云南5个典型高原湖泊沉水植物群落组成及其与环境因子的关系
2024-01-01朱利明张道熙史方邹曦张志永胡莲


摘要:通过对云南中部5个典型高原湖泊沉水植物和水环境状况进行野外调查,研究该区域主要沉水植物群落组成及其与环境因子的关系,为云南高原湖泊沉水植被保护和管理提供理论参考。综合营养状态指数计算表明,所选取的5个湖泊中,异龙湖、杞麓湖和星云湖属于富营养湖泊,抚仙湖和阳宗海属于贫-中营养湖泊。调查共发现沉水植物6科10属15种,微齿眼子菜(Potamogeton maackianus)和穿叶眼子菜(P. perfoliatus)在贫-中营养湖泊中为主要优势种,穗花狐尾藻(Myriophyllum spicatum)和篦齿眼子菜(P. pectinatus)在各营养类型湖泊中均能成为优势种或亚优势种,轮叶黑藻(Hydrilla verticillata)、菹草(P. crispus)和金鱼藻(Ceratophyllum demersum)仅在富营养湖泊中成为优势种。沉水植物多样性分析表明,抚仙湖的香农-威纳多样性指数(H')最高,平均值达到1.63;杞麓湖的H'最低,平均值仅0.79,总体来说,贫-中营养湖泊的沉水植物多样性要高于富营养湖泊。沉水植物群落物种与水环境因子的冗余分析(redundancy analysis, RDA)结果显示,透明度(SD)、pH、硝氮(NO3--N)是影响这些不同营养水平湖泊沉水植物分布特征的关键环境因子,pH、氨氮(NH4+-N)、水温(WT)是影响贫-中营养湖泊沉水植物分布特征的关键环境因子,WT、电导率(SPC)、叶绿素a(Chl-a)是影响富营养湖泊沉水植物分布特征的关键环境因子。研究对于恢复、保护和管理该区域湖泊沉水植物具有重要指导意义。
关键词:高原湖泊;沉水植物;空间分布;环境因子;冗余分析
中图分类号:Q178.1" " " " 文献标志码:A" " " " 文章编号:1674-3075(2024)05-0039-10
沉水植物是淡水湖泊生态系统主要的初级生产者,在湖泊物质循环和能量流动中发挥着重要作用,是维持湖泊清水稳态的关键(Wang et al,2016)。沉水植物生命活动对湖泊环境因素的变化非常敏感,水体营养盐浓度、底泥类型、水文水动力条件、浊度、透明度、溶解氧、水深等诸多环境因子都与沉水植物的群落组成与空间分布密切相关(Nakamura et al,2008;Bornette amp; Puijalon,2011;孔祥虹等,2015)。近些年来,随着社会经济的快速发展,湖泊富营养化日益加重,我国多个湖泊沉水植物群落演替剧烈,群落组成和优势物种发生了明显的改变,最终导致生物量锐减、多样性减少,湖泊生态系统功能受到严峻挑战(Sachse et al,2014)。
湖泊富营养化会导致水生植物群落结构发生变化,这与富营养水体本身对水生植物的胁迫、富营养促进浮游植物与水生植物之间的竞争以及富营养促进单一物种的大量繁殖扩散等因素有关(Kalff,2002)。富营养化引起水生植物群落退化、生物多样性降低的内在机理是不同水生植物对水环境的适应范围存在差异(吴爱平等,2005;游灏,2006),耐受范围小、生态位宽度窄的物种对水环境的变化更为敏感。有沉水植物存在的水域水质通常较好。有研究表明,沉水植物具有富集水体污染物的功能,在富营养化水体修复过程中起到净化水质、维持水生态系统健康的作用(Carpenter amp; Lodge,1986)。当前,国内外众多学者在沉水植被恢复重建领域开展了大量研究,光照强度(李文朝和连光华,1996)、营养盐(Horppila amp; Nurminen,2005;金相灿等,2007)、底质(谢贻发等,2007)、浊度(王文林等,2006)、温度(Barko amp; Smart,1981;闫志强等,2014)等因素对沉水植物的生长至关重要,共同影响沉水植物的群落组成与分布(王华等,2008)。因此,研究沉水植物群落组成及分布格局与水环境因子的关系具有重要意义。
云南是我国淡水湖泊资源最为集中的地区之一,其湖泊主要分布在断裂带或各大水系的分水岭地带,具有海拔较高、湖岸陡峻、面积小而水深的特点(曾理等,2009),兼具调节气候、水量,提供生产生活用水、水产养殖产品,美化环境和发展旅游的功能(蓝红林,2001)。这些湖泊多为源头型湖泊,其生态状况同时影响着当地和下游平原地区的生态环境(杨柳和黄耀志,2002)。然而,随着该地区工农业的发展以及长期不合理的湖泊资源开发,云南高原湖泊生态环境遭到严重破坏,富营养化严重,水体营养梯度日益明显,生态系统日益退化,这一系列问题已引起众多学者和社会的关注(颜昌宙等,2005)。以往的调查多由不同研究者单独进行,对多个湖泊同时期沉水植物分布情况了解不足。为了深入了解云南高原湖泊沉水植物群落组成及分布格局,本文对云南5个典型高原湖泊沉水植物进行了系统调查,比较分析该区域沉水植物的区系特征,探明沉水植被现状,对影响沉水植物分布的水环境因子进行解析,辨识关键影响因子,以期为云南高原湖泊沉水植被保护和管理提供理论参考。
1" "材料与方法
1.1" "研究区域
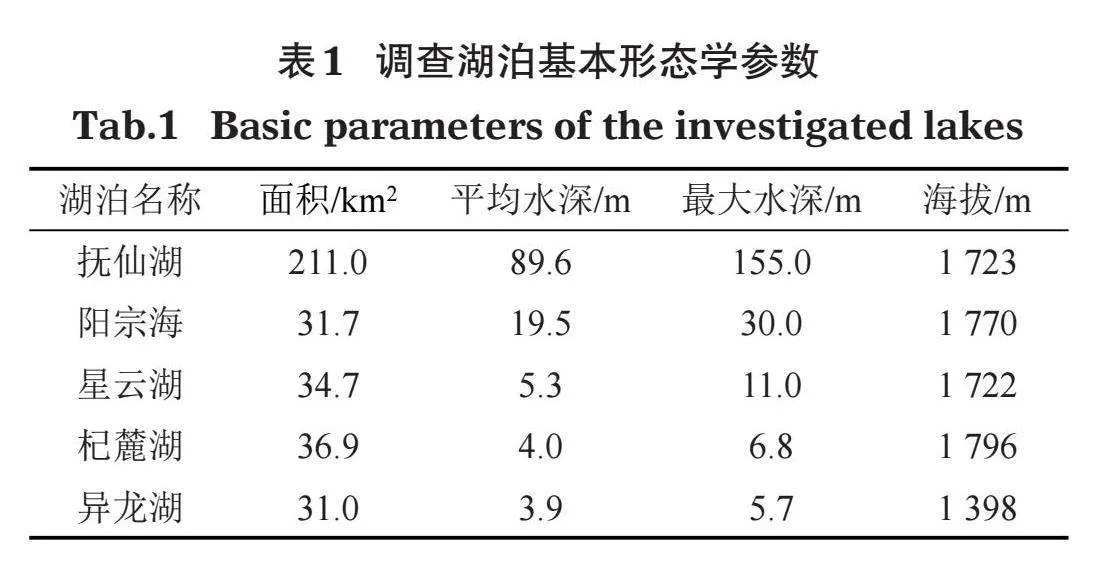
分别于2020年和2021年9-10月对云南中部5个典型高原湖泊进行2个年度的沉水植物调查(图1)。根据所选湖泊大小、受干扰程度以及沉水植物实际分布情况设置采样点,对沉水植物的群落组成及水环境因子进行调查。其中,抚仙湖(FXH)和阳宗海(YZH)沉水植物主要局限于环湖湖岸带一周,因此调查时沿湖岸带设置采样点(沈亚强等,2010;高弋明等,2021)。星云湖(XYH)、杞麓湖(QLH)和异龙湖(YLH)由于水生态环境较差,沉水植物分布面积和生物量已大为减少,并呈现向岸边萎缩和分布不均匀的趋势(沈亚强等,2010),同样采用环湖设置采样点的方法进行调查。其中,抚仙湖设置4个采样点,星云湖、杞麓湖、阳宗海和异龙湖各设置3个采样点。各湖泊的基本形态学特征见表1。
1.2" "环境因子的测定
现场采用透明度盘测定透明度(SD),用YSI多参数水质监测仪测定水体水温(WT)、pH、电导率(SPC)、氧化还原电位(ORP)、溶解氧(DO)、盐度(Sal)等参数,采集表层水样带回实验室分析总氮(TN)、总磷(TP)、氨氮(NH4+-N)、硝氮(NO3--N)、磷酸盐(PO43-)、叶绿素a(Chl-a)和高锰酸盐指数(CODMn),水体化学指标的测定参考《水和废水监测分析方法》(国家环境保护总局,2002)。
1.3" "沉水植物的采集及处理
深水区使用0.5 m×0.5 cm的采草器随机采集3次;岸边浅水区使用面积为 0.5 m×0.5 m 的铝制样方框确定采样区域,徒手采集样方框内所有植物,采集3次。采集到的沉水植物及时冲洗干净、分类、称重,以湿重代表生物量。
以往研究多使用植物株数密度来计算物种多样性指数,但沉水植物由于其特殊的生物学特性,绝大部分种类多通过分枝或分蘖的方式进行繁殖,而不是简单地通过增加株数来扩大种群生物量。因此,本文参考Jeppesen等(2000)的方法,使用生物量来计算沉水植物的优势度和多样性指数,即用相对生物量(RB)与相对频度(RF)来计算物种的优势度(DV):
DV=(RB + RF)/2×100%" " " ①
用香农-威纳多样性指数(H')计算公式如下:
H' = -[i=1Sbib lnbib]" " " " "②
式中:bi为群落中i物种生物量;b为群落中所有沉水植物的生物量之和;S为该群落总物种数。
1.4" "湖泊营养程度评价方法
采用综合营养指数(TLI)法评价湖泊富营养化(金相灿,1995;王明翠等,2002)。计算公式为:
TLI(Chl-a)=10(2.5+1.086 ln Chl-a)" "③
TLI(TP)=10(9.436+1.624 ln TP)" " "④
TLI(TN)=10(5.453+1.694 ln TN)" " ⑤
TLI(SD)=10(5.118-1.94 ln SD)" " ⑥
TLI(∑)=W(Chl-a)·TLI(Chl-a)+W(TP)·TLI(TP)+W(TN)·TLI(TN)+W(SD)·TLI(SD)" " " " "⑦
式中:W(Chl-a)、W(TP)、W(TN)和W(SD)分别为0.3260、0.2300、0.2192和0.2246。采用0~100的一系列连续数字对湖泊营养状态进行分级:TLI(∑)≤30为贫营养;30lt;TLI(∑)≤50为中营养;50lt;TLI(∑)≤60为轻度富营养;60lt;TLI(∑)≤70为中度富营养;70lt;TLI(∑)≤100为高度富营养。
1.5nbsp; "数据分析
利用One-way ANOVA对不同湖泊环境因子变量均值进行分析(Plt;0.05),在进行方差分析前,对数据进行了方差齐性分析和正态分布分析,若方差齐性,选择LSD检验,反之使用Tamhane's检验(Plt;0.05),用SPSS19.0软件进行分析,origin 9.0进行作图。运用R 4.1.3中的vegan包分析沉水植物优势度与环境因子的关系。在数据进行排序分析前,对物种数据和环境因子数据进行标准化处理(ErO\"s et al,2012),再进行去趋势对应分析(detrended correspondence analysis, DCA)以确定排序模型(Braak amp; Smilauer,2002)。采用方差膨胀因子(variance inflation factor,VIF)分析,剔除共线性强的环境因子(VIFgt;10);Pearson相关分析进一步剔除强相关性环境因子(rgt;0.7);采用蒙特卡洛检测方法检验环境因子对植物影响的显著性,保留Plt;0.05的环境因子(Blanchet et al,2008)。
2" "结果与分析
2.1" "水环境现状
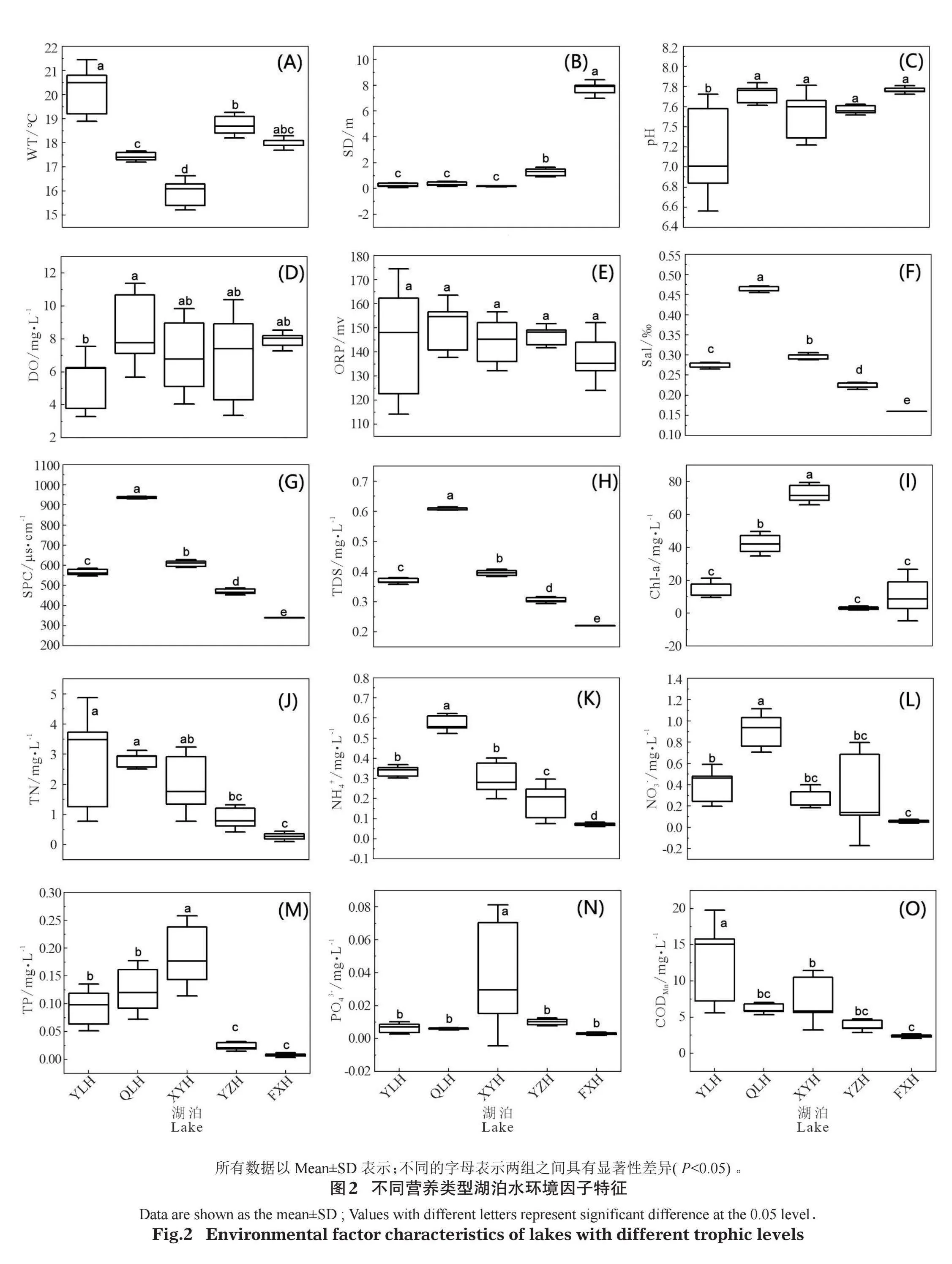
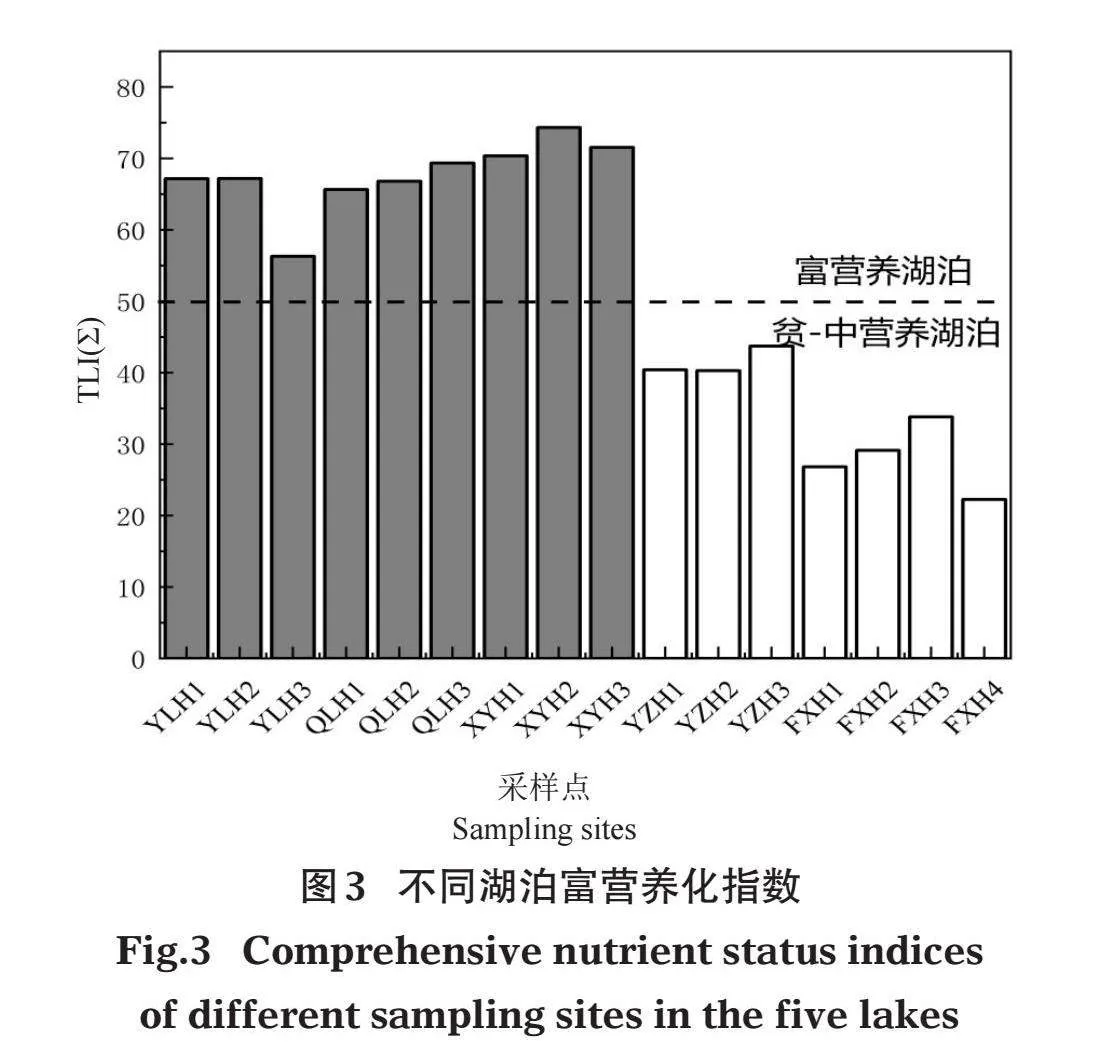
不同营养类型湖泊水环境因子特征如图2。从中可以看出,异龙湖、杞麓湖、星云湖和阳宗海4个湖泊的WT差异显著(Plt;0.05),异龙湖最高,星云湖最低,抚仙湖与异龙湖WT具有显著差异(Plt;0.05),其他湖泊差异不显著(图2A)。Sal、SPC、TDS 3个指标在不同湖泊间具有显著差异(Plt;0.05),表现为杞麓湖gt;星云湖gt;异龙湖gt;阳宗海gt;抚仙湖(图2F、2G、2H)。阳宗海和抚仙湖的SD显著大于杞麓湖、星云湖和异龙湖(P<0.05)(图2B)。杞麓湖、星云湖和异龙湖TN、NH4+-N、TP显著大于抚仙湖(Plt;0.05)(图2J、2K、2M),pH、DO、ORP、PO43-、CODMn等水环境因子在各湖泊之间差异不大(图2C、2D、2E、2N、2O)。综合营养状态指数法计算表明,异龙湖、杞麓湖和星云湖属于富营养湖泊,营养指数分别为63.55±6.28、67.26±1.89和72.08±2.04;抚仙湖和阳宗海属于贫-中营养湖泊,营养指数分别为28.01±4.82和41.47±1.96(图3)。
2.2" "沉水植物群落现状
本次共调查到沉水植物6科10属15种,包括苦草(Vallisneria natans)、大茨藻(Najas marina)、篦齿眼子菜(Potamogeton pectinatus)、穿叶眼子菜(P. perfoliatus)、光叶眼子菜(P. lucens)、角果藻(Pteridophyta)、金鱼藻(Ceratophyllum demersum)、丽藻属(Nitella)、轮叶黑藻(Hydrilla verticillata)、轮藻属(Chara)、马来眼子菜(P. wrightii)、穗花狐尾藻(Myriophyllum spicatum)、微齿眼子菜(P. maackianus)、伊乐藻(Elodea nuttallii)和菹草(P. crispus)。
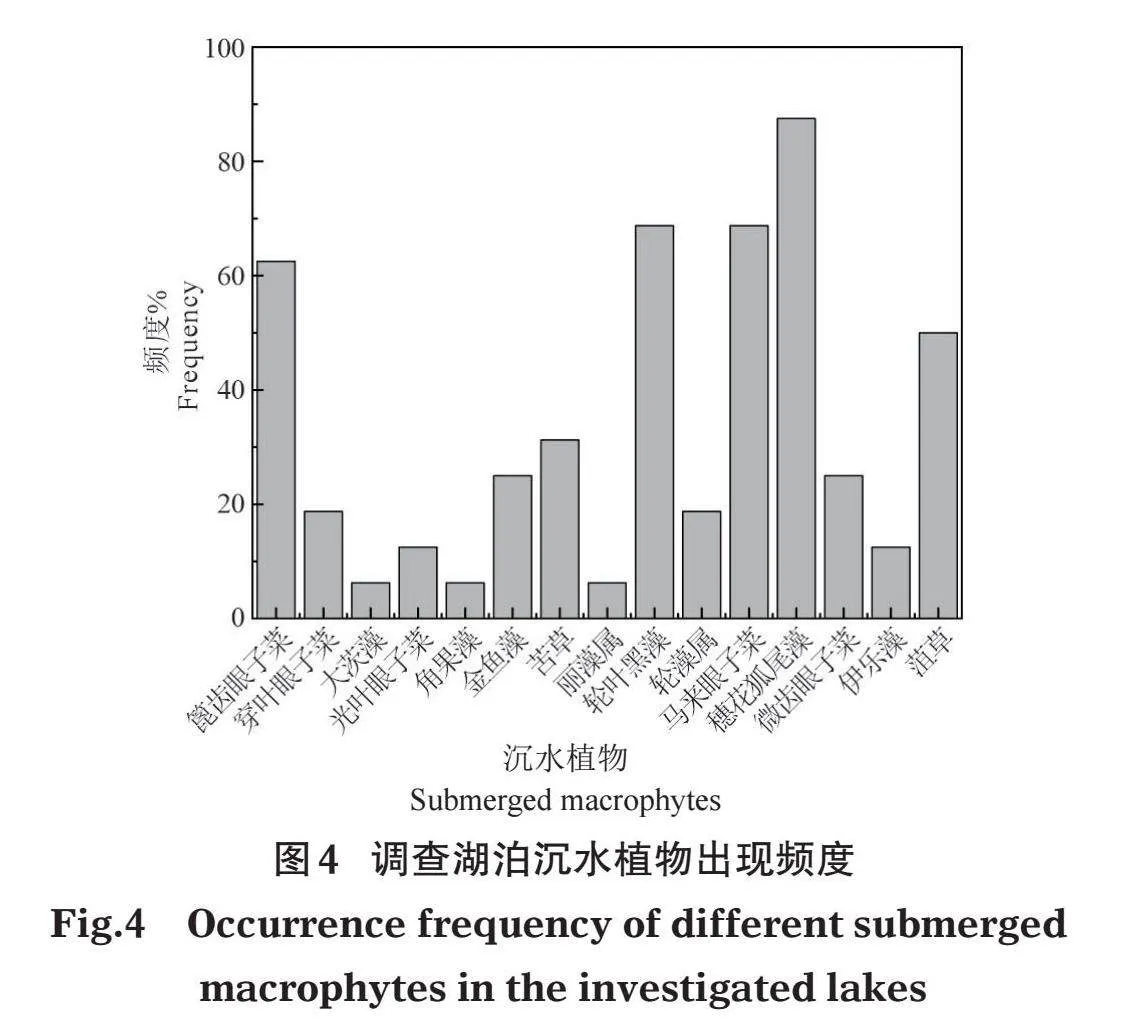
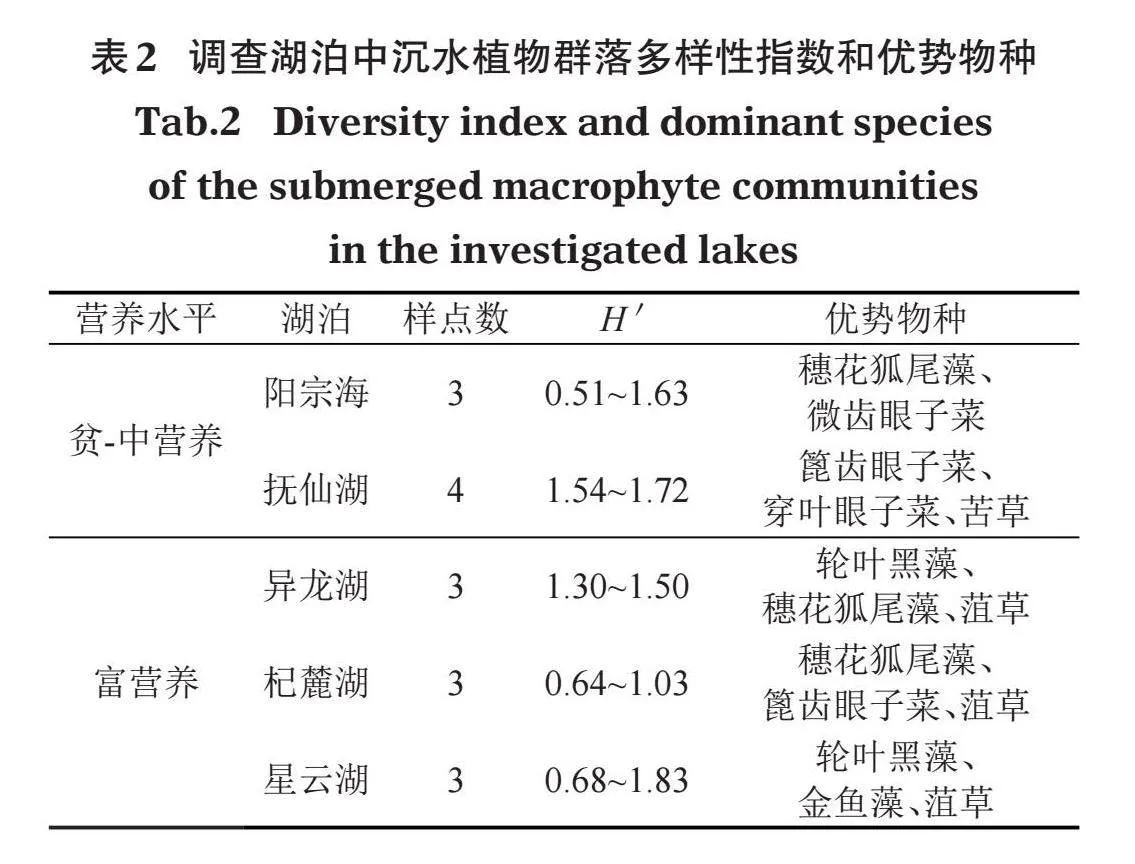
云南高原湖泊中沉水植物的主要优势种为穗花狐尾藻、微齿眼子菜、轮叶黑藻、穿叶眼子菜、菹草、篦齿眼子菜和苦草。不同营养类型湖泊沉水植物优势种有所不同,微齿眼子菜和穿叶眼子菜为贫-中营养湖泊的优势种,穗花狐尾藻和篦齿眼子菜在各营养类型湖泊中均能成为优势种或亚优势种,轮叶黑藻、菹草和金鱼藻仅在富营养湖泊中成为优势种(表2)。沉水植物多样性分析表明,抚仙湖的香农-威纳多样性H'最高,平均值达到1.63;杞麓湖的H'最低,平均值仅0.79。总体来说,贫-中营养湖泊的沉水植物多样性要大于富营养湖泊。在16个样点中,出现频率最高的是穗花狐尾藻,为87.5%;最低是大茨藻、角果藻和丽藻属,为6.25%(图4)。
2.3" "沉水植物群落物种与环境因子的关系
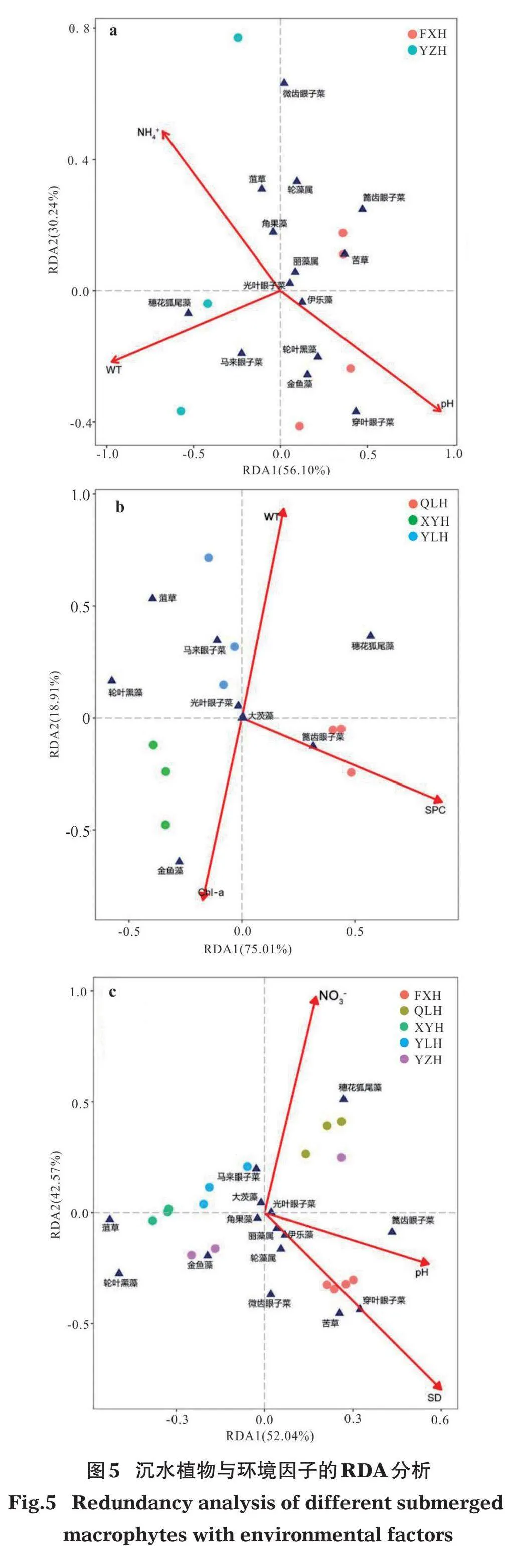
DCA结果表明,各排序轴的最大梯度长度(LOG)为:贫-中营养湖泊1.87、富营养湖泊3.67、整体湖泊2.99,都lt;4,符合线性模型,因此本研究统一选用RDA分析方法。分析显示,贫-中营养湖泊、富营养湖泊、整体湖泊的第1、2轴共解释物种与环境因子之间累计方差为86.34%、93.92%、94.61%,说明排序结果可以很好地解释沉水植物群落组成与环境因子的关系(图5)。
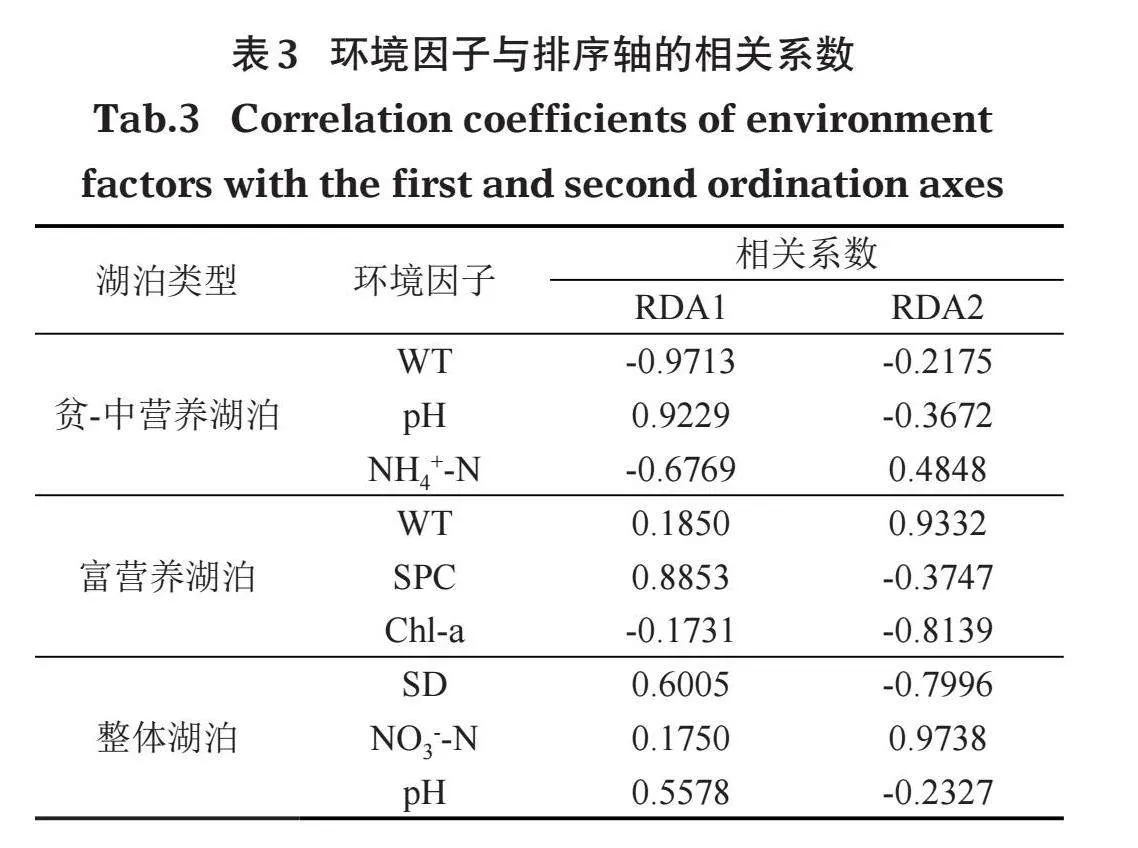
蒙特卡洛置换检验分析表明,贫-中营养湖泊中15个环境变量中只有3个变量对解释沉水植物群落组成与环境因子的关系做出了显著贡献(即Plt; 0.05)。其中,穿叶眼子菜、轮叶黑藻、金鱼藻与pH呈显著正相关,与NH4+-N呈显著负相关;菹草、角果藻、轮藻属和微齿眼子菜与NH4+-N呈显著正相关,与pH呈显著负相关;马来眼子菜和穗花狐尾藻与WT呈显著正相关,篦齿眼子菜、苦草和轮藻属与WT呈显著负相关(图5a)。环境因子与坐标轴的相关系数越高则表明环境因子对物种的相关性越强,影响越大,由表3可以看出,pH、NH4+-N、WT是影响贫-中营养湖泊沉水植物分布特征的主要因子。
富营养湖泊RDA分析中,通过蒙特卡洛置换检验预选出符合条件的环境因子为WT、SPC、Chl-a,其中,轮叶黑藻、菹草和马来眼子菜与SPC呈显著负相关,穗花狐尾藻和篦齿眼子菜与SPC呈显著正相关;金鱼藻与Chl-a呈显著正相关,与WT呈显著负相关;穗花狐尾藻、马来眼子菜、菹草与WT呈显著正相关,与Chl-a呈显著负相关(图5b)。环境因子与坐标轴的相关系数表明,WT、SPC、Chl-a是影响富营养湖泊沉水植物分布特征的主要因子(表3)。
整体湖泊RDA分析表明,SD、NO3--N、pH为蒙特卡洛置换检验预选出的环境因子。其中,穿叶眼子菜、苦草、篦齿眼子菜、微齿眼子菜、轮藻属、伊乐藻和丽藻属分别与pH和SD呈显著正相关;菹草、轮叶黑藻、金鱼藻以及马来眼子菜分别与pH和SD呈显著负相关;穗花狐尾藻和马来眼子菜与NO3--N呈显著正相关;穿叶眼子菜、苦草、篦齿眼子菜、微齿眼子菜、轮藻属、伊乐藻、丽藻属、金鱼藻和轮叶黑藻都与NO3--N呈显著负相关(图5c)。环境因子与坐标轴的相关系数表明,SD、NO3--N、pH是影响整体湖泊沉水植物分布特征的主要因子(表3)。
3" "讨论
3.1" "沉水植物群落组成变化
本研究通过综合营养状态指数法计算表明,异龙湖、杞麓湖和星云湖属于富营养湖泊,抚仙湖和阳宗海属于贫-中营养湖泊(图3)。调查共发现沉水植物6科10属15种,其中优势种包括穗花狐尾藻、微齿眼子菜、篦齿眼子菜、穿叶眼子菜、轮叶黑藻、菹草和苦草。微齿眼子菜和穿叶眼子菜在贫-中营养湖泊中可以成为优势种,穗花狐尾藻和篦齿眼子菜在各营养湖泊中均能成为优势种或亚优势种,轮叶黑藻、菹草和金鱼藻仅能在富营养湖泊中成为优势种(表2)。导致这种分布现象的原因可能包括:(1)环境因素。已有研究表明水生植物的生长受水深、水温、光照强度、营养盐、水文水动力条件、底质类型等众多环境因子共同作用,水生生境条件对水生植物的物种组成及分布具有显著的影响(秦伯强,2002)。(2)人为因素。社会、经济、工农业的发展以及长期以来对湖泊资源的不合理开发,造成云南地区湖泊生态环境严重破坏,湖泊富营养化严重,湖泊生态系统日益退化(颜昌宙等,2005)。
已有研究发现,异龙湖水环境在21世纪90年代后逐渐恶化,2009年异龙湖水质类别甚至达到劣Ⅴ类,水生生态系统发生剧烈变化,平均透明度为0.22 m,综合营养状态指数为78.13,同年进行的该湖泊水生植物调查显示沉水植物已完全消失(魏翔和唐光明,2014)。本研究调查异龙湖的综合营养状态指数为63.55±6.28,仍属于中度富营养状态,沉水植物虽有所恢复,但多以耐污种(穗花狐尾藻和篦齿眼子菜)为主,这与方馨等(2021)的研究结果一致。1970年代以来,受周边围湖造田以及农业面源污染的长期影响,杞麓湖水生生态系统遭到严重破坏,对水质要求非常严格的海菜花(Ottelia acuminata)、水鳖(Hydrocharis dubia)群落、荇菜(Nymphoides peltatum)群落等已相继消失,对水质要求较高的竹叶眼子菜群落分布面积巨减,穗花狐尾藻、菹草等耐污种群落逐渐增多,成为优势类群(沈亚强等,2010),本研究调查也发现穗花狐尾藻、篦齿眼子菜、菹草为杞麓湖的主要优势种。已有资料显示,随着星云湖周边畜禽养殖业生产规模的扩大,畜禽粪便污染已成为星云湖水环境的重要的污染源(邱成和叶春丽,2015)。另有研究认为,星云湖周边农田施用的化学用剂污染及大量食草鱼类放养等因素影响其水质质量,导致湖内植物群落类型单一,仅有少数对环境要求较低的植物得以生存(李恒,1980)。本次调查发现星云湖综合营养状态指数为72.08±2.04,属于高度富营养状态,间接导致该湖泊沉水植物生物多样性较低,轮叶黑藻、金鱼藻、菹草等耐污种为主要优势种(表2),这与杨加林等(2012)的研究结果一致。
3.2" "沉水植物与环境因子的关系
本研究结果发现,在水体营养盐水平差异不大的情况下(中营养湖泊和富营养湖泊),WT成为影响沉水植物分布的主要因子(图5a和图5b),且在富营养湖泊中,沉水植物物种多样性随着温度的升高而增加(表2)。已有研究表明,水温和沉积物温度都会影响水生植物分布及其群落结构特征(Rooney amp; Kalff,2000;Spencer et al,2000;Heino,2002)。温度可对水体盐度、营养盐含量和气体含量产生明显的影响,在水生态系统的物理、化学和生物过程中发挥着重要作用(Welch,1952)。较高的水温会增加水体的蒸发量,降低水体溶解氧,从而增加许多水生物种的含盐量,增加其生存压力(Al-Thahaibawi et al,2021)。本研究发现富营养湖泊异龙湖,其较高的水温导致了较低的水体溶解氧和盐度(图2),这也是导致该湖泊沉水植物物种多以耐污种为主的原因。
SPC是影响富营养湖泊沉水植物分布的另一主要环境因子(图5b)。水体SPC的变化与水位、蒸发量都有显著的关系(Al-Kenzawi et al,2011),此外,农业活动面源污染也可能导致夏季水体SPC过高(Al-Shawi,2006)。已有研究表明,自1970年代以来,杞麓湖一直受周边围湖造田和农业面源污染的影响,使得竹叶眼子菜群落分布面积锐减,穗花狐尾藻、菹草群落等耐污种逐渐蔓延(沈亚强等,2010;邱成和叶春丽,2015)。本研究调查发现,杞麓湖水体SPC显著大于其他4个湖泊(Plt;0.05)(图2),耐盐能力较强的穗花狐尾藻(刘萌萌等,2019)、篦齿眼子菜(王卫红和季民,2007)为主要优势物种。
pH是沉水植物生存与繁衍的重要环境因子,其通过改变水体溶解无机碳的平衡关系,进而影响水生植物的生长和分布(任南等,1996;何俊等,2008)。已有研究表明,穗花狐尾藻、篦齿眼子菜在pH值为7.5~8.8时对HCO3-形式的碳源都表现出较强的利用能力,从而能适应高pH的水环境(苏睿丽和李伟,2005;刘玲玲,2011)。本次调查的5个云南高原湖泊的pH值平均范围为7.14~7.77,穗花狐尾藻和篦齿眼子菜为主要优势种和亚优势种,也证实了这一结论。以往研究还发现,当pH为7~9时,轮叶黑藻更易在富营养状态水体中生长(张浏等,2007),本次调查结果与其一致,即在富营养湖泊(异龙湖、星云湖)中轮叶黑藻更易成为优势类群。
由于沉水植物整个生活史大部分位于水中,底质和水体中氮元素可直接被其根系和叶片吸收,其中NH4+-N和NO3--N两类基础无机氮源最易被吸收利用(段娜等,2015)。本研究中湖泊NH4+-N和NO3-的平均浓度为0.28 mg/L和0.37 mg/L,其中富营养湖泊NH4+-N为0.40 mg/L、NO3--N为0.53 mg/L,贫-中营养湖泊NH4+-N为0.12 mg/L、NO3--N为0.17 mg/L。已有研究表明,在一定范围内,较高的氮素浓度有利于马来眼子菜的生长(苏睿丽和李伟,2005)。本研究发现马来眼子菜与NO3--N浓度呈显著正相关(图5c),其在富营养湖泊异龙湖中更容易成为优势物种。
水下光照条件是沉水植物进行正常光合作用的重要前提,是影响沉水植物在天然水体中生长的主要因素(王华等,2008)。已有研究表明,沉水植物可正常生长的水深通常为水体SD的2~2.5倍(邱成和叶春丽,2015)。本研究发现,水体SD是影响云南高原湖泊沉水植物分布最关键的环境因子(图5c);贫-中营养湖泊(抚仙湖和阳宗海)的SD要显著大于富营养湖泊(Plt;0.05),其中抚仙湖的SD为(7.77±0.03)m(图2)。由于沉水植物对光和空间的竞争能力不同,可粗分为草甸型植物和冠层型植物2类(James et al,2004)。其中,草甸型植物具有茎或分枝短、植冠低矮、生长较慢的生物学特征,绝大部分生活在沉积物附近,对光和生存空间具有相对较弱的竞争能力,如轮藻类、苦草、篦齿眼子菜和微齿眼子菜等物种;相反,冠层型植物具有较长的茎或分枝,其植冠高大、生长迅速,可生长到水面附近,对光和空间的具有较强的竞争能力,如穗花狐尾藻、黑藻和金鱼藻等物种(Gopal amp; Usha,1993)。由于抚仙湖、阳宗海具有较高的SD,故苦草、篦齿眼子菜、穿叶眼子菜和微齿眼子菜等草甸型沉水植物可以在该类型湖泊中成为优势种。
沉水植物的生长分布与水环境因子是相互影响的。草甸型植物比冠层型植物更有利于维持湖泊的清水稳态(Carpenter amp; Lodge,1986;Rehman et al,2016)。草甸型沉水植物多具有相对稠密的须根,且绝大部分生活在沉积物附近,能有效阻止沉积物向水体释放营养盐,显著提升沉积物滞留营养盐的能力(Kufel amp; Kufel,2002;James et al,2004)。冠层型沉水植物生长较快,其衰败腐烂时会释放大量腐殖质和营养盐进入水体,导致浮游植物快速繁殖,引起透明度下降(Engelhardt amp; Ritchie,2001;Hilt et al,2006)。因此,当沉水植物类型的转变,也预示着湖泊营养水平的转变(da Silva et al,2014)。另外,水环境因子之间也是相互影响、相互制约的,单个环境因子可以通过影响其他环境因子进而影响沉水植物的生长和分布。因此,在研究影响水生植物生长分布的环境因子时,应当综合考虑各环境因子之间的内在联系,全面系统分析水生植物与环境因子的关系。
综合本次调查研究结果,提出以下建议:(1)针对类似本研究的贫-中营养类型湖泊,要遵循沉水植物的生物学特征和生长规律,及时收割清除高大的冠层型沉水植物,创造草甸型沉水植物的生长条件,促进沉水植物群落向贫营养化湖泊的群落结构方向发展;(2)针对类似本研究的富营养类型湖泊,其沉水植物恢复的关键要控制水体营养盐浓度,抑制藻类的生长,采用不同的恢复方法,选取不同的植物种类来制定沉水植物的恢复方案。
参考文献
段娜, 章尧想, 刘芳, 等, 2015. 植物氮素吸收及其转运蛋白研究进展[J].分子植物育种, 13(2): 461-468.
方馨, 赵风斌, 柴晓利, 等, 2021. 异龙湖沉水植物分布格局与水环境因子相关性研究[J].长江流域资源与环境," 30(3): 636-643.
国家环境保护总局," 2002. 水和废水监测分析方法[M].4版. 北京: 中国环境科学出版社.
高弋明, 殷春雨, 刘霞, 等, 2021. 抚仙湖近60年来沉水植物群落变化趋势分析[J].湖泊科学, 33(4): 1209-1219.
何俊, 谷孝鸿, 刘国锋, 2008. 东太湖水生植物及其与环境的相互作用[J]. 湖泊科学, 20(6): 47-49.
金相灿, 1995. 中国湖泊环境[M]. 北京: 海洋出版社.
金相灿, 楚建周, 王圣瑞, 2007. 水体氮浓度、形态对黑藻和狐尾藻光合特征的影响[J].应用与环境生物学报, 13(2): 200-204.
孔祥虹, 肖兰兰, 苏豪杰, 等, 2015. 长江下游湖泊水生植物现状及与水环境因子的关系[J].湖泊科学, 27(3): 385-391.
蓝红林, 2001. 云南高原湖泊的治理与保护初探[J].云南环境科学, 20(4): 26-28.
李恒, 1980. 云南高原湖泊水生植被的研究[J].云南植物研究, 2(2): 113-141.
李文朝, 连光华, 1996. 几种沉水植物营养繁殖体萌发的光需求研究[J]. 湖泊科学," 8(增刊1): 25-29.
刘玲玲, 2011. 三种沉水植物无机碳利用机制研究[D].武汉:华中师范大学.
刘萌萌, 刘巧," 杨娜," 等, 2019. 沉水植物穗花狐尾藻耐盐性与生长[J].生态学杂志, 38(3): 778-784.
秦伯强, 2002. 长江中下游浅水湖泊富营养化发生机制与控制途径初探[J].湖泊科学, 14(3): 193-202.
邱成, 叶春丽, 2015. 浅析江川县发展生态畜牧业与星云湖水环境保护[C]. 中国环境科学学会环境经济学分会2015年学术年会.
任南, 严国安, 马剑敏, 等, 1996. 环境因子对东湖几种沉水植物生理的影响研究[J].武汉大学学报(自然科学版), 42(2): 213-218.
沈亚强, 王海军, 刘学勤, 2010. 滇中五湖水生植物区系及沉水植物群落特征[J]. 长江流域资源与环境, 19(增刊1): 111-119.
苏睿丽, 李伟, 2005. 沉水植物光合作用的特点与研究进展[J].植物学通报, 22(增刊1): 128-138.
王华, 逄勇, 刘申宝, 等, 2008. 沉水植物生长影响因子研究进展[J].生态学报," 28(8): 3958-3968.
王明翠, 刘雪芹, 张建辉, 2002. 湖泊富营养化评价方法及分级标准[J].中国环境监测, 18(5): 47-49.
王卫红, 季民, 2007. 9种沉水植物的耐盐性比较[J].农业环境科学学报, 26(4): 1259-1263.
王文林, 王国祥, 李强, 等, 2006. 水体浊度对菹草(Potamogeton cripus)幼苗生长发育的影响[J].生态学报, 26(11): 3586-3593.
魏翔, 唐光明, 2014. 异龙湖近20年来营养盐与水生生态系统变化[J].环境科学导刊, 33(2): 9-14.
吴爱平, 吴世凯, 倪乐意, 2005. 长江中游浅水湖泊水生植物氮磷含量与水柱营养的关系[J].水生生物学报," 29(4): 406-412.
谢贻发, 李传红, 刘正文, 等, 2007. 基质条件对苦草(Vallisneria natans)生长和形态特征的影响[J].农业环境科学学报, 26(4): 1269-1272.
杨加林, 李杰, 李经纬, 等, 2012. 抚仙湖-星云湖水生生物与水环境研究综述[J].云南地理环境研究, 24(2): 98-102.
杨柳, 黄耀志, 2002. 云南高原湖区综合发展研究[J].重庆大学学报(社会科学版)," 8(3): 19-21.
颜昌宙, 金相灿, 赵景柱, 等, 2005. 云南洱海的生态保护及可持续利用对策[J]. 环境科学, 26(5): 38-42.
闫志强, 刘黾, 吴小业, 等, 2014. 温度对五种沉水植物生长和营养去除效果的影响[J].生态科学, 33(5): 839-844.
游灏, 2006. 五种沉水植物对富营养化水体的生态适应性研究[D].南京:南京农业大学.
张浏, 陈灿, 高倩, 等," 2007. 两种营养状态下pH对轮叶黑藻(Hydrilla verticillata)生长和抗氧化酶活性的影响[J].生态环境, 16(3): 748-752.
曾理, 吴丰昌, 万国江, 等, 2009. 中国地区湖泊沉积物中137Cs分布特征和环境意义[J].湖泊科学, 21(1): 1-9.
Al-Kenzawi M," Al-Haidary M," Talib A H," et al," 2011. Environmental study of some water characteristics at Um-Al-Naaj Marsh," south of Iraq[J]. Baghdad Science Journal," 8(1): 531-538.
Al-Thahaibawi B," Al-Abbawy D," Al-Mayaly I," et al," 2021. The effect of some environmental variables on the abundance and distribution of aquatic macrophytes in Al-Hawizeh marsh," Iraq[J]. IOP Conference Series: Earth and Environmental Science," 722(1): 012001.
Al-Shawi I," 2006. Comparative study of some physico-chemical characteristics for Northern Al-Hammar marsh waters before destroyed and after Rehabilitation 2004[J]. Marsh Bulletin," 2:127-133.
Barko J W," Smart R M," 1981. Comparative influences of light and temperature on the growth and metabolism of selected submersed freshwater macrophytes[J]. Ecological Monographs," 51(2): 219-235.
Blanchet F G," Legendre P," Borcard D," 2008. Forward selection of explanatory variables[J]. Ecology," 89(9): 2623-2632.
Bornette G," Puijalon S," 2011. Response of aquatic plants to abiotic factors: a review[J]. Aquatic Sciences," 73(1): 1-14.
Carpenter S R," Lodge D M," 1986. Effects of submersed macrophytes on ecosystem processes[J]. Aquatic Botany," 26: 341-370.
da Silva S C A D," Cervi A C," Bona C," et al," 2014. Aquatic macrophyte community varies in urban reservoirs with different degrees of eutrophication[J]. Acta Limnol Bras," 26(2): 129-142.
Engelhardt K," Ritchie M E," 2001. Effects of macrophyte species richness on wetland ecosystem functioning and services[J]. Nature," 411(6838): 687-689.
EeO\"s T," S[a][']ly P," Tak[a][']cs P," et al," 2012. Temporal variability in the spatial and environmental determinants of functional metacommunity organization-stream fish in a human-modified landscape[J]. Freshwater Biology," 57(9): 1914-1928.
Gopal B," Usha G," 1993. Competition and allelopathy in aquatic plant communities[J]. The Botanical Review," 59(3): 155-210.
Heino J," 2002. Concordance of species richness patterns among multiple freshwater taxa: a regional perspective[J]. Biodiversity amp; Conservation," 11(1):137-147.
Hilt S," Gross E," Hupfer M," et al," 2006. Restoration of submerged vegetation in shallow eutrophic lakes: a guideline and state of the art in Germany[J]. Limnologica- Ecology and Management of Inland Waters," 36(3): 155-171.
Horppila J," Nurminen L," 2005. Effects of different macrophyte growth forms on sediment and P resuspension in a shallow lake[J]. Hydrobiologia," 545(1): 167-175.
James W F," Barko J W," Butler M G," 2004. Shear stress and sediment resuspension in relation to submersed macrophyte biomass[J]. Hydrobiologia," 515(1/2/3): 181-191.
Jeppesen E," Jensen J P," M Søndergaard," et al," 2000. Trophic structure," species richness and biodiversity in Danish lakes: changes along a phosphorus gradient[J]. Freshwater Biology," 45(2): 201-218.
Kalff Jacob," 2002. Limnology: Inland Water Ecosystems[M].Prentice Hall," NJ: Benjamin Cummings.
Kufel L," Kufel I," 2002. Chara beds acting as nutrient sinks in shallow lakes: a review[J]. Aquatic Botany," 72(3/4): 249-260.
Wang H," Wang Q," Bowler P A," et al," 2016. Invasive aquatic plants in China[J]. Aquatic Invasions," 11(1): 1-9.
Nakamura K," Kayaba Y," Nishihiro J," et al," 2008. Effects of submerged plants on water quality and biota in large-scale experimental ponds[J]. Landscape amp; Ecological Engineering," 4(1): 1-9.
Rehman F," Pervez A," Khattak B N," et al," 2016. Constructed wetlands: perspectives of the oxygen released in the rhizosphere of macrophytes[J]. Clean-Soil," Air," Water," 45(1).DOI:10.1002/clen.201600054.
Rooney N," Kalff J," 2000. Inter-annual variation in submerged macrophyte community biomass and distribution: the influence of temperature and lake morphometry[J]. Aquatic Botany," 68(4): 321-335.
Sachse R," Petzoldt T," Blumstock M," et al," 2014. Extending one-dimensional models for deep lakes to simulate the impact of submerged macrophytes on water quality[J]. Environmental Modelling amp; Software," 61: 410-423.
Spencer D F," Ksander G G," Madsen J D," et al," 2000. Emergence of vegetative propagules of Potamogeton nodosus," Potamogeton pectinatus," Vallisneria americana," and Hydrilla verticillata based on accumulated degree-days[J]. Aquatic Botany," 67(3): 237-249.
Welch P S," 1952. Limnology[M]. New York: McGraw Hill Book Company.
(责任编辑" "郑金秀)
Community Composition of Submerged Macrophytes and Relationship
with Environmental Factors in Five Yunnan Plateau Lakes
ZHU Li‐ming, ZHANG Dao‐xi, SHI Fang, ZOU Xi, ZHANG Zhi‐yong, HU Lian
(Key Laboratory of Ecological Impacts of Hydraulic-Projects and Restoration of Aquatic Ecosystem
of Ministry of Water Resources, Institute of Hydroecology, Ministry of Water Resources amp; Chinese
Academy of Sciences, Wuhan" "430079, P.R. China)
Abstract:Many studies have suggested that restoration of the submerged plant community is an important means for controlling lake eutrophication. Therefore, it is important to study the composition and distribution of the submerged plant communities in lakes and the relationship with the water environment factors. In this study, five typical plateau lakes in central Yunnan Province were selected for research, including Yilong Lake (YLH), Qilu Lake (QLH), Xingyun Lake (XYH), Fuxian Lake (FXH) and Yangzonghai lake (YZH). We investigated the composition and distribution of submerged macrophytes communities in the five lakes, and the relationship between the distribution of submerged macrophytes and water environmental factors. A two-year investigation of submerged plants and water environment factors were conducted in the five lakes during September and October of 2020 and 2021. The comprehensive nutrient status indices of Yilong Lake, Qilu Lake and Xingyun Lake were 63.55±6.28, 67.26±1.89 and 72.08±2.04, respectively, indicating an eutrophic state, and the comprehensive nutrient status indices of Fuxian Lake (FXH) and Yangzonghai Lake (YZH) were 28.01±4.82 and 41.47±1.96, respectively, indicating an oligotrophic-mesotrophic state. A total of 15 submerged macrophyte species belonging to 6 families and 10 genera were identified during the investigation. Myriophyllum spicatum, P. pectinatus were dominant species in all lakes, Potamogeton maackianus and P. perfoliatus were dominant in the oligotrophic-mesotrophic lakes, and Hydrilla verticillata, P. crispus and Ceratophyllum demersum were dominant in the eutrophic lakes. The Shannon-Weiner diversity (H') index of the submerged macrophytes in FXH was highest, with an average value of 1.63, while the diversity index of QLH was lowest, with an average value of only 0.79. In general, submerged macrophyte diversity was higher in the oligotrophic-mesotrophic lakes than in the eutrophic lakes. Redundancy analysis of the submerged plants and the environmental factors shows that transparency, pH and NO3--N were the key factors affecting the distribution of submerged macrophytes in lakes with different nutrient levels; pH, NH4+-N and WT were the key factors in oligotrophic-mesotrophic lakes; and WT, conductivity and Chl-a were the key factors in eutrophic lakes. In conclusion, we identified the key water environmental factors affecting the distribution of submerged macrophytes in lakes on the Yunnan Plateau, which will provide guidance for the restoration, protection and management of submerged macrophytes in lakes in Yunnan plateau lakes.
Key words: plateau lakes; submerged macrophytes; spatial distribution; environmental factors; redundancy analysis
