2016—2018年东莞地区耐碳青霉烯类肠杆菌目细菌的耐药表型、耐药机制和分子流行病学分析
2024-01-01郭主声吕飞谢树金黄亚林偲思徐宝华冯剑波冯森何芬周谋清
郭主声 吕飞 谢树金 黄亚 林偲思 徐宝华 冯剑波 冯森 何芬 周谋清
摘要:目的 通過研究东莞地区的耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacteriaceae, CRE)的耐药情况和基因分型,研究耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)的亲缘性、耐药机制和blaKPC-2基因环境,为临床寻找控制和治疗该致病菌的更优方案提供参考。方法 回顾性收集2016年1月—2018年12月东莞市人民医院、东莞东华医院、康华医院、东莞市中医院和东莞市妇幼保健院等十三所医院的住院患者的CRE菌株进行常规微生物培养、鉴定和药敏试验。以美罗培南或亚胺培南纸片法(K-B法)或最小抑菌浓度(MIC)测定法对肠杆菌目细菌进行初筛;采用改良Hodge试验、亚胺培南-EDTA双纸片协同试验和CIM试验检测CRE产酶情况;聚合酶链式反应(polymerase chain reaction, PCR)检测并鉴定CRE的碳青霉烯类耐药基因(blaKPC、blaNDM、blaIMP、blaDHA、blaCTX-M和blaCMY),以及CRKP的多位点序列分型(multilocus sequence typing, MLST)和孔蛋白(OmpK35、OmpK36和OmpK37);通过Junction PCR、Mapping PCR和Crossing PCR检测blaKPC-2基因环境;使用WHONET 5.6软件统计分析CRE临床分离株在标本和科室中的分布与耐药情况,以及碳青霉烯酶基因在科室中的分布情况。结果 从37217株肠杆菌目细菌中共检出131株CRE(占0.35%),其中肺炎克雷伯菌79株(占60.31%)、大肠埃希菌21株(占16.03% )和阴沟肠杆菌12株(占9.16%);检出CRE的临床科室主要为ICU(66株,占50.38%);在检出CRE的标本中,位于前3位分别是痰液标本(56株,占42.75%)、尿液标本(21株,占16.03%)、伤口分泌物标本(12株,占9.16%);CRE对目前临床中常使用的抗菌药物表现出高耐药性,仅对阿米卡星耐药率较低,为21.38%。检测104株CRE(包括肺炎克雷伯菌、大肠埃希菌和阴沟肠杆菌)发现的碳青霉烯酶有KPC-2型(57,54.81%)、NDM-1型(7株,6.73%)和NDM-5型(2株,1.92%);其中,CRKP主要为ST11型(49株,占62.03%),其次为ST1型(25株,占31.65%);ompK35(75株,占94.94%)、ompK36(77株,占97.47%)和ompK37(79株,占100%)发生突变的占比高;blaKPC-2的基因环境主要为B1型突变型(38株,占48.10%),其次为A型突变型(14株,占17.72%)。 结论 2016—2018年东莞地区临床CRE检出率为0.35%,耐药性强,其中,CRKP主要为ST11型,主要流行的是KPC-2型,其基因环境为B1型突变型,而且孔蛋白突变占比极高,这提示东莞地区blaKPC-2基因主要通过质粒进行传播,并且孔蛋白突变在CRE中发挥重要作用,院内感染医务工作者应根据该菌科室分布、耐药情况和耐药机制等特点,采取合理有效的预防和治疗方法。
关键词:耐碳青霉烯类肠杆菌目细菌;耐碳青霉烯类肺炎克雷伯菌;多位点序列分型;孔蛋白;blaKPC-2;基因环境
中图分类号:R978.1 文献标志码:A
Analysis of drug resistance phenotype, drug resistance mechanism and molecular epidemiological of carbapenem-resistant Enterobacteriaceae in Dongguan from 2016 to 2018
Guo Zhusheng, Lü Fei, Xie Shujin, Huang Ya, Lin Sisi, Xue Baohua, Feng Jianbo,
Feng Sen, He Fen, and Zhou Mouqing
(Dongguan Tungwah Hospital, Dongguan 523110)
Abstract Objective To provides a reference for better clinical control and treatment of such pathogenic bacteria in Dongguan by studying the drug resistance and genotyping of carbapenem-resistant Enterobacteriaceae (CRE), and the affinity, the drug resistance mechanism, and the blaKPC-2 gene environment of carbapenem-resistant Klebsiella pneumoniae (CRKP). Methods CRE from 13 hospitals including Dongguan People's Hospital, Dongguan Tungwah Hospital, Kanghua Hospital, Dongguan Traditional Chinese Medicine Hospital, and Dongguan Maternal and Child Health Hospital et al, were collected retrospectively for routine microbial culture, and identification and drug sensitivity tests from January 2016 to December 2018. Gram negative Enterobacteriaceae were screened by the meropenem or imipenem disk method (the K-B method) or the minimum inhibitory concentration (MIC) method. Enzyme production of carbapenem resistant Enterobacteriaceae was detected by the modified Hodge test, the imipenem EDTA double disk synergy test, and the CIM test. The detection and identification of carbapenem resistance genes (blaKPC, blaNDM, blaIMP, blaDHA, blaCTX-M, and blaCMY) of CRE, multi-locus sequence typing (MLST), and the detection of porins (OmpK35, OmpK36 and OmpK37) of CRKP were performed to analyze the affinities and the drug resistance mechanism by polymerase chain reaction (PCR); Simultaneously, the blaKPC-2 gene environment was detected by junction PCR, mapping PCR, and crossing PCR. The WHONET 5.6 software was used to analyze the distribution and drug resistance of CRE clinical isolates in specimens and departments, as well as the distribution of carbapenemase genes in departments. Results A total of 131 strains of CRE (0.35%) were detected from 37,217 strains of Enterobacteriaceae, including 79 Klebsiella pneumoniae (60.31%), 21 Escherichia coli (16.03%), and 12 Enterobacter cloacae (9.16%). The main clinical departments detected CRE were ICU (66 strains, accounting for 50.38%). The top three samples of CRE were sputum (56 strains, 42.75%), urine (21 strains, 16.03%), and wound secretion (12 strains, 9.16%). Through drug resistance analysis, this study found that CRE showed high drug resistance to antibiotics commonly used in clinic, and only low drug resistance to amikacin (21.38%). The carbapenemases found in 104 CRE strains (including Escherichia coli, Klebsiella pneumoniae, and Enterobacter cloacae) were KPC-2 (57 strains, accounting for 54.81%), NDM-1 (7 strains, accounting for 6.73%), and NDM-5 (2 strains, accounting for 1.92%); CRKP was mainly the ST11 type (49 strains, accounting for 62.03%), followed by the ST1 type (25 strains, accounting for 31.65%); The porins (ompK35, ompK36, and ompK37) had a high proportion of mutations which accounted 94%, 97.47%, and 100%, respectively; the gene environment of blaKPC-2 was mainly B1 mutant (38 strains, accounting for 48.10%), followed by a mutant (14 strains, accounting for 17.72%). Conclusion From 2016 to 2018, the detection rate of clinical CRE in Dongguan was 0.35%, and the drug resistance was strong. Among them, CRKP was mainly the ST11 type, and the KPC-2 type was mainly prevalent. Its genetic environment was B1 type mutation, and the percentage of porin mutation was very high, which suggested that the blaKPC-2 gene in Dongguan was mainly transmitted through plasmids, and the porin mutation played an important role in CRE. Hospital infection medical workers should take reasonable and effective prevention and treatment methods according to the distribution of the bacteria departments, the characteristics of drug resistance, and the drug resistance mechanism.
Key words Carbapenem-resistant Enterobacteriaceae; Carbapenem-resistant Klebsiella pneumoniae; Multi-locus sequence typing; Porins; blaKPC-2; Genetic environment
肠杆菌目细菌是自然界和人体中广泛存在的一种机会致病菌,常引起尿路感染、腹腔感染、败血症、胆道感染、肺部感染等多种部位感染。目前,已经证实肠杆菌目细菌可以长期存在于人体的呼吸道和肠道,其中最常见的是肺炎克雷伯菌和大肠埃希菌[1]。耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacteriaceae, CRE)对于临床中经常使用的抗菌药物表现出广泛的耐药性,感染者临床表现严重,死亡率高。
近些年,在全球范围内由CRE引起的感染呈现逐年增高的趋势;在国内,感染CRE的患者数量也逐年增高[2]。起初,针对CRE的感染,临床采取的有效治疗手段是应用碳青霉烯类抗菌药物,但是随着抗生素的广泛应用,肺炎克雷伯菌等几种常见的肠杆菌目细菌逐渐对临床中频繁使用的几种抗菌药物产生了耐药性[3],这给临床治疗CRE的感染带来了巨大挑战。
为了应对这个挑戰,在东莞地区,2014年11月市卫计委和市医院感染管理质量控制中心牵头成立了东莞耐药监测网,要求全市所有医院分离到疑似CRE,应按《东莞地区医疗机构耐碳青霉烯类肠杆菌感染预防与控制指引(试行)》的要求将菌株送到质控中心复核[4]。为了明确东莞地区2016年以来耐碳青霉烯类肠杆菌目细菌对临床中常见抗菌药物的耐药变化情况,本研究收集了2016年1月—2018年12月东莞市人民医院、东莞东华医院、康华医院、东莞市中医药和东莞市妇幼保健院等13所医院从住院患者分离的CRE,对菌株类型、菌株来源、药敏试验结果和临床科室分布进行分析,并且使用PCR扩增和测序方法对CRE的常见的碳青霉烯类耐药基因(blaKPC、blaNDM、blaIMP、blaDHA、blaCTX-M和blaCMY)进行检测,并检测CRKP的MLST、ompK35、ompK36和ompK37,以及blaKPC-2基因环境,分析其亲缘性、孔蛋白突变情况和blaKPC-2基因环境。从而更好地了解本地区CRE的菌株类型分布和耐药情况,以及CRKP的碳青霉烯酶型、亲缘性、耐药机制和blaKPC-2基因环境,为临床合理规范使用抗菌药物提供准确依据,指导我市各级医院临床医师更加准确的“经验性”用药,指导院感管理防控措施的制定,避免耐药菌株的传播流行。
1 材料与方法
1.1 实验菌株
2016年1月—2018年12月,连续从东莞市人民医院、东莞东华医院、康华医院、东莞市中医药和东莞市妇幼保健院等13所医院的住院患者的37217株细菌中检出非重复的131株CRE菌株。
1.2 仪器与试剂
VITEK 2 Compact全自动细菌鉴定药敏系统分析仪系统及配套GN鉴定卡(法国Bio Mérieux公司),AST-GN09和AST-GN355药敏板卡(法国Bio Mérieux公司),3730XL测序仪(美国Applied Biosystems公司),Verity 96well PCR仪(美国Applied Biosystems公司),FR-980A凝胶成像仪(上海复日科技有限公司),M-H琼脂平板和药敏纸片(江门凯琳生物科技有限公司),亚胺培南-EDTA双纸片(上海原科实业有限公司),PrimeSTAR? Max DNA Polymerase(宝日医生物技术(北京)有限公司),SanPrep柱式DNA胶回收试剂盒(生工生物工程(上海)股份有限公司),Ezup柱式细菌基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司)。
1.3 菌株鉴定方法
细菌的分离培养按照《全国临床检验操作规程(第4版)》[5]操作进行,首先分离并纯化疑似细菌,使用VITEK 2 Compact全自动细菌鉴定药敏系统分析仪鉴定到种,可疑结果根据菌落生长形态、革兰染色、镜下形态和相应的生化试验复核。以美罗培南或亚胺培南纸片法(K-B法)或最小抑菌浓度(MIC)测定法对菌株进行初筛并记录耐药情况,对于碳青霉烯类药物其中1种不敏感的肠杆菌目细菌鉴定为CRE。初筛耐药的菌株采用改良Hodge试验、亚胺培南-EDTA双纸片协同试验和CIM试验检测耐碳青霉烯类肠杆菌目细菌的产酶情况[4]。药敏试验按2021年CLSI版标准判断结果[6]。
1.4 药敏试验质控菌株
实验所采用的质控标准菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC700603、肺炎克雷伯菌ATCC BAA-1705和肺炎克雷伯菌ATCC BAA-1706,均购自国家卫生健康临床检验中心。
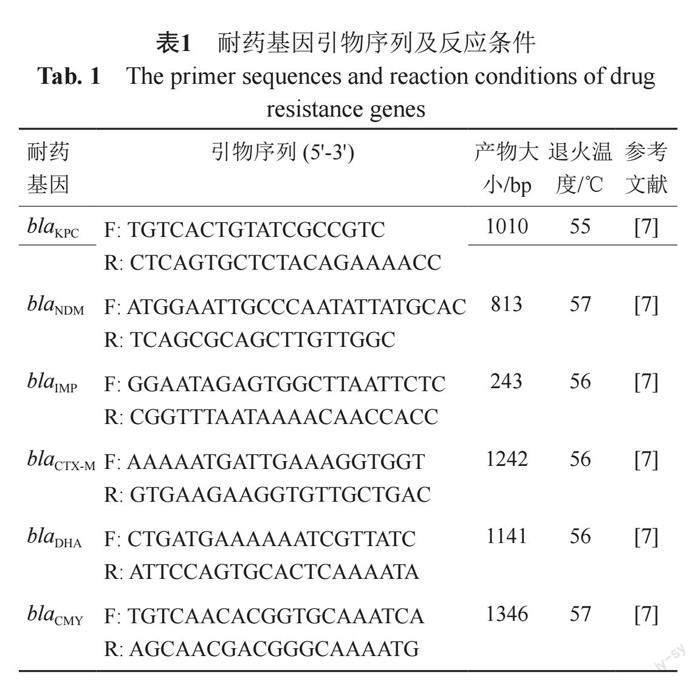
1.5 碳青霉烯类耐药基因的检测
将筛选获得的CRE采用PCR扩增的方法,对blaKPC、blaNDM、blaIMP、blaDHA、blaCTX-M和blaCMY等常见的耐碳青霉烯类基因进行扩增测序(扩增引物详见表1)。反应体系为25 μL:目的基因1 μL,上、下游引物各1 μL,PrimeSTAR? Max DNA Polymerase 12.5 μL,ddH2O 9.5 μL。PCR扩增条件为:预变性98 ℃ 30 s;变性98 ℃ 10 s,退火55 ℃ 5 s,延伸72℃ 5 s,30个循环;终延伸72 ℃ 5 min。
1.6 统计学方法
使用WHONET 5.6软件对细菌鉴定及药敏试验结果进行统计处理和分析。
1.7 CRKP的MLST和孔蛋白序列检测
使用7对管家基因引物(rpoB、gapA、mdh、pgi、phoE、infB和tonB)[8],和孔蛋白引物[9]对CRKP进行PCR扩增并测序;基于单核苷酸多态性(single-nucleotide polymorphisms, SNPs),使用CGE在线网站的CSIPhylogeny在线工具(https://cge.food.dtu.dk/services/CSIPhylogeny/)绘制CRKP的进化树,并使用iTOL在线工具(https://itol.embl.de/)对进化树进行修饰。
1.8 blaKPC-2基因环境检测
使用junction PCR、mapping PCR和crossing PCR的引物[10]对CRKP的blaKPC-2基因环境进行PCR扩增,并测序。
2 结果
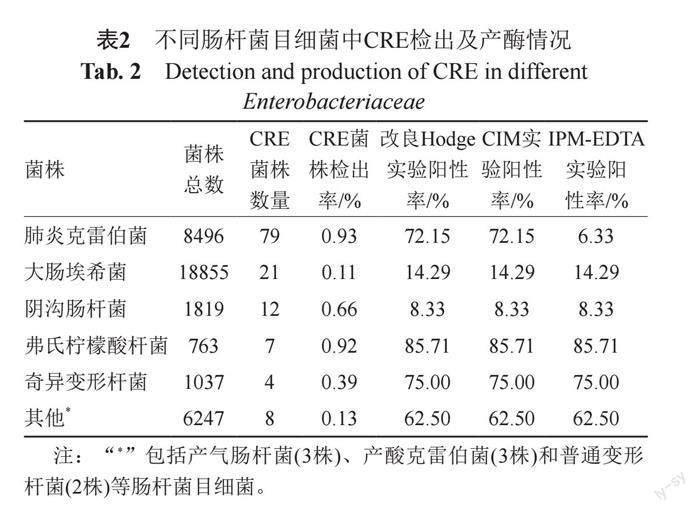
2.1 不同肠杆菌目细菌中CRE检出及产酶情况
从37217株细菌中检出131株CRE(占比0.35%),其中肺炎克雷伯菌79株、大肠埃希菌21株和阴沟肠杆菌12株。不同肠杆菌目细菌中CRE检出率、改良Hodge试验、CIM试验和亚胺培南-EDTA双纸片协同试验阳性率见表2。
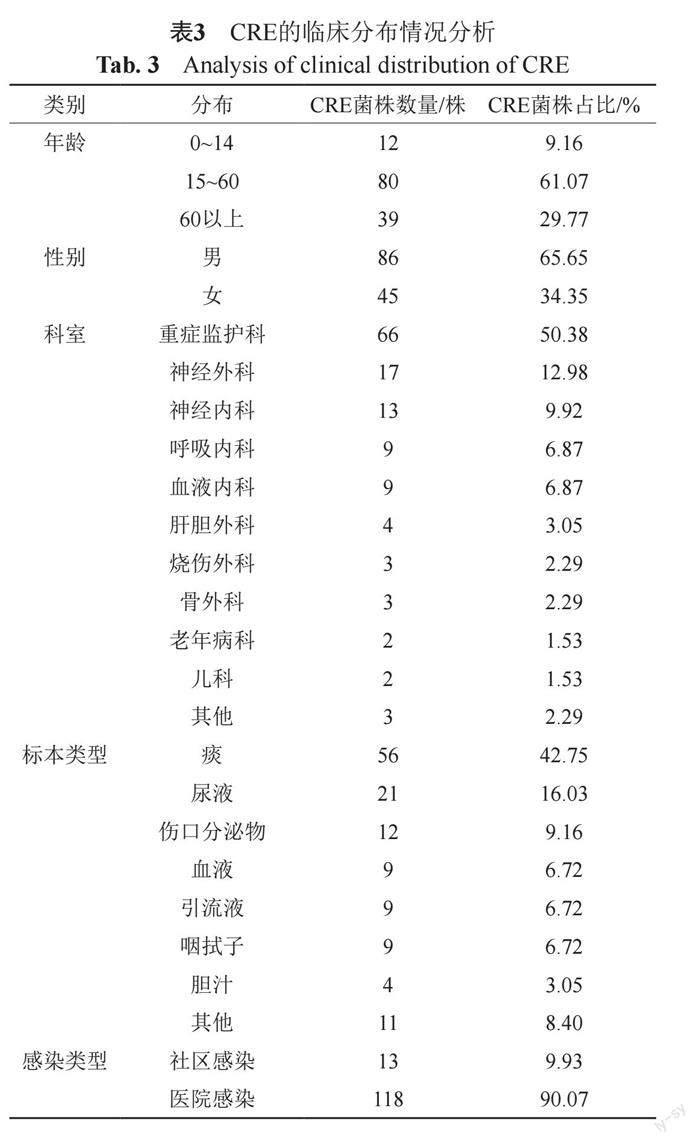
2.2 菌株的临床分布情况分析
分离CRE前3位的标本分别是痰液标本、尿液标本和伤口分泌物标本,其次为血液标本、各部位引流液标本和咽拭子标本。CRE感染科室前3位分别是重症医学科、神经外科和神经内科,其次为呼吸内科、血液内科和肝胆外科等,感染类型判断标准参照《医院感染诊断标准》[11]进行(表3)。
2.3 CRE对常用抗菌药物的耐药情况
从104株做耐药基因检测的CRE药敏结果分析可知:亚胺培南耐药率为100.00%,美罗培南耐藥率为91.12%;耐药率低于30%的药物仅有阿米卡星(21.38%);耐药率在50%~60%的只有妥布霉素(53.30%)和庆大霉素(59.04%);而临床广泛使用的氟喹诺酮类、第三代头孢菌素及其含酶抑制剂等药物耐药率超过80%(表4)。
2.4 CRE的碳青霉烯类耐药基因分型
通过检测104株属于肺炎克雷伯菌、大肠埃希菌和阴沟肠杆菌的CRE的碳青霉烯类耐药基因,发现东莞地区的碳青霉烯酶基因主要为为KPC-2,其次为NDM-1和NDM-5型(表5)。
2.5 CRKP的同源性和孔蛋白突变分析
在79株CRKP中,最主要的MLST分型为ST11型(49株,占62.03%),其次为ST1型(25株,占31.65%),然后是ST15、ST307、ST2368、ST2536和ST5253各1株,共占6.32%(详见图1);产KPC-2型碳青霉烯酶的有57株(占72.15%),产NDM-1型的有5株(占6.33%),不产碳青霉烯酶的有17株(占21.52%);ompK35发生缺失突变的有64株(占81.01%),发生提前终止突变的有11株(占13.92%),未发生突变的有4株(占5.07%);ompK36发生(第134和135位增加G和D)插入突变有41(占51.90%),发生缺失突变的有26株(占32.91%),发生319-325位插入突变的有8株(占10.13%),未发生突变的有2株(占2.53%),发生移码突变的有2株(占2.53%);ompK37发生I70M和I128M点突变的有77株(占97.47%),发生移码突变的有2株(占2.53%)(详见图1)。
2.6 blaKPC-2基因环境分析
通过Junction PCR、Mapping PCR和Crossing PCR,本研究发现,东莞地区的blaKPC-2的基因环境主要为B1型突变型(38株,占66.67%),其次为A型突变型(14株,占24.56%),最后为B1型(5株,占8.77%),与A型(pKP048,GenBank号:FJ628167.2)和B1型(pKPHS2,GenBank号:CP003224.1)均不一致;其中,B1型突变型可以扩增出M1-M5和J4部分,J1和J5部分扩增失败,这表明B1型的Tn1721的IRR和IS26发生缺失;A型突变型可以扩增出M1-M5、J3和J4部分,J1和M6部分扩增失败,这表明A型Tn1721的IRR发生缺失,M6部分发生IS26插入突变(图2)。
3 讨论
肠杆菌目细菌在近3年已经成为了各地区临床科室中最常见的分离菌株,随着多重耐药甚至泛耐药的CRE检出数量增加,CRE感染的控制及治疗对于临床来说越来越棘手[12]。目前,世界范围内对于CRE的预防、临床控制及治疗方案并没有达成共识,临床往往根据药敏试验,选择合适的抗菌药物及用药途径。目前治疗轻、中度CRE的感染,多选择单用敏感的药物治疗;对于重度细菌感染,采用两种以上敏感药物联合治疗[13]。
目前研究认为肠杆菌目细菌对碳青霉烯类抗菌药物的耐药机制主要有3种:①细菌自身分泌的碳青霉烯酶可水解碳青霉烯类抗菌药物,国内主要流行的是KPC和IMP酶;②高产AmpC头孢菌素酶或超广谱β-内酰胺酶合并孔道蛋白缺失或表达降低导致的外膜通透性降低;③碳青霉烯类药物作用位点PBP蛋白改变[14]。本研究发现:在104株CRE中,未检测到碳青霉烯类耐药基因(blaKPC、blaNDM、blaIMP、blaDHA、blaCTX-M和blaCMY等常见的耐药基因)但表现出对碳青霉烯类抗菌药物耐药的有38株(占36.54%),这可能与第二或者第三种耐药机制有关。
本次研究发现:CRE检出率较高的主要分布在成年人、男性、重症医学科(ICU)、年龄为5M~86Y。15~64岁检出80株,占61.07%;男性检出86株,65.65%;66株分离于重症医学科(50.38%),与相关报道一致[15];检出CRE的标本中以呼吸道标本为主,其次是尿液和伤口分泌物,这与国内报道一致[16-17];来源于院内感染的有118株(90.07%),源自社区感染的有13株(9.93%)。其中因为CRE感染导致死亡的有6例(5.31%),这低于相关报道的10%~72%[18],表明临床的治疗措施比较正确,但导致病情加重的有92例(70.23%),这给患者造成极大的伤害,也给临床治疗带来很大的麻烦。同时也再次提醒我们超级耐药细菌的预防与控制不仅仅是限于各级医院,社区卫生服务站、药店和畜牧业的抗菌药物的监管同样责无旁贷[19]。
本研究发现,感染CRE的患者多数在ICU,认为这与重症监护室的患者普遍年龄较高、病情复杂严重、住院时间久、抗生素应用频繁和免疫力低下等因素有关。同时,由于重症监护室的患者往往需要机器辅助通气,会接受气管插管甚至气管切开等有创性操作,这也增加了ICU患者感染CRE的风险[20]。有研究表明,导致患者感染CRE的危险因素较多,临床中较常见的是外科手术等有创的侵袭性操作、插置尿管和患者频繁更换病房床位以及频繁使用广谱抗菌药物等[15]。有研究报道:对于既往合并多种基础病的患者,预防院内获得性感染比感染后治疗更重要[21]。因此,需要医务人员注意的是,在给患者用药时要详细评估患者情况,根据药敏结果选择合适抗生素,尽量减少侵袭性操作,同时提高所有医务人员对于预防感染防控的基本意识[15]。
在本文的相关研究可以发现,CRE检出率较高的菌株主要为肺炎克雷伯菌、大肠埃希菌和阴沟肠杆菌,这与相关报道较为一致[17]。目前已经明确CRE对临床中使用频率较高的几种抗菌药物均表现为高水平耐药,对亚胺培南耐药率为100.00%,对美罗培南耐药率为91.12%,耐药率低于30%的药物仅有阿米卡星,耐药率在50%~60%只有妥布霉素和庆大霉素,而临床广泛使用的氟喹诺酮类、第三代头孢菌素及其含酶抑制剂等药物耐药率均超过80%,这提示临床针对疑似CRE感染的经验性用药可以选择阿米卡星,其余抗菌药物的效果微乎其微。第三代头孢菌素及其含酶抑制剂等药物耐药率相对较高,可能与东莞地区各三级医院应用头孢噻肟、哌拉西林/他唑巴坦较早,其他抗菌药物应用时间相对较短有关。在多重耐药菌高检出率时期,抗菌药物选择的多样性是有必要的,继续加强碳青霉烯类特殊级抗菌药物的使用限制,尤其是重视第三代头孢菌素和氟喹诺酮类药物的管理与合理使用,对遏制CRE超级细菌的产生有着深远的意义[16]。
本研究发现,东莞地区主要流行的是ST11型CRKP,这与ST11型肺炎克雷伯菌缺少CRISPR-Cas系统和限制修饰系统,易于获得外源性基因和质粒有关[22];东莞地区主要流行的为KPC-2型碳青霉烯酶,有研究表明,国外的blaKPC-2的基因环境主要为A型,国内其他地区主要为B1型[10],然而,本研究发现,东莞地区blaKPC-2的基因环境主要为B1型突变型(66.67%),Tn1721和IS26缺失,意味着除了质粒以外,blaKPC-2不能通过转座子和插入元件进行转移;除此之外,孔蛋白的突变也会引起细菌对碳青霉烯类耐药,在79株CRKP中,ompK36发生插入突变的区域为L3区,可改变OmpK36蛋白的孔径,ompK37发生点突变,均可降低碳青霉烯类抗生素的渗透率[23];ompK35、ompK36和ompK37同时突变可导致细菌对厄他培南耐药,而β-内酰胺酶联合孔蛋白突变,可导致细菌对亚胺培南和美罗培南耐药[24]。东莞地区的主要流行的blaKPC-2基因环境不同于其他地区,这可能与在东莞地区流行的携带blaKPC-2的质粒类型有关;除了产碳青霉烯酶以外,孔蛋白突变结合β-内酰胺酶导致细菌对碳青霉烯类耐药占比也较高,容易导致临床使用碳青霉烯酶抑制剂治疗此类CRE感染效果不佳。因此,临床医生在做好CRE感染的预防、控制和治疗的同时,医务相关部门还应加强环境清洁及病房消毒工作,减少CRE的扩散和blaKPC-2基因传播,严格把控各种抗菌药物的使用指征及流程,杜绝抗生素滥用,建立规范CRE感染的预警及管理制度[16]。
综上所述,从菌株类型的分布来看,东莞地区的CRE主要以肺炎克雷伯菌和大肠埃希菌为主,检出率高的临床科室是ICU,主要流行的是KPC-2型碳青霉烯酶,基因环境为B1突变型,主要通过质粒进行传播。CRE对临床的多种常用抗菌药物的耐药性高,因此,对于各临床科室尤其是重症监护室,要加强对CRE的监测,医务工作者要熟悉患者临床资料,准确掌握感染细菌的种类及耐药情况,合理选择抗菌药物。
参 考 文 献
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-30.
张鸿娟, 孟雪斐, 马志刚, 等. 无菌体液中耐碳青霉烯肠杆菌科细菌的临床分布及耐药性分析[J]. 检验医学与临床, 2022, 19(4): 438-442.
员静, 单斌, 孟雪斐, 等. 2018—2020年多中心耐碳青霉烯类肠杆菌目细菌的流行病学特征及耐药性分析[J]. 中国抗生素杂志, 2021, 46(11): 1038-1043.
郭主声, 朱学海, 周谋清, 等. 东莞地区耐碳青霉烯类肠杆菌科细菌的临床分布及耐药性[J]. 中国感染控制杂志, 2017, 16(11): 1040-1043.
尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. (第4版). 北京: 人民卫生出版社, 2015.
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年耐碳青霉烯類肺炎克雷伯菌流行病学变迁[J]. 中国感染控制杂志, 2021, 20(2): 175-179.
Han R, Shi Q Y, Wu S, et al. China Antimicrobial Surveillance Network (CHINET) study group. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbiol, 2020, 10: 314.
Wyres K L, Lam M M C, Holt K E. Population genomics of Klebsiella pneumoniae[J]. Nat Rev Microbiol, 2020, 18(6): 344-359.
Liao X P, Yang R S, Xia J, et al. High colonization rate of a novel carbapenem-resistant Klebsiella lineage among migratory birds at Qinghai Lake, China[J]. J Antimicrob Chemother, 2019, 74(10): 2895-2903.
Klein S, Boutin S, Sp?th I, et al. Acquisition and transmission of carbapenemase-producing (blaKPC-2) Enterobacter cloacae in a highly frequented outpatient clinic[J]. Clin Infect Dis, 2021, 72(5): e158-e161.
中華人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320.
陈慧君, 朱齐兵, 叶丽君, 等. 耐碳青霉烯类肠杆菌科细菌的分布及耐药性分析[J]. 中国医药, 2020, 15(6): 953-956
张琴, 许健, 宋培培. 儿童患者检出耐碳青霉烯类抗菌药物肠杆菌科细菌分布特征及耐药性分析[J]. 中国抗生素杂志, 2020, 45(12): 1273-1278.
任艳丽, 王云英, 蒋敏, 等. 不同碳青霉烯酶酶型肠杆菌科细菌感染的治疗策略研究[J]. 中国抗生素杂志, 2021, 46(4): 339-345.
王俊, 高凯杰, 张玲. 2015—2017年某儿童医院耐碳青霉烯类肠杆菌科细菌分布及耐药性分析[J]. 中国抗生素杂志, 2019, 44(7): 860-863.
周赫. 抗碳青霉烯类耐药肠杆菌科细菌感染治疗中的药敏研究[J]. 中国卫生标准管理, 2022, 13(8): 116-119.
甘龙杰, 陈善建, 林宇岚, 等. 碳青霉烯类耐药肠杆菌科细菌基因型检测及耐药性分析[J]. 临床检验杂志, 2018, 36(9): 663-666.
郭普, 乔艳, 李静, 等. 2016—2018年某医院CRE临床分布、耐药性及碳青霉烯酶基因检测[J]. 中国抗生素杂志, 2020, 45(11): 1139-1143.
中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识编写组, 中国医药教育协会感染疾病专业委员会, 中华医学会细菌感染与耐药防控专业委员会. 中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识[J]. 中华医学杂志, 2021, 101(36): 2850-2860.
胡玲. 碳青霉烯类耐药肠杆菌科细菌控制措施的监测[J]. 当代护士(中旬刊), 2020, 27(1): 109-111.
燕成岭, 樊淑珍. 耐碳青霉烯类肠杆菌科细菌的临床分布特征及耐药性分析[J]. 内蒙古医学院学报, 2019, 41(5): 464-467.
Lv F, Cai J J, He Q X, et al. Overexpression of efflux pumps mediate pan resistance of Klebsiella pneumoniae sequence type 11[J]. Microb Drug Resist, 2021, 27(10): 1405-1411.
Ejaz H. Analysis of diverse β-lactamases presenting high-level resistance in association with OmpK35 and OmpK36 porins in ESBL-producing Klebsiella pneumoniae[J]. Saudi J Biol Sci, 2022, 29(5): 3440-3447.
Rocker A, Lacey J A, Belousoff M J, et al. Global trends in proteome remodeling of the outer membrane modulate antimicrobial permeability in Klebsiella pneumoniae[J]. mBio, 2020, 11(2): e00603-20.
