多拉菌素有机杂质的纯化与结构鉴定
2024-01-01金鑫秦娜范思洋杨玉雷郭雅俊
金鑫 秦娜 范思洋 杨玉雷 郭雅俊
摘要:目的 分离与鉴定多拉菌素中有机杂质,对改进生产工艺,提高产品质量具有重要意义。方法 采用制备液相色谱技术,对多拉菌素中有机杂质进行分离制备,并通过质谱和核磁共振技术鉴定杂质结构。结果 经制备液相分离得到5个主要杂质,经核磁共振光谱和质谱分析鉴别为12-乙基多拉菌素,14-去甲基多拉菌素,5-甲氧基多拉菌素,5-酮多拉菌素和25-环己基-阿维菌素B2。其中12-乙基多拉菌素未见文献报道。结论 建立了多拉菌素有机杂质的制备方法,并进行了结构鉴定,为多拉菌素的质量控制提供了参考。
关键词:多拉菌素;分离制备;杂质;结构鉴定;高效液相色谱;质谱;核磁共振
中图分类号:R978.1 文献标志码:A
Isolation and identification of impurities in doramectin
Jin Xin1, Qin Na1, Fan Siyang2, Yang Yulei2, and Guo Yajun2
(1 Zhejiang Jinhua Conba Bio-pharm Co., Ltd., Jinhua 321016; 2 State Key Lab of New Drug & Pharmaceutical Process, Shanghai Institute of Pharmaceutical Industry, China State Institute of Pharmaceutical Industry, Shanghai 201203)
Abstract Objective To separate and identify main organic impurities in doramectin and improve the production process and product quality. Methods The organic impurities of doramectin were enriched by the semi-preparative liquid chromatography. The nuclear magnetic resonance spectrum and mass spectrum analysis were used to identify the structures of the impurities. Results Five impurities were obtained by the preparative liquid chromatography. By MS and NMR analysis, the impurities were identified as 12-ethyldoramectin, 14-demethyldoramectin, 5-methoxydoramectin, 5-ketodoramectin, and 25-cyclohexy-avermectin B2. 12-ethyldoramectin was newly identified. Conclusion The method of preparing organic impurities was developed, and the structures were identified. This research provides a reference for the quality control of doramectin.
Key words Doramectin; Separation and preparation; Impurities; Structure identification; HPLC; MS; NMR
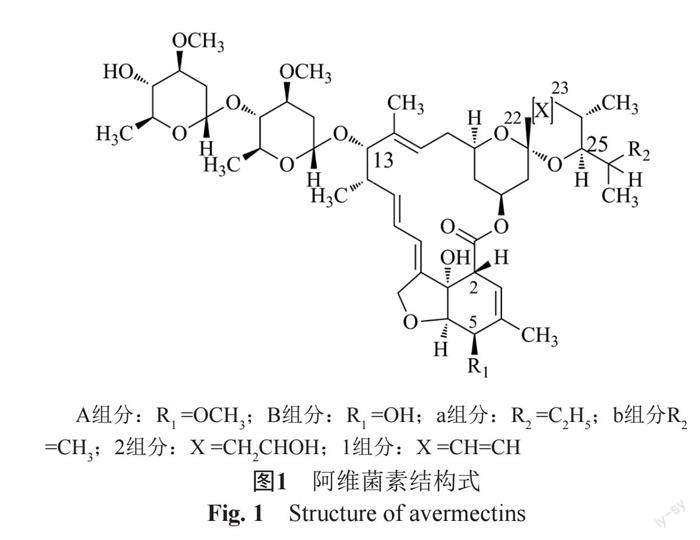
寄生虫感染是畜牧业面临的重要问题之一。阿维菌素(avermectin,图1),发现于链霉菌的培养液中,对寄生虫具有优异的活性。经研究,阿维菌素的基本结构是一个十六元内酯环,其上连接有3个主要基团:六氢化苯并呋喃(C-2到C-8),二糖基(C-13)和螺酮缩醇系统(C-17到C-28)。天然的阿维菌素有8种组分。根据C-5位上取代基的不同,C-22和C-23之间单双键的差异及C-25位上取代基的不同,分别用A,B;1,2和a,b的组合来表示,分别命名为A1a、A1b、A2a、A2b、B1a、B1b、B2a和B2b。其中B1的活性最优,尤其是B1a组分的杀虫效果最佳[1],其他异构体抗寄生虫活性低且毒性高[2]。商品化阿维菌素为B1a与B1b的混合物。
目前,相继报道了通过突变生物合成生产新型阿维菌素衍生物。多拉菌素(25-环己基阿维菌素B1, doramectin, DOR)作为第三代阿维菌素衍生物,是高效广谱的驱虫药,见图2。与阿维菌素相比,在动物体内吸收迅速、体内分布容积大、消除缓慢,具有明显的长效性,更高杀寄生虫活性[3]。阿维菌素菌bkdFGH缺失突变株发酵过程中添加环己羧酸时,突变株将以加入的环己羧酸为起始物合成多拉菌素。
在光照条件下,多拉菌素稳定性差,将转化为 8,9-Z异构体[4-5]或5-酮多拉菌素[6]。除此之外,多拉菌素相关杂质报道较少。为保证产品质量,本文以对多拉菌素主要杂质1~5(图3和表1)进行了分离收集,并采用质谱与核磁共振技术进行了结构确证(见图4),可供该品种理化性质研究和质量标准制定参考。制备所用样品为多拉菌素粗品结晶母液。
1 材料与仪器
多拉菌素粗品结晶母液(浙江金华康恩贝生物制药有限公司,批號:LI20180703);乙腈(色谱纯,Admas公司);甲醇(色谱纯,Admas公司);蒸馏水(自制);CDCl3(Sigma-Aldrich公司);其他试剂均为国产分析纯。
Agilent 1260型高效液相色谱系统(紫外检测器);Thermo U3000型高效液相色谱系统(紫外检测器);Waters 6000型半制备色谱仪(2489紫外检测器);Waters XEVO G2-XS Qtof质谱检测器;Varian INOVA-500 MHz核磁共振仪。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Poroshell 120 EC-18色谱柱(50 mm × 4.6 mm, 2.7 μm);流动相:甲醇-乙腈-水(15:70:15,V/V/V);等度洗脱;流速:0.6 mL/min;检测波长:245 nm;柱温:30℃;进样量:10 μL。
2.2 制备色谱条件
色谱柱:Sunfire Prep C18 OBD色谱柱
(150 mm×19 mm, 5 μm);流动相:甲醇-乙腈-水(65:10:25,V/V/V);等度洗脱;流速:2 mL/min;检测波长:245 nm。在该制备条件下,杂质1为8.5 min,杂质2为6.3 min,杂质3为11.7 min,杂质4为9.8 min,杂质5为3.3 min。
2.3 结构确证
2.3.1 12-乙基多拉菌素(杂质1)
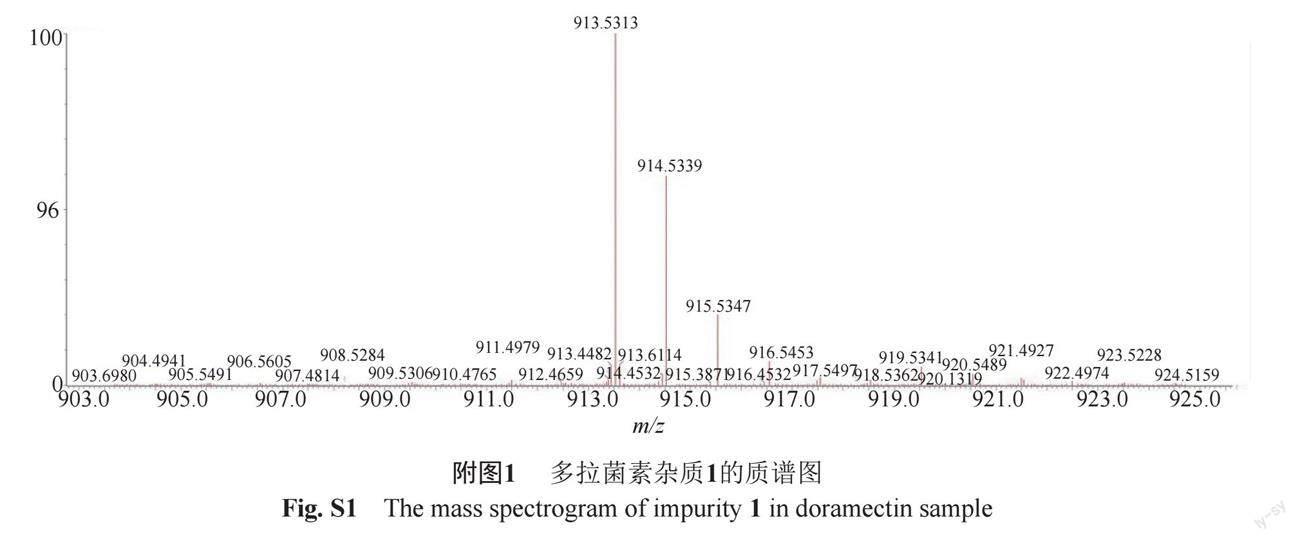
杂质1分子离子表现为m/z 913.5313 [M+H]+ (calcd. for C51H77O14: 913.5313),确定分子式为C51H76O14,提示其有14个不饱和度。质谱图见附图1。
杂质1经核磁共振光谱分析,13C NMR和1H NMR数据见表2。
从13C NMR谱(表2)可以看出,低场有一羰基碳信号(δC =173.74)。10个sp2杂化碳信号,证明结构中含有5个碳碳双键。以及8个环状结构。通过对比杂质1和doramectin 13C NMR谱[7]发现,杂质1可能具有doramectin母核结构。通过HMBC和1H-1H COSY谱,对化合物母核上的碳氢信号进行归属,发现H-12(δH=2.13),C-12(δC=47.34),12-CH2-CH3(δH=0.91, δC=12.22)与doramectin H-12(δH =2.53),C-12(δC=39.94),14-CH3(δH=1.17, δC=20.43)相比,化学位移差异较大。并且,1的分子量与doramectin相比,相差14,提示1结构中可能多了一个亚甲基。12-CH2-CH3质子信号裂分成三重峰,耦合常数J=6.9 Hz,提示甲基与亚甲基相连。通过1H?1H COSY谱δH=0.91与δH=1.46, 1.18相关,证明结构中乙基的存在。根据HMBC谱,δH =0.91与δC=67.30(C-12)相关,δH =1.46,1.18与δC136.74(C-11),80.41(C-13)相关,表明乙基连接在C-12位上。1H-1H COSY谱δH=1.46,1.18与δH=2.13相关;δH=2.13与δH=4.04,5.67相关。证明了上述推测。将1H NMR,13C NMR化学位移进行归属,将氢谱裂分及HMBC相关情况进行总结见表2。最后,确定杂质1平面结构如图4所示。
2.3.2 14-去甲基多拉菌素(杂质2)
杂质2分子离子表现为m/z 885.5004 [M+H]+ (calcd. for C49H73O14: 885.5000),确定分子式为C49H72O14,提示其有14個不饱和度。质谱图见附图2。
杂质2经核磁共振光谱分析,13C NMR和1H NMR数据见表3。
通过对比杂质2和doramectin 13C NMR谱[7]发现,杂质2可能具有doramectin母核结构。通过HMBC和1H?1H COSY谱,对化合物母核上的碳氢信号进行归属,发现C-13(δC=77.61), C-14(δC =132.27), C-15(δC =124.43), C-16(δC =39.40),H-14(δH=5.25), H-15(δH=5.21), 与doramectin C-13(δC=81.92),C-14(δC =135.20, 季碳), C-15(δC=118.38), C-16(δC=34.56),H-15(δH =5.00)相比,化学位移差异较大。并且缺少C-14-CH3信号。杂质2分子量与doramectin分子量相比,减少14。HSQC谱中,杂质2 C-14显示为叔碳信号。以上信息提示2结构中,在14位可能少了1个甲基。HMBC谱显示H-14与C-13,16相关;H-16与C-14相关。1H?1H COSY谱显示H-13与H-12,14相关;H-14与H-13, 15相关;H-15与H-16相关。由此验证,杂质2结构在doramectin基础上,在14位缺少1个甲基。
H-14,15构型确认:从HSQC谱可以看出,H-14与H-15信号有部分重叠(附图3),为H-14和H-15的一级裂分情况分析造成一定困难。H-14较H-15稍微偏低场。如附图4所示,H-14裂分为dd峰,耦合常数J=15.8, 9.6 Hz;H-15裂分为dt峰,耦合常数J=15.8, 10.7 Hz。由此推断H-14与H-15之间耦合常数为15.8 Hz。因此,H-14和H-15为反式(trans)结构。
最后,确定化合物平面结构如图4所示,为已知化合物[8]。
2.3.3 5-甲氧基多拉菌素(杂质3)
杂质3分子离子表现为m/z 913.5313 [M+H]+ (calcd. for C51H77O14: 913.5313),确定分子式为C51H76O14,提示其有14个不饱和度。质谱图见附图5。
杂质3经核磁共振光谱分析,13C NMR和1H NMR数据见表4。
从13C NMR谱(表4)可以看出,低场有1个羰基碳信号(δC=173.91)。10个sp2杂化碳信号,证明结构中含有5个碳碳双键。以及8个环状结构。通过对比化合物和doramectin 13C NMR谱[1]发现,化合物可能具有doramectin母核结构。通过HMBC和1H-1H COSY谱,对化合物母核上的碳氢信号进行归属,发现H-5(δH=3.97),C-5(δC=76.92)与doramectin H-5(δH=4.295),C-5(δC=67.91)相比,化学位移差异较大。并且,该化合物的分子量与doramectin相比,相差14。此外,该化合物13C NMR谱多了1个甲氧基信号(δC=57.81)。提示化合物结构中可能多了一个甲氧基,且与C-5相连。根据HMBC谱,δH=3.51(5-OMe)与δc=76.92(C-5)相关,δH=3.97(H-5)与δc=57.81(5-OMe)相关,表明甲氧基连接在C-5位上。证明了上述推测。将1H,13C-NMR化学位移进行归属,将氢谱裂分及HMBC相关情况进行总结。最后,确定化合物平面结构如图4所示,为已知化合物[9]。
2.3.4 5-酮多拉菌素(杂质4)
杂质4分子离子表现为m/z 897.5004 [M+H]+ (calcd. for C50H73O14: 897.5000),提示该化合物有15个不饱和度。质谱图见附图6。
杂质4经核磁共振光谱分析,13C NMR和1H NMR数据见表5。
从13C NMR谱可以看出,低场有2个羰基碳信号(δC=172.20, 192.11)。10个sp2杂化碳信号,证明结构中含有5个碳碳双键。以及8个环状结构。通过对比化合物和doramectin 13C NMR谱[1]发现,化合物可能具有doramectin母核结构。通过HMBC和1H-1H COSY谱,对化合物母核上的碳氢信号进行归属,发现缺少C-5(δC=67.91)信号。多了羰基碳信号(δC=192.11)。并且,该化合物的分子量与doramectin相比,相差2。提示化合物结构中原本doramectin 5位羟基可能被氧化成酮羰基。根据HMBC谱,δH=6.57(H-3), δH=3.85(H-6)与δc=192.11相关,表明C-5为酮羰基碳。证明了上述推测。将1H, 13C NMR化学位移进行归属,将氢谱裂分及HMBC相关情况进行总结。最后,确定化合物平面结构如图4所示,为已知化合物[6]。
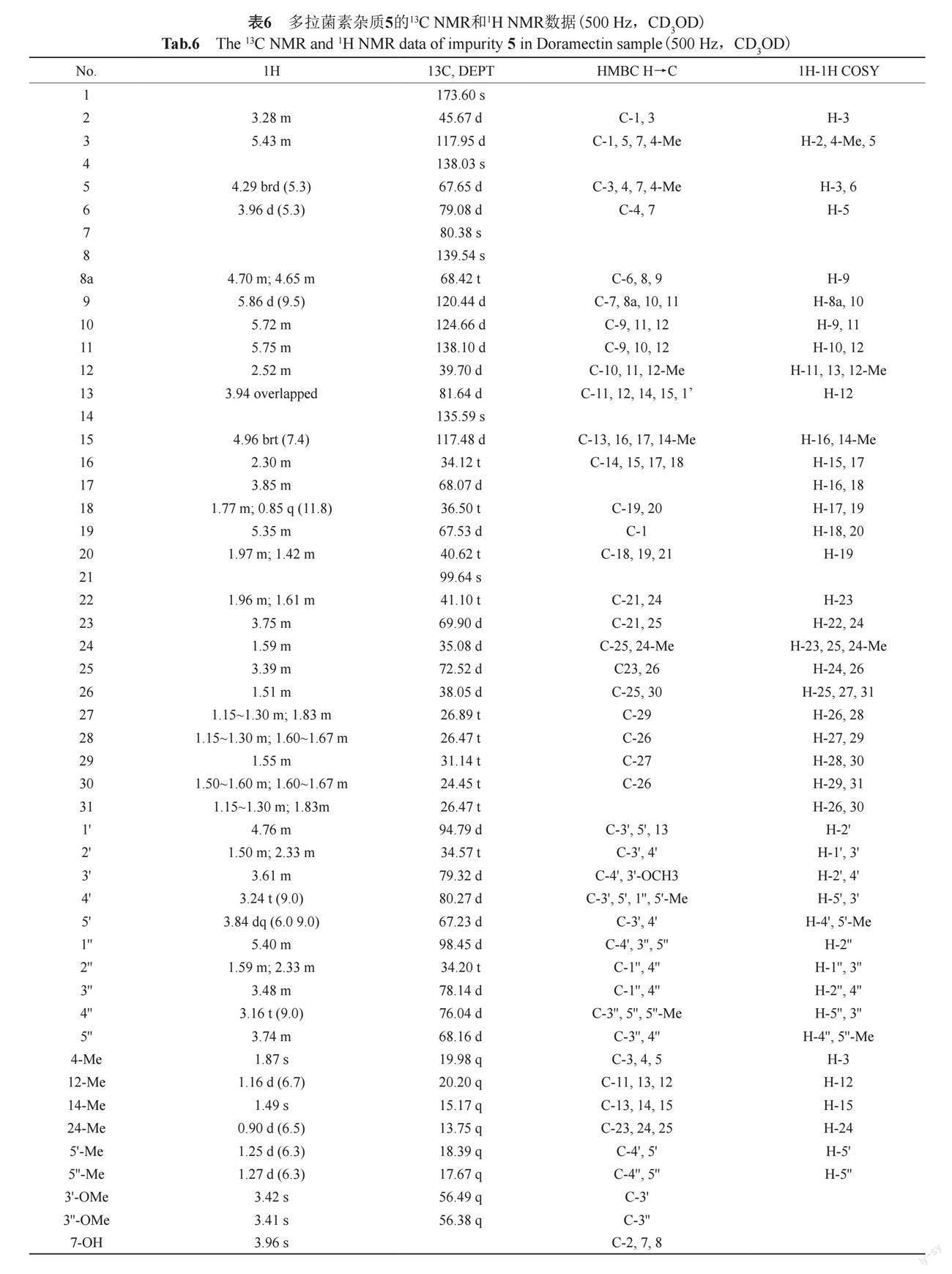
2.3.5 25-环己基-阿维菌素B2(杂质5)
杂质5分子离子表现为m/z 917.5262 [M+H]+(calcd. for C50H77O15: 917.5262),提示该化合物有13个不饱和度。质谱图见附图7。
杂质5经核磁共振光谱分析,13C NMR和1H NMR数据见表6。
从13C-NMR谱可以看出,低场有1个羰基碳信号(δC=173.60)。8个sp2杂化碳信号,证明结构中含有4个碳碳双键。以及8个环状结构。化合物与doramectin相比,分子量多18。通过对比化合物和doramectin 13C-NMR谱7发现,化合物可能具有doramectin母核结构。与doramectin相比,化合物缺少22和23位碳碳双键。通过HMBC和1H?1H COSY谱,对化合物母核上的碳氢信号进行归属,发现H-23(δH=3.75),C-23(δC=69.90),H-22(δH=1.61,1.96),C-22(δC=41.10)与doramectin H-23(δH=5.74),C-23(δC=136.40),H-22(δH=5.54),C-22(δC=127.93)相比,化学位移差异较大。提示,可能化合物为doramectin与一分子H2O发生加成后产物,且加成位于22位双键。此外,根据HMBC谱,δH=0.90(24-CH3)与δC=69.90(C-23), δC=35.08(C-24), δC=72.52(C-25)相关,证明了上述推测。将1H,13C-NMR化学位移进行归属,其核磁数据与文献报道的完全一致[7],为已知化合物25-环己基-阿維菌素 B2。根据研究结果,将杂质1~5定入质量标准,单独控制,提高了多拉菌素的安全性和质量可控性。
参 考 文 献
胡栋, 柯灵超, 张敬宇, 等. 响应面法设计优化阿维菌素化学合成发酵培养基[J]. 中国抗生素杂志, 2018, 43(8): 1055-1061.
成丕乐. 新型阿维菌素和氯虫酰胺衍生物的设计,合成与杀虫活性研究[D]. 兰州: 兰州大学, 2017.
高玉红, 郭照成, 刘方悦, 等. 多拉菌素的研究进展及应用[J]. 东北农业大学学报, 2009, 40(4): 141-144.
Sklavounos C, Demers N, Lukaszewicz J, Nowakowski M. Photoisomerization of aromatic doramectin derivatives[J]. J Agric Food Chem, 1994, 42(5): 1228-1231.
Mrozik H, Eskola P, Reynolds G F, et al. Photoisomers of avermectins[J]. J Org Chem, 1988, 53(8): 1820-1823.
Sklavounos C, Demers N, Lukaszewicz J, et al. Photoisomerization of aromatic doramectin derivatives[J]. J Agric Food Chem, 1994, 42: 1228-1231.
Dutton C J, Gibson S P, Kinns M, et al. Structure of doramectin[J]. J Chem Soc Perkin Trans, 1995, 2(2): 403-408.
Zhang Q, Cheng Y, Yang J, et al. Isolation, identification, and characterization of potential impurities of doramectin and evaluation of their insecticidal activity[J]. J Pharm Biomed Anal, 2020, 191: 1-9.
Dutton C J, Gibson S P, Goudie A C, et al. Novel avermetins produced by mutation biosynthesis[J]. J Antibiot, 1991, 44(3): 357-365.
