二氧化氯对褐腐菌、酵母菌及大肠埃希菌的抑菌作用研究
2024-01-01幸红霞姚倩张雨铖廖俊米董娟余沁郭晓强
幸红霞 姚倩 张雨铖 廖俊米 董娟 余沁 郭晓强
摘要:目的 考察二氧化氯对桃褐腐病主要致病菌褐腐菌(Monilinia fructicola)、酵母菌(Kazachstania exigua)以及大肠埃希菌(Escherichia coli)的抑制效果。方法 以褐腐菌、酵母菌、大肠埃希菌为实验对象,采用固体培养法测定菌斑直径和细菌存活率;测定胞外培养液电导率,蛋白质和DNA含量,检测胞内丙二醛浓度和脱氢酶活性,并采用扫描电镜进行形态学观察。结果 随着二氧化氯浓度升高,菌斑直径和细菌存活率逐渐降低,胞外培养液电导率、蛋白质、DNA含量和胞内丙二醛含量增加,脱氢酶活性显著下降;二氧化氯对褐腐菌的抑菌效果显著高于酵母菌和大肠埃希菌(P<0.05)。电镜扫描下可见细菌细胞膜边界模糊,有明显渗出液。结论 二氧化氯能有效抑制褐腐菌的生长,其机制与破坏细菌细胞膜,使细菌代谢酶失活有关。
关键词:二氧化氯;褐腐菌;酵母菌;大肠埃希菌;抑菌机制
中图分类号:R978.1 文献标志码:A
Antibacterial effects of chlorine dioxide on Monilinia fructicola, yeast and Escherichia coli
Xing Hongxia1, Yao Qian2, Zhang Yucheng2, Liao Junmi3, Dong Juan3, Yu Qin2, and Guo Xiaoqiang2
(1 School of Food and Biological Engineering, Chengdu University, Chengdu 610106; 2 School of Pharmacy, Chengdu University, Chengdu 610106; 3 Sichuan Shuangjinduotai Biotechnology Co., LTD, Chengdu 610100)
Abstract Objective To study the inhibitory effect of ClO2 on Monilinia fructicola , the primary pathogen of peaches, as well as yeast (Kazachstania exigua) and Escherichia coli (E. coli). Methods The plaque diameter and bacterial survival rate of Monilinia fructicola, yeast, and E. coli were measured using the solid culture method. The conductivity, protein, and DNA content of the extracellular culture medium, as well as the intracellular malondialdehyde content and dehydrogenase activity, were all tested using the same approach. Finally, scanning electron microscopy was applied to observe the bacterial morphology. Results The plaque diameter and bacterial survival rate gradually reduced as ClO2 concentration increased. However, extracellular conductivity, protein and DNA content as well as intracellular malondialdehyde content increased, while dehydrogenase activity declined dramatically. The inhibitory effect of ClO2 on Monilinia fructicola was notably stronger than that on yeast and E coli (P<0.05). The blurred boundary of bacterial cell membrane with visible intracellular effusion were observed under SEM. Conclusion The antibacterial mechanisms are associated with the impairment of cell membrane and inactivation of bacterial metabolic enzymes.
Key words Chlorine dioxide; Monilinia fructicola; Yeast; E. coli; Antibacterial mechanism
二氧化氯是一種新型的空气消毒剂,具有适用面广、使用剂量低、灭菌率高、持续时间长、无毒副作用及对环境无污染等优点,己被世界卫生组织列为A1级安全高效的绿色消毒剂[1],被公认为食品除臭和消毒最突出和最有效的化学品之一。二氧化氯对饮用水、水果和蔬菜进行消毒处理时通常采用水溶液或者气体形式[2];研究表明,二氧化氯气体处理后残留的氯气比其水溶液形式少,且表面的渗透速度也更快[3]。成都龙泉山脉区域是全国重要的水蜜桃生产基地之一,有“天下第一桃”的美誉[4]。桃的软组织和薄果皮在采后贮藏期间易受到真菌感染引起疾病,褐腐菌是桃果实采后软腐病的主要致病菌[5],由褐腐菌引起的褐腐病是桃收获后最具破坏性的病害[6],在贮藏、运输、销售及消费过程中极易发生,使果实迅速腐败,导致无法食用,造成巨大的经济损失[7]。大肠埃希菌是食品主要污染源之一,食用后易引起腹泻、呕吐等消化道症状。酵母菌可利用果皮表面和伤口处的营养迅速大量繁殖,从而消耗伤口处营养且布满整个伤口表面[8]。细菌加速了桃的腐烂变质,不利于贮藏和运输。目前,桃果实采后主要依赖于化学杀菌剂防治微生物污染,但杀菌剂的过度使用会造成环境污染、对人体健康有一定的危害,为减少环境污染和满足消费者对安全食品日益增长的需求,寻找新的褐腐菌防治方法迫在眉睫[9]。本文选择水蜜桃贮存和运输过程中常见的3种菌-褐腐菌、酵母菌和大肠埃希菌,采用固体反接培养方法考察二氧化氯对3种菌的抑制作用,以期更好地模拟果蔬贮藏的实际状况,找到高效低毒的水蜜桃保鲜策略,为延长水蜜桃货架期、提高水蜜桃营养价值提供有益指导。
1 材料与仪器
1.1 实验菌株
大肠埃希菌BNCC336902(Escherichia coli)、酵母菌JC2636(Kazachstania exigua)均由成都大学四川省生物医药基础实验教学中心微生物实验室提供。
1.2 试剂
丙二醛(malondialdehyde,MDA,AR,纯度≥98%,广东翁江化学试剂有限公司);营养琼脂和LB肉汤购自青岛海博生物技术有限公司;硫代巴比妥酸、乙酸异戊酯和2, 3, 5-三苯基氯化四氮唑(2, 3, 5-triphenyl tetrazolium chloride,TTC)购自上海泰坦科技股份有限责任公司;二氧化氯(AR,含量10%)由四川金科药业有限公司提供。
1.3 仪器
UV5100B紫外可见分光光度计(上海元析仪器有限公司),FE30台式电导仪(梅特勒-托力多仪器有限公司),SPX-250生化培养箱(常州迈科诺仪器有限公司),CT14D高速冷冻离心机(上海天美生化仪器设备工程有限公司),Quanta 200扫描电子显微镜(scanning electron microscope, SEM,美国FEI仪器有限公司)。
2 方法
2.1 褐腐菌的分离与复苏
2.1.1 褐腐菌的分离
在龙泉水蜜桃病果上挑取少量腐烂部分,用无菌水连续稀释,0.1 mL稀释液置于PDA灭菌固体培养基,涂布均匀,25 ℃培养1 d,根据菌落形态挑选单个菌落,转移至新的灭菌培养基中培养,重复3次。经形态学和PCR验证[10],鉴定为褐腐菌。菌株置于PDA斜面上,4 ℃低温保存。
2.1.2 菌种复苏与生长
用接种环挑取褐腐菌、酵母菌、大肠埃希菌,分别接种于100 mL LB灭菌液体培养基中,分别在
25 ℃、28 ℃和37 ℃下以100 r/min振荡培养24 h。调整其浓度为106 CFU/mL,吸取50 μL菌悬液置于PDA平板中央,涂布均匀,将培养皿分别置于25 ℃、
28 ℃和37 ℃下培养1 d备用[11]。
2.2 反接培养法
参照文献[11]的方法并稍作改进。将灭菌的PDA培养基倒入培养皿中,冷却备用,无菌打孔器(6 mm)取“2.1.2”项下含菌培养基,制得菌饼,将其反接于PDA平板中央;精确称量二氧化氯固体,分别用蒸馏水配置成0.0125、0.025、0.05和0.1 mmol/L的二氧化氯溶液10 mL,将10 mL二氧化氯溶液倒入50 mL烧杯中;将烧杯和培养皿(加盖)放置于10 L塑料盒中,将塑料盒分别置于25 ℃、28 ℃和37 ℃下培养16 h。取出培养皿,继续培养直至空白组的菌落直径大于培养皿直径的2/3,结束培养。以未经二氧化氯处理的菌饼作为空白组。
2.3 抑菌活性测定
2.3.1 菌落直径
培養结束后,用游标卡尺采用十字交叉法测定各组菌斑直径3次,结果取平均值。
2.3.2 存活率
菌落培养结束后,用小刀刮下相同大小的菌斑(直径约4 cm),置于试管中,用20 mL无菌PBS分散均匀,于600 nm波长处测吸光值,与空白组的吸光度值做比较,按下式计算存活率lg(Nt/N0)[12]:
lg(Nt/N0)=lg(At/A0)
其中,Nt和N0分别表示二氧化氯处理组和空白组的细菌数量,At和A0分别表示二氧化氯处理组和空白组细菌混悬液的吸光度值。
2.4 抑菌机制考察
2.4.1 电导率
取“2.3.2”项下培养结束后的菌斑,用无菌水分散样品置于烧杯中,用电导仪测定电导值记为A1,测完后将所有样品沸水浴15 min,冷却后再次测其电导值记为A2,参照文献[13]计算电导率。
电导率(%)=A1/A2×100
2.4.2 蛋白质和DNA
使用PBS冲洗反接处理培养后菌落,12000 r/min
离心30 min;吸取上清液,用紫外分光光度计测定A260和A280,DNA含量用260 nm波长处的吸光值表示,参照文献[14]计算蛋白质含量。
蛋白质含量/(mg/mL)=1.45×A280 -0.74×A260
2.4.3 MDA测定
MDA含量测定参照文献[15],并稍作改进。取反接菌斑,用PBS分散,随后吸取1.5 mL,加入3 mL 10%三氯醋酸(w/v),在4 ℃、4500 r/min离心30 min;吸取上清液2 mL,加0.67% 硫代巴比妥酸(w/v)4.5 mL,沸水浴10 min,离心,于532 nm波长处测吸光值,根据MDA标准曲线计算含量。
2.4.4 脱氢酶活性测定
脱氢酶活性测定参照文献[15],并稍作改进。取经PBS分散的菌液6 mL,加入2 mL Tris-HCl(pH 8.8)溶液,以及2 mL TTC-葡萄糖溶液,37 ℃水浴加热2 h,分别加入7.5 mL甲苯和冰醋酸溶液,室温放置1 h后,于485 nm波长处测吸光值;以未经二氧化氯处理的细菌作为阴性对照。
2.5 细菌形态观察
取“2.1.2”项下培养的细菌,二氧化氯处理16 h,用6 mm无菌打孔器取菌饼,分散于灭菌蒸馏水中,8000 r/min离心5 min;弃上清液,加入2 mL 2.5%戊二醛(w/v),4℃下放置12 h;然后参照Tao等[16]方法进行梯度洗脱,样品经自然干燥后,喷金、上样,在扫描电镜下观察形态。
2.6 统计学分析
样品测定重复3次,以平均值±标准偏差表示。使用Origin 2021软件作图,SPSS 26.0软件进行统计分析[17],当P≤0.05时,组间有显著性差异。
3 结果
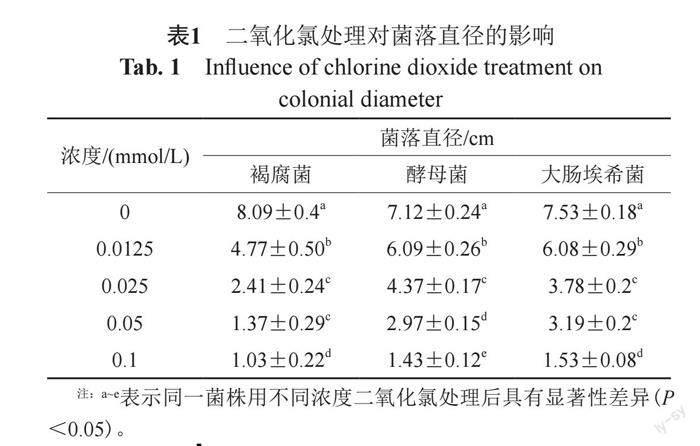
3.1 抑菌活性
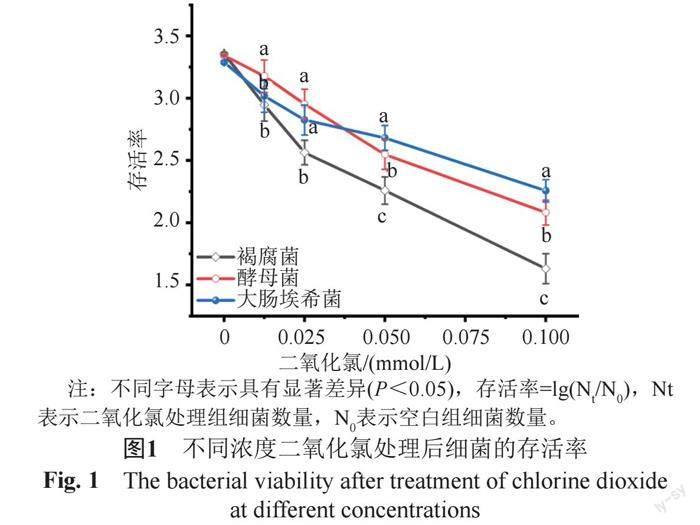
菌落直径结果如表1所示,二氧化氯浓度与菌落直径呈负相关,即浓度越大,菌落直径越小。采用相同浓度的二氧化氯处理后,褐腐菌的菌落直径均显著小于酵母菌和大肠埃希菌,表明二氧化氯对褐腐菌的杀菌效果最好。细菌存活率表现了相同的趋势,即随着二氧化氯浓度的升高,细菌存活率下降,显示了二氧化氯较强的杀菌作用(图1);浓度≥0.025 mmol/L时褐腐菌的存活率显著低于酵母菌和大肠埃希菌(P<0.05),浓度≥0.05 mmol/L时酵母菌存活率显著低于大肠埃希菌(P<0.05)。
3.2 抑菌机制研究
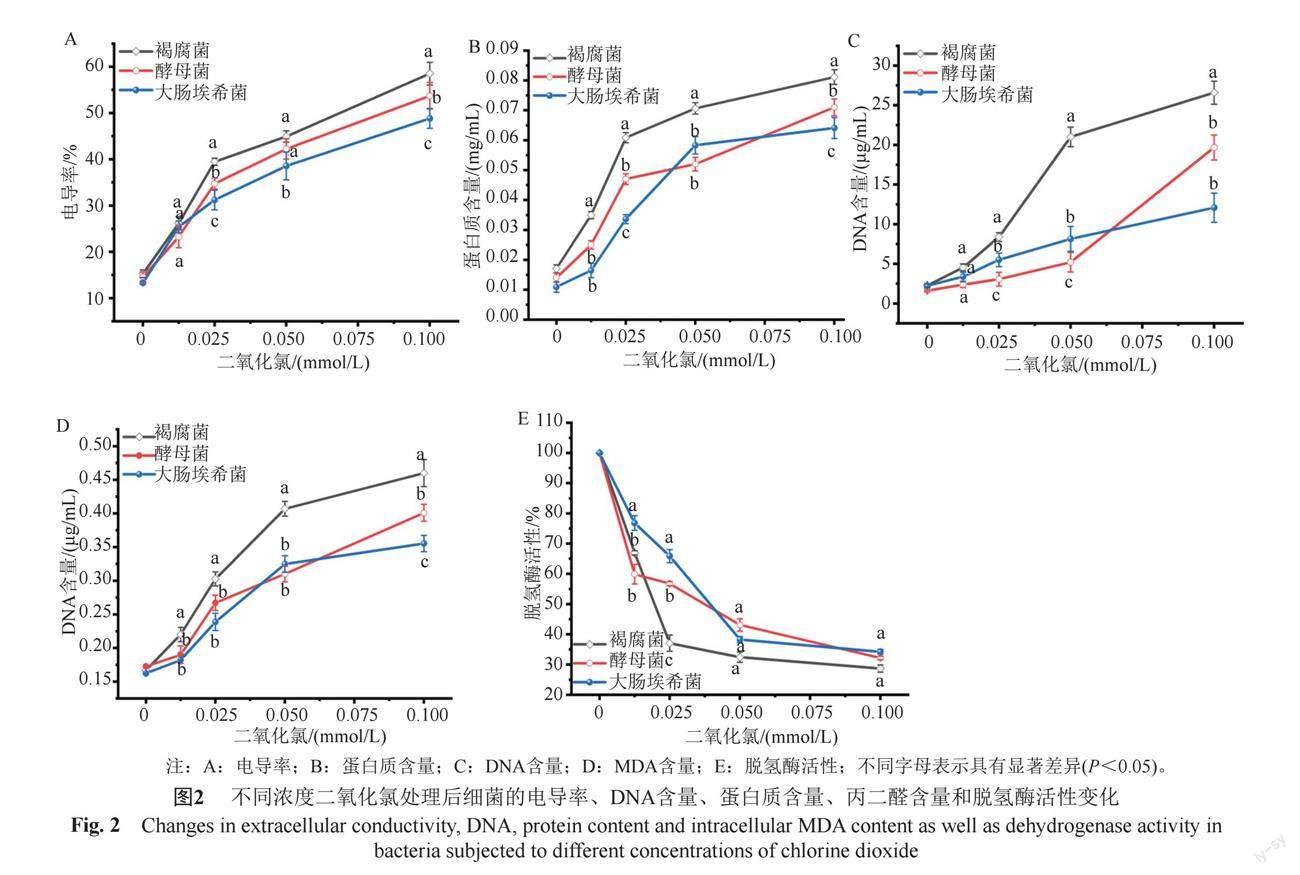
3.2.1 电导率
电导率测定结果如图2(A)所示,随着二氧化氯浓度的增加,细菌培养液的电导率不断增加;在二氧化氯浓度≤0.0125 mmol/L时,3种菌株电导率无显著性差异;二氧化氯浓度升至0.025 mmol/L,电导率顺序为褐腐菌>酵母菌>大肠埃希菌。
3.2.2 蛋白质含量
培养基中细菌泄露的蛋白质含量测定结果如图2(B)所示,二氧化氯处理后,褐腐菌、酵母菌和大肠埃希菌渗出的蛋白质含量与二氧化氯浓度呈正相关,在多数浓度下,蛋白质含量顺序为褐腐菌>酵母菌>大肠埃希菌(P<0.05),褐腐菌胞外蛋白的含量均显著高于酵母菌和大肠埃希菌。
3.2.3 DNA含量
细胞外DNA含量测定结果如图2(C)所示,随着二氧化氯浓度的增加,细菌胞外DNA含量逐渐增大,当二氧化氯浓度至0.025 mmol/L时,褐腐菌DNA含量急剧增大;二氧化氯浓度达0.05 mmol/L时,酵母菌胞外DNA开始迅速上升,而大肠埃希菌的DNA呈现匀速增大趋势。二氧化氯浓度为0.05 mmol/L时,3种细菌DNA含量顺序为褐腐菌>大肠埃希菌>酵母菌(P<0.05);当气体浓度增至0.1 mmol/L时,DNA含量为褐腐菌>酵母菌>大肠埃希菌,褐腐菌胞外DNA浓度显著高于其他两种细菌(P<0.05)。
3.2.4 MDA含量
细菌MDA含量测定结果如图2(D)所示,随着二氧化氯浓度增加,细菌胞内MDA含量逐渐增大;在多数浓度作用下,MDA含量顺序为褐腐菌>酵母菌>大肠埃希菌,浓度≥0.0125 mmol/L时褐腐菌胞内产生的MDA显著高于酵母菌和大肠埃希菌(P<0.05)。
3.2.5 脱氢酶活性
脱氢酶活性测定结果如图2(E),随着二氧化氯浓度增加,3种细菌的脱氢酶活性迅速降低。二氧化氯浓度为0.0125 mmol/L时,大肠埃希菌的酶活性显著高于褐腐菌与酵母菌(P<0.05),表明二氧化氯对大肠埃希菌酶的破坏作用相对较弱;二氧化氯浓度增至0.025 mmol/L时,3种菌株酶活性为大肠埃希菌>酵母菌>褐腐菌(P<0.05);二氧化氯浓度≥
0.05 mmol/L时,3种菌株的脱氢酶活性持续降低,组间均无显著性差异(P>0.05),表明高浓度二氧化氯可使不同细菌的脱氢酶失活,從而引起细菌的死亡。
3.3 细菌形态变化
SEM扫描结果如图3所示,空白组形态完整,表面较为光滑,基本没有褶皱,SEM背景较干净,说明无内容物流出。处理组中3种菌的部分形态发生改变,表面干瘪粗糙、凹陷,细胞膜受损,边界变得模糊,镜下可见多处团聚体和渗出液,其中褐腐菌变形最严重,形态严重塌陷并有大量渗出液,这与灭活效果一致。
4 讨论
大量研究表明,二氧化氯可抑制细菌、病毒、孢子形成的生物体,具有来源广泛、安全性高、毒副作用小和环境友好等优势。褐腐菌引起的褐腐病是桃果实采后的重要侵染性病害,二氧化氯对褐腐菌的抑菌研究较少。本实验结果显示,与酵母菌和大肠埃希菌相比,二氧化氯能较好抑制褐腐菌生长,原因可能是褐腐菌有菌丝体,二氧化氯能较快进入褐腐菌的菌丝细胞,抑制菌落生长。Yu等[18]报道二氧化氯气体可抑制黄曲霉的菌丝体生长、孢子萌发和AFB1产毒能力。
二氧化氯促进微生物的死亡机制被认为有以下两种,一种是由于细胞表面蛋白质巯基的氧化和细胞膜通透性的增加[19],另一种是通过影响细胞内部成分,如蛋白质和核酸含量,并干扰蛋白质的合成[20]。细菌悬浮液中的电导率可以反映细胞膜的渗透性改变,如果电解质渗漏,表明细胞膜被破坏,可检测到胞外培养液电导率升高[21-22]。二氧化氯处理后3种菌株的电导率增加,说明二氧化氯对细菌细胞膜有一定程度的破坏作用,引起细胞膜内电解质外渗。二氧化氯处理后3种菌株的胞外蛋白质和DNA含量均有所增加,表明二氧化氯处理后细菌的细胞膜遭到破坏,使胞内物质泄露到细胞外。蛋白质和DNA是细菌维持生命活动的物质基础,它与病原菌体内的正常生理活动和细胞周期等密切相关;细菌胞内蛋白质和DNA的渗出加速了细菌的死亡。MDA为细胞脂质膜的氧化产物,本实验发现,经二氧化氯处理后,3种菌株的MDA含量均明显增加,同时表现出了浓度依赖性,即随着二氧化氯浓度升高,MDA含量增大,说明二氧化氯通过氧化脂质的形式使细菌细胞膜受损。同时,二氧化氯可抑制细菌相关代谢酶活性[20],TTC法测定脱氢酶活性可表征细菌呼吸活性的大小;本实验显示,低剂量的二氧化氯能使细菌脱氢酶活性急剧下降,在高剂量下脱氢酶活性降至40%以下,说明二氧化氯对细菌代谢酶有强烈的抑制作用,从而引起细菌的死亡。
通常,二氧化氯对真菌的抑制作用强于细菌。在本实验中,当二氧化氯浓度高于0.025 mmol/L时,对酵母菌的抑制率显著高于大肠埃希菌,但当浓度低于0.025 mmol/L时,二氧化氯对大肠埃希菌的抑制作用高于酵母菌(图1),可能的原因为低浓度的二氧化氯即可破坏大肠埃希菌细胞核,使其DNA外溢;而酵母菌的细胞核在相同浓度作用下损伤较小,在培养液中仅检出少量DNA,细胞核的完整性使酵母菌保持较强的活力(图2C)。另外,不同真菌对药物的敏感性存在差异,比如Pereira等[23]发现,氯气对不同真菌的杀灭作用不一致,与培养真菌的基质有较大关系。本实验所用培养基可能对酵母菌有一定保护作用,导致其对低浓度二氧化氯不敏感。
以上结果表明,二氧化氯对褐腐菌、酵母菌和大肠埃希菌均有抑制作用,其抑制机理可能是二氧化氯使细菌细胞膜氧化,导致细胞膜破损,胞内电解质、蛋白质和DNA渗出,引起细菌死亡;此外,二氧化氯对细菌代谢酶有强烈的抑制作用,研究结果为二氧化氯作为安全无毒抑菌剂的推广应用提供了理论依据。二氧化氯的其他抑菌机制,如是否抑制蛋白的表达,是否改变细菌能量代谢和相关基因的表达等,有待进一步深入研究。
参 考 文 献
康慧芳. 不同保鲜剂处理对葡萄交链孢霉腐病抑制效果的研究[D]. 上海: 上海师范大学, 2020.
Liu Z L, Cao Z Y, Wang J, et al. Chlorine dioxide fumigation: An effective technology with industrial application potential for lowering aflatoxin content in peanuts and peanut products[J]. Food Control, 2022, 136: 108847.
Kim S, Lee H, Ryu J H, et al. Inactivation of Bacillus cereus spores on red chili peppers using a combined treatment of aqueous chlorine dioxide and hot-air drying[J]. J Food Sci, 2017, 82(8): 1892-1897.
代婭. 水蜜桃气调保鲜技术及不同处理保持果实硬度的机理研究[D]. 雅安: 四川农业大学, 2013.
李广锦. 外源NO在中华寿桃应答褐腐菌胁迫中的作用及其蛋白组学研究[D]. 泰安: 山东农业大学, 2017.
Abate D, Pastore C, Gerin D, et al. Characterization of monilinia spp. populations on stone fruit in south Italy[J]. Plant Dis, 2018, 102(9): 1708-1717.
殷晓慧, 王庆国, 张畅, 等. 桃果实褐腐病拮抗菌的筛选、鉴定及其拮抗活性[J]. 食品工业科技, 2017, 38(9): 128-132.
赵鲁宁. 水蜜桃炭疽病拮抗酵母菌的筛选、初步应用及其生防机理的研究[D]. 镇江: 江苏大学, 2018.
Tian S, Torres R, Ballester A R, et al. Molecular aspects in pathogen-fruit interactions: Virulence and resistance[J]. Postharvest Biol Tec, 2016, 122: 11-21.
陈淑宁. 桃褐腐病菌和炭疽病菌对DMI杀菌剂的抗性研究[D]. 武汉: 华中农业大学, 2017.
刘欣. 二氧化氯对指状青霉致病力的影响及其机制研究[D]. 济南: 齐鲁工业大学, 2021.
Guan J W, Lacombe A, Tang J M, et al. Use of mathematic models to describe the microbial inactivation on baby carrots by gaseous chlorine dioxide[J]. Food Control, 2020, 123: 107832.
吴路芳. 影响致病疫霉孢子囊畸变的活性物的筛选与初步利用[D]. 保定: 河北大学, 2020.
Wen G, Xu X Q, Zhu H, et al. Inactivation of four genera of dominant fungal spores in groundwater using UV and UV/PMS: Efficiency and mechanisms[J]. Chem Eeg J, 2017, 328: 619-628.
Ersoya Z G, Dincb O, Cinar B, et al. Comparative evaluation of disinfection mechanism of sodium hypochlorite chlorine dioxide and electroactivated water on Enterococcus faecalis[J]. Lwt-Food Sci Technol, 2019, 102: 205-213.
Tao N G, Jia L, Zhou H E. Anti-fungal activity of Citrus reticulata Blanco essential oil against Peniillium italicum and Penicillium digitatum[J]. Food Chem, 2014, 153: 265-271.
Yao Q, Shen Y F, Bu L, et al. Ultrasound-assisted aqueous extraction of total flavonoids and hydroxytyrosol from olive leaves optimized by response surface methodology[J]. Prep Biochem Biotech, 2019, 49(9): 837-845.
Yu Y, Shi J Y, Xie B Y, et al. Detoxification of aflatoxin B1 in corn by chlorine dioxide gas[J]. Food Chem, 2020, 328: 127121.
Ulrike P, Herppich W B, Hassenberg K, et al. Aqueous chlorine dioxide treatment of horticultural produce: Effects on microbial safety and produce quality-A review[J]. Crit Rev Food Sci, 2018, 58(2): 318-333.
Bridges D F, Lacomeb A, Wu V C. Integrity of the Escherichia coli O157: H7 cell wall and membranes after chlorine dioxide treatment[J]. Front Microbiol, 2020, 11: 888.
Tang W W, Zeng X P, Zhao Y S, et al. Disinfection effect and its mechanism of electrolyzed oxidizing water on spores of Bacillus subtilis var. niger[J]. Food Sci Bioteclonol, 2011, 20(4): 889-895.
Zhu C H,Chen Z, Yu G Y. Fungicidal mechanism of chlorine dioxide on Saccharomyces cerevisiae[J]. Ann Microbiol, 2013, 63(2): 495-502.
Pereira V J, Marques R, Marques M, et al. Free chlorine inactivation of fungi in drinking water sources[J]. Water Res, 2013, 47(2): 517-523.
