两株分离自木塑复合材料的腐朽真菌的分离鉴定及其腐朽性能研究
2023-12-30施庆珊苏皑庭黄健聪谢小保
冯 静,施庆珊,文 霞,苏皑庭,黄健聪,谢小保
1.广东省科学院微生物研究所,广东 广州 510070;2.广东省微生物分析检测中心,广东 广州 510070;3.华南应用微生物国家重点实验室,广东 广州 510070;4.广东省菌种保藏与应用重点实验室,广东 广州 510070
木塑复合材料是由木质纤维与热塑性塑料混配后经特殊工艺处理成型的一种新型材料,由于兼具木质和塑料的优点,且具有易加工、可生物降解、原料来源丰富等的特点,被广泛应用于建筑、家居、园林景观、包装运输及仓储等领域[1]。在木塑材料开发及应用的早期,由于木质纤维被塑料基体有效包裹,人们大多认为该材料具有足够的真菌抗性。然而,随着木质纤维含量的增加、产业的快速发展及应用领域的不断拓展,人们发现,木填充量高的木塑制品和天然木材一样,也会受到真菌、白蚁、藻类等生物因子的侵蚀,其中以真菌对木塑材料的危害最为严重[2-4]。
研究表明,在人工模拟加速试验条件下,多种腐朽真菌,如粉孢革菌(Coniophoraputeana)、采绒革盖菌(Coriolusversicolor)、密粘褶菌(Gloeophyllumtrabeum)、变色栓菌(Trametesversicolor)、 绵腐卧孔菌(Poriavaporaria)、洁丽香菇(Lentinuslepideus)、鲑色波斯特孔菌(Postia placenta)、裂褶菌(Schizophyium commune)、血红密孔菌(Pycnoporussanguineus)、瘤盖干酪菌(Tyromycespalustris)、深红密孔菌(Pycnoporuscoccineus) 及瘤盖拟层孔菌(Fomitopsispalustris)等均可侵染并攻击木塑材料,导致其质量减轻、力学及机械性能退化,吸水性能增加[5-12]。
然而,目前尚无有关实际生产和应用中危害木塑材料的真菌种群的研究报道。基于此,本研究通过采集被真菌侵染后受损的木塑复合材料,利用传统微生物学和现代分子生物学的方法对危害木塑材料的真菌进行分离鉴定,并对其腐朽性能进行相关测试,以确定在实际应用中危害木塑材料的主要真菌种群,有望为木塑材料真菌危害的相关控制策略及木塑材料真菌危害的相关国家标准的制定(如试验所用标准菌株的选择)提供前期的理论和数据支撑。
1 材料与方法
1.1 样品采集
受损木塑复合材料采集自安徽某木塑复合材料示范园区,表面可见真菌侵蚀及腐朽痕迹。将在自然条件下被真菌感染的木塑试样用无菌手术刀切割一部分并装于采样袋中带回实验室备用。
1.2 供试培养基
菌株的分离及纯化培养所用培养基为马铃薯葡萄糖琼脂培养基(PDA):马铃薯200.0 g/L,葡萄糖20.0 g/L,琼脂15.0 g/L。
菌株耐腐性能的测试采用河砂锯屑培养基,配置方法如下:在500 mL 培养瓶中分别加入洗净干河砂150 g(筛孔尺寸0.600~0.850 mm,粒度20~30目)、木屑15 g、玉米粉8.5 g、红糖1 g,拌匀平整后,在培养基表面放入各自分离的饲木3 块,再向培养瓶中徐徐加入100 mL 麦芽糖液(波梅氏比重1.03),于121 ℃高压蒸汽灭菌1 h,待冷却后接种。
1.3 菌株的分离及纯化
在无菌操作台上用湿润的无菌脱脂棉球轻轻擦拭受损木塑试样表面的真菌感染区域,用无菌双蒸水充分洗涤擦拭棉球后便可得到含真菌孢子的孢子原液。将该孢子原液按浓度梯度稀释后取适量涂布于PDA 平板上,于28 ℃培养箱中培养7 d 后,挑取单菌落转接于另一PDA 平板上,直至获得纯菌落。然后将其转接至PDA 斜面培养基上培养至菌株长满斜面,存放于4 ℃冰箱中,保存备用。
1.4 菌株的形态学鉴定
将获得的纯化菌株置于PDA 上培养7 d,观察菌落在PDA 平板上的形态特征。挑取PDA 上培养的真菌菌丝制作临时载玻片,以灭菌水为介质,采用Nikon E200 生物显微镜摄像系统观察菌丝及分生孢子的形态特征并进行显微拍照。从PDA 培养基上切取真菌菌落,经戊二醛固定、磷酸盐缓冲液(PBS)清洗、乙醇梯度脱水、叔丁醇置换、冷冻干燥并喷金后,用扫描电子显微镜(HITACHI S-3000N)观察菌丝及孢子的形态特征。综合菌株的平板培养特性及显微特征,参考相关真菌分类学资料进行形态鉴定。
1.5 菌株分子生物学鉴定
采用18S rRNA 及ITS 序列扩增法对菌株进行分子生物学鉴定。挑取PDA 上培养7~10 d 的真菌菌丝体,用Magen(美基)真菌DNA 提取试剂盒提取基因组DNA。以提取到的DNA 为模板,采用真菌通用18S rRNA 及ITS 序列引物进行PCR 扩增(表1)[13]。PCR 反应体系为50 μL: 2×Taq Master Mix 25 μL,Primer 1 (10 μmol/L)2 μL,Primer 2(10 μmol/L)2 μL,模板DNA 1 μL,用ddH2O 定容至50.0 μL。扩增程序:95 ℃预变性3 min,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min40 s,循环36次;72 ℃延伸15 min。PCR 扩增产物纯化后委托北京擎科生物科技有限公司广州分公司进行测序。
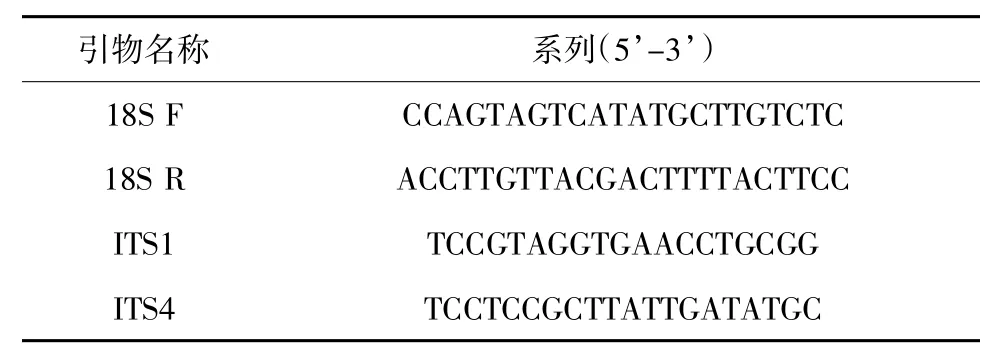
表1 真菌通用18S rRNA 及ITS 序列引物信息
在GenBank 中对获取的基因序列进行同源比对,下载相似序列后使用MEGA 6.0 构建系统发育树(Neighbor-joining 法),确定菌株分类。
1.6 腐朽性能测试
参照国家标准GB/T 13942.1-2009(木材耐久性能第1 部分:天然耐腐性实验室试验方法)进行[14]。取未经处理的天然黄瑾木材,加工切割成大小约50 mm×30 mm×10 mm 的样品。将木材样品放入105 ℃烘箱中烘至恒重后,对样品编号、称重(精确到0.0001g)并记录,将木材样品于121 ℃高压灭菌20 min 后备用。
使用无菌打孔器,对PDA 平板上培养7~10 d的菌丝块(直径约5 mm)进行切取。将这些菌丝块接入河砂木屑培养基的中央部分,并在28 ℃、相对湿度(RH)85%的培养箱中培养,直至菌丝完全覆盖培养基表面。在无菌条件下,轻轻将木材试样置于培养基的中间部位,每个样品设置4 个相同的对照组。将培养瓶置于28 ℃、RH 85%的条件下培养12 周后,取出木材试样,除去表面的菌丝和杂质。将其置于105 ℃烘箱中烘至恒定重量后使用称重器进行质量测量。按照以下公式计算木材试样在腐朽真菌侵染后的质量损失率。
式中:W1:木材试样腐朽试验前干重,W2:木材试样腐朽试验后干重。
1.7 红外光谱(FTIR)分析
取腐朽试验前后的黄槿木材试样品,在105 ℃烘箱中烘至恒重后,用刀片在样品表面刮取少许木屑,与KBr 混均压片后用Avatar 370 型傅里叶变换红外光谱仪(FTIR)(美国Thermo Nicolet 公司)进行红外光谱测定。扫描波长范围为4 000~450 cm-1,分辨率为4 cm-1,扫描32 次。
2 结果与讨论
2.1 菌株分离及形态学鉴定
对受损木塑试样上的真菌菌株进行分离纯化后得到两株腐朽真菌,编号分别为WPC-11 和WPC-12。两株菌株的平板菌落、显微形态及SEM 图如图1、2 所示。
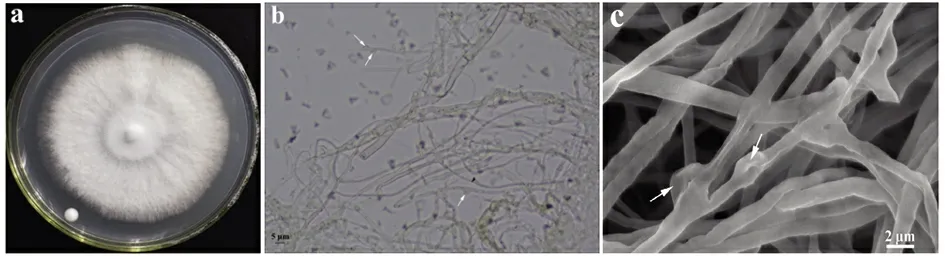
图1 腐朽真菌WPC-11 的平板(a)、显微镜(b)及SEM(c)图片
WPC-11 在PDA 平板上的菌落特征如下:菌落圆形,颜色为白色、不透明,菌丝细绒毛状,菌丝体发达,有明显腐朽味。菌丝生长速度较快,PDA 上培养7 d 后直径约为65 mm。光学显微镜下,可见菌丝系统的二体型,生殖菌丝无色,薄壁,具锁状联合(图1中白色箭头所示);骨架菌丝无色,厚壁,担孢子近球形,长椭圆形到椭圆形。SEM 扫描电镜下可见其菌丝无色、平滑,可清晰发现锁状联合结构上的锁状结构。
WPC-12 在PDA 平板上的菌落特征如图2 所示。由图可知,菌落圆形,颜色为白色至米白色,菌丝绒兼絮状,不产孢或产孢量极少,菌丝体发达,有明显腐朽味。菌丝生长速度快,PDA 上生长7 d 即可铺满整个平皿(直径90 mm)。光学显微镜下,可见菌丝系统二体型,生殖菌丝无锁状联合,无色,薄壁,分支很少;骨架至缠绕菌丝无色,厚壁,弯曲,多分枝;担孢子椭圆形至圆柱形,无色,薄壁,平滑。SEM扫描电镜下可见其菌丝无色、平滑。

图2 腐朽真菌WPC-12 的平板(a)、显微镜(b)及SEM(c)图片
2.2 菌株的分子生物学鉴定
通过扩增WPC-11 菌株ITS 和18S rDNA 片段,分别获得一条604 bp 和1639 bp 的基因序列。通过在GenBank 中进行序列比对分析,结果均显示WPC-11 菌株的序列与Perenniporia sp.属菌株的相似度最高。WPC-11 菌株基于ITS 序列同源性构建的系统发育进化树如图3 所示,WPC-11 以84%及78%的支持率与P.subtephropor、P.cinereofusca 聚在同一大支上,并以99%的支持率与P.vanhullii 排列在同一小分支上。结合形态学特征与分子生物学的鉴定结果,将WPC-11 鉴定为白腐菌多年卧孔菌属(Perenniporia sp.)菌株。
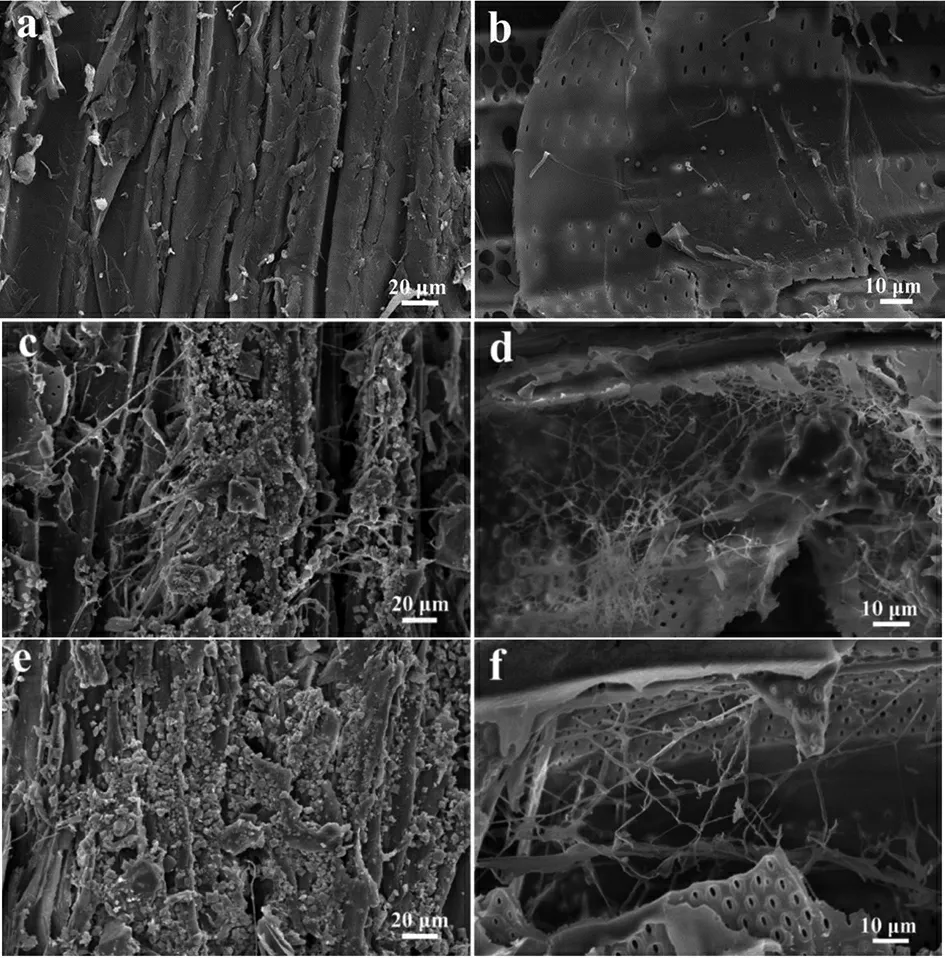
图3 菌株WPC-11 及WPC-12 腐朽前后黄瑾木材试样的SEM 图
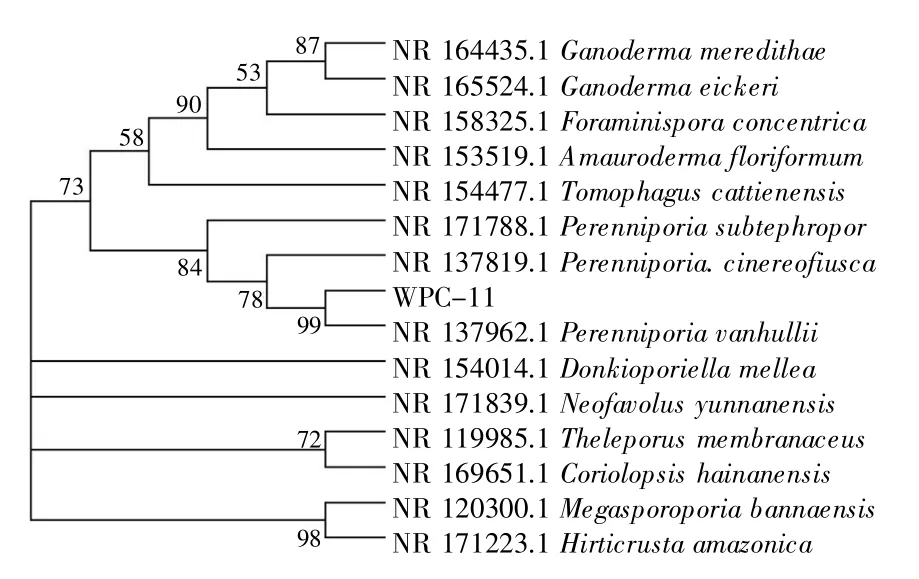
图3 木腐真菌WPC-11 的系统进化树构建
菌株WPC-12 的ITS 和18S rNDA 序列扩增后,分别获得一条638 bp 和1631 bp 的基因序列。将序列提交GenBank 并进行序列比对分析后发现,WPC-12 菌株的序列与Fomitopsis palustris 及F.bambusae 序列的相似性分别为99.82%及93.69%。基于ITS 序列同源性构建的WPC-12 菌株系统发育进化树(图4)显示,菌株WPC-12 以100%的支持率与F.palustris 和F.ochracea 菌株共处同一大分枝上,再以100%的支持率与F.ostreiformis 共处同一小分枝。综合菌株的形态学特征与分子生物学鉴定结果,将WPC-12 鉴定为褐腐菌拟层孔菌属(Fomitopsis sp.)菌株。
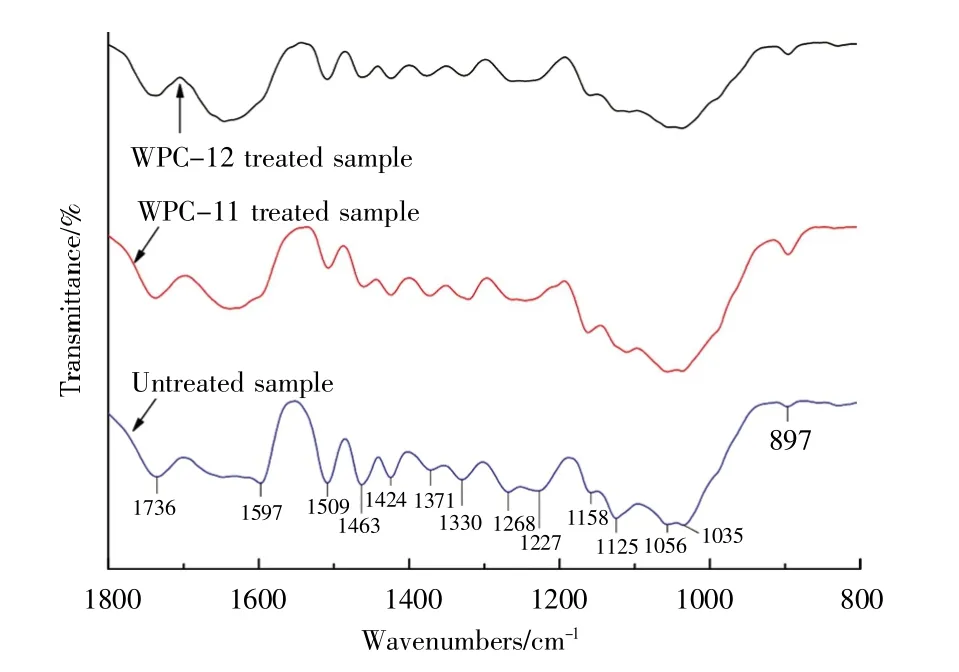
图4 菌株WPC-11 及WPC-12 腐朽前后黄瑾木材的红外光谱图

图4 木腐真菌WPC-12 的系统进化树构建
2.3 腐朽真菌的腐朽性能测试
以未经处理的黄瑾木材为试验材料,对WPC-11 和WPC-12 菌株的腐朽性能进行测试。表2 为黄瑾木材在腐朽试验前后的质量变化及腐朽12 周后的质量损失率。结果显示,两株腐朽真菌均导致木材试样产生极大的质量损失。在WPC-11 菌株腐朽处理12 周后,木材试样出现了39.06%的质量损失;而在WPC-12 菌株腐朽12 周后,木材试样的质量损失率为47.39%,高于菌株WPC-11 腐朽后木材试样的质量损失率,表明WPC-12 菌株的腐朽能力强于WPC-11。这可能与白腐菌及褐腐菌的作用特点相关,通常褐腐菌对木材的降解速度比白腐菌更快[15]。
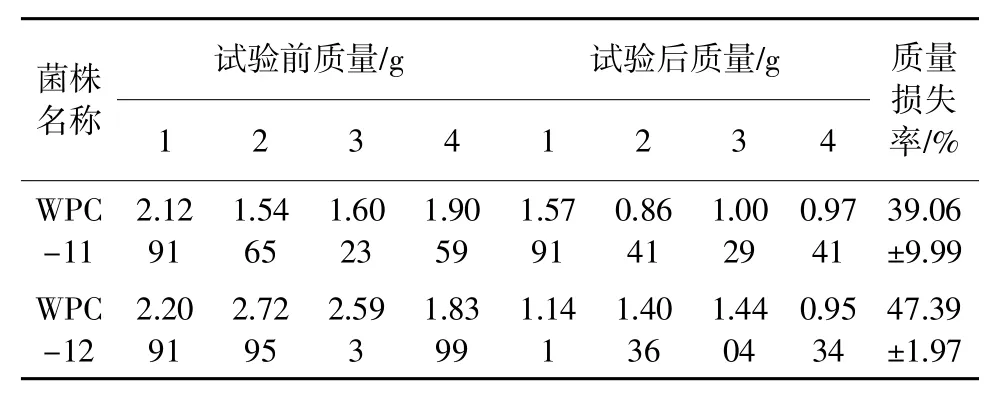
表2 黄瑾木材在腐朽试验前后的质量损失率
图3 为未经腐朽处理的对照黄瑾木材试样,及经WPC-11 与WPC-12 菌株处理12 周后黄瑾木材试样在扫描电镜下表面及内部形态的图片。由图可知,未腐朽木材试样表面平整光滑,组织结构完整(图3a);而经WPC-11 及WPC-12 腐朽后的木材试样表面破损,片状完整的木纤维断裂降解为颗粒状、碎片状或条状形态(图3c,e)。其中经WPC-12 菌株降解后的木试样表面的木质纤维几乎全部被降解为碎颗粒状(图3e),表明木材试样的纤维被WPC-12菌株严重破坏,腐朽情况十分严重。
木材试样腐朽前后的内部SEM 图片也可以清晰显示未腐朽试样的内部纤维呈完整的片状结构,可见排列整齐的纤维纹孔(图3b)。与之相比,经WPC-11 及WPC-12 菌株腐朽后的木材试样内壁分布大量菌丝,且菌丝穿透纹孔进入另一相邻细胞中会进一步侵蚀木质纤维,导致纤维结构出现断裂、破损或坍塌等迹象,片状完整的纤维结构被降解为絮状或丝状,木材试样被严重破坏及腐朽(图3d,f)。这一腐朽过程与前人有关木腐真菌对木材微观结构破坏的阐述一致[16-17]。
a,b: 腐朽前木材试样的表面(a)及内部(b)SEM 图;c,d: WPC-11 腐朽12 周后黄瑾木材的表面(c)及内部(d)SEM 图;e,f: WPC-12 腐朽12 周后黄瑾木材的表面(e)及内部(f)SEM 图。
2.4 腐朽试样的FTIR 分析
对腐朽前后的黄瑾木材试样进行红外光谱分析,结果如图4 所示。因木材纤维有机物主要官能团吸收峰多分布在1 800~800 cm-1的区域内,受杂质干扰较小,故通常认为该区域为木材红外光谱的特征指纹区。与未腐朽对照木材的FTIR 图谱相比,菌株WPC-11 及WPC-12 腐朽后的木材试样在1 736 cm-1、1 597 cm-1、1 509cm-1、1463 cm-1、1 424 cm-1、1 330 cm-1、1 268 cm-1及1 125 cm-1等吸收峰处峰值显著下降或特征峰消失,表明木材试样中的多种化学组分已被真菌降解。
与未腐朽的木材试样相比,白腐菌株WPC-11处理后的木材试样在表征木质素的多个特征峰(1 597 cm-1、1 509 cm-1、1 463 cm-1、1 268 cm-1、1 227 cm-1及1 125 cm-1)处吸收值均出现明显下降或峰值消失(1 597 cm-1)的情况,而在表征纤维素及半纤维素的特征峰(1 736 cm-1、1 424 cm-1)处下降不明显或略有下降。897 cm-1为表征多糖类物质中β-1,4-糖苷键振动的吸收峰,腐朽后该峰增强表明随着木质素被大量降解,细胞壁中多糖类物质的含量相对增加。上述结果表明白腐菌主要且优先降解细胞壁中的木质素,而纤维素及半纤维素仅被少量降解,木质素降解是造成腐朽后木材质量、强度和硬度下降的关键因素[17-21]。
褐腐真菌WPC-12 腐朽后,可见腐朽试材在表征纤维素和半纤维素特征峰(1 736 cm-1、1 424 cm-1)处的峰值下降比WPC-11 腐朽试材的下降幅度略大,但在表征木质素的系列特征峰(1 597 cm-1、1 509 cm-1、1 463 cm-1、1 268 cm-1、1 227 cm-1、1 125 cm-1)处的下降程度与WPC-11 相比无明显差异。同时,腐朽试样表征多糖类物质的897 cm-1与未腐朽试样相比无明显变化。这些结果表明褐腐真菌不仅能降解细胞壁中的纤维素和半纤维素,也会大量降解木质素[22-23],这也与前述WPC-12 菌株腐朽后黄瑾木材试样质量损失率更高的结果一致。
3 结论
从户外腐朽的木塑复合材料上,通过分离、纯化及培养,分离到两株腐朽真菌。结合菌株的平板菌落和显微形态特征以及ITS 序列和18S rDNA 的序列分析比对结果,明确WPC-11 为白腐菌多年卧孔菌属菌株,WPC-12 为褐腐菌拟层孔菌属菌株。腐朽性能测试结果表明,二株菌株对黄瑾木材造成了极为严重的侵蚀。在腐朽12 周时,WPC-11 和WPC-12 分别对黄瑾木材造成了39.06%及47.39%的质量损失。观察腐朽后木材试样的SEM 发现腐朽导致木材表面平整的纤维结构被降解为颗粒状、碎片状或条状,内部则可见菌丝通过纹孔结构侵蚀木质纤维,导致纤维出现了断裂、破损或坍塌等迹象。FTIR 分析结果表明,腐朽后,木材试样在表征纤维素、半纤维素和木质素的多个吸收峰处峰值下降,表明木材试样中的多种化学组分已被腐朽真菌降解。
