蒺藜生药粉及其水提取物的肝毒性作用机制研究
2023-12-30罗福祥马福昌艾西木江热甫卡提阿不都吉力力阿布都艾尼尤力都孜买买提库尔班尼沙麦提卡思木
罗福祥 马福昌 艾西木江·热甫卡提 阿不都吉力力·阿布都艾尼 窦 勤 尤力都孜·买买提 高 莉 库尔班尼沙·麦提卡思木
(1 新疆维吾尔自治区维吾尔医药研究所毒理学研究室,乌鲁木齐,830011; 2 新疆维吾尔自治区维吾尔医药研究所,新疆维吾尔自治区维吾尔医方剂学重点实验室,乌鲁木齐,830011)
蒺藜为蒺藜科植物蒺藜(TribulusterrestrisL.)的干燥成熟果实。中医认为其辛、苦,微温,有小毒,归肝经,用于平肝解郁,活血祛风,头痛眩晕,胸胁胀痛,乳闭乳痈,目赤翳障,风疹瘙痒[1]。蒺藜含有皂苷类、黄酮类等化合物[2],现代临床应用和毒理学研究发现蒺藜对肝脏具有一定的毒性作用[3-6],国家食品药品监督管理局药品评价中心早在2005年药品不良反应信息通报(第9期)发布了蒺藜复方白蚀丸不良反应的信息通报[7],因此,临床应用中需重点监测肝肾功能相关指标。目前,其肝毒性特点及作用机制均未见报道,本研究通过组织病理学、实时PCR、酶联免疫吸附试验法,从肝组织病理学、氧化应激、肝细胞极性改变相关及胆汁合成、转运、摄取、代谢相关基因蛋白表达变化等方面,探讨蒺藜的肝毒性作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 斯泼累格·多雷(Sprague-Dawley,SD)大鼠140只,鼠龄为4~6周,体质量130~150 g,雌雄各半,购自新疆医科大学,实验动物许可证号:SCXK(新)2018-0002,饲养条件为SPF(无特定病原体)屏障环境,室温为20~26 ℃,相对湿度为40%~70%,光照黑暗各12 h,动物使用许可证:SYXK(新)2021-0004。经新疆维吾尔医药研究所动物实验伦理委员会审批(伦理审批号:nGLP2020-007),根据中国国家动物保护局卫生和医学研究委员会动物条例用于科学目的的护理和使用。
1.1.2 药物 蒺藜生药粉,黄绿色粉末,由南通飞宇生物科技有限公司提供,批号:FY200619。蒺藜水提物,棕褐色粉末,由南通飞宇生物科技有限公司提供,批号:FY200616。提取方法:取一定量的蒺藜,粉碎,分别加10倍量的水回流提取3次,1 h/次,合并提取液,干燥得干浸膏,称重,计算浸膏得率为5%。
1.1.3 试剂与仪器 全自动生化分析仪(日立公司,日本,型号:7100型),脱水机(浙江金华科迪仪器设备有限公司,型号:KDTS3D),包埋机(浙江金华科迪仪器设备有限公司,型号:KD-BMII),切片机(LEICA,德国,型号:RM2235),PCR仪(Bio-Rad,美国,型号:MyCycler Thermal),酶标仪(Bio-Rad,美国,型号:xMarkTM)。超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒(江莱生物,批号:JL22893),谷胱甘肽(Glutathione,GSH)试剂盒(江莱生物,批号:JL21016),丙二醛(Malondialdehyde,MDA)试剂盒(江莱生物,批号:JL13297),BCA蛋白浓度测定试剂盒(北京索拉比奥科技有限公司,货号:PC0020),PCR引物:法尼酯X受体(Farnesoid X Receptor,FXR)(Bioss Inc.,批号:bs-22519R),过氧化物酶体增殖物激活受体α(Peroxisome Proliferator-activated Receptor,PPAR α)(Bioss Inc.,批号:bs-3614R),β-actin(Bioss Inc.,批号:bs-0061R),细胞色素7A1(Cytochrome P450 7A1,CYP7A1)[生工生物工程(上海)股份有限公司,批号:D161909]。
1.2 方法
1.2.1 剂量设置 蒺藜生药粉(JLF):临床拟服用量为6~10 g,按照成人体质量60 kg计算,临床拟用量为0.17 g生药/kg。其大鼠的等效剂量为1.071 g生药/kg,按照相关技术指导原则要求,长期毒性试验低剂量应高于动物等效剂量。因此试验选取2.125 g生药/kg作为JLF低剂量,以4.250 g生药/kg为JLF中剂量,8.500 g生药/kg为JLF高剂量,分别为临床用量的12.5、25、50倍。3个剂量呈1∶2∶4倍数关系,浓度分别为0.07、0.14、0.28 g供试品/mL,以期获得毒性的剂量-反应关系。蒺藜水提物(JLS):其提取率为5%,按照成人体质量60 kg计算,临床拟用量为0.17 g生药/kg,相当于0.008 5 g水提物/kg。按照相关技术指导原则要求,长期毒性试验低剂量应高于动物等效剂量。因此试验选取0.43 g水提物/kg作为JLS低剂量,以0.85 g水提物/kg为JLS中剂量,1.70 g水提物/kg为JLS高剂量,分别为临床用量的50、100、200倍。3个剂量呈1∶2∶4倍数关系,浓度分别为0.04、0.09、0.17 g供试品/mL,以期获得毒性的剂量-反应关系。
1.2.2 分组与给药 选取健康SD大鼠140只,雌雄各半,按随机数字表法随机分为正常对照组,蒺藜粉低、中、高剂量组,蒺藜水提物低、中、高剂量组。将蒺藜生药粉及蒺藜水提物分别用动物饮用水配制成相应给药浓度,10 mL/kg,灌胃给予SD大鼠。蒺藜生药粉低、中、高剂量组2次/d,蒺藜水提取物低、中、高剂量组1次/d,连续灌胃给予大鼠1个月,每日观察动物有无中毒情况发生。给药末次当晚,动物禁食不禁水,次日称取禁食体质量,1%戊巴比妥钠4 mL/kg腹腔注射进行麻醉解剖,腹主动脉采血进行血液学检测,取部分新鲜肝脏置于液氮中分装保存,部分肝脏组织置于10%的中性甲醛中制作病理切片,进行组织病理学观察。
1.2.3 血液生化检测 采用一次性真空采血管腹主动脉采血,内含分离胶+促凝剂(血清管),腹主动脉取血,立即轻轻混匀。采血后静置30 min,3 000 r/min,离心10 min,离心半径14 cm,分离血清,全自动血液生化分析仪检测大鼠血清中谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)、碱性磷酸酶(Alkaline Phosphatase,ALP)、总胆红素(Total Bilirubin,TBIL)的含量。
1.2.4 肝组织能量代谢相关指标检测 按照CBA蛋白浓度测定试剂盒说明书对各组大鼠肝脏组织样本进行蛋白进行定量,酶联免疫吸附试验法检测大鼠肝脏中相关代谢指标。具体按试剂盒操作,在反应终止后用酶标仪在450 nm波长依序测量各孔的吸光度值(A值)。按照公式计算得到吸光度比值,通过ELISACalc软件以吸光度比值为Y轴,以标准品浓度为X轴拟合标准曲线,进行计算得到样本含量。
1.2.5 PCR检测肝组织中FXR、CYP7A1、PPAR α的表达 肝脏组织样本用液氮充分研磨,取50 mg于离心管中,加1 mL Trizol充分混匀,室温静置10 min至组织完全裂解。加200 μL氯仿混匀放置5 min。4 ℃,12 000 r/min,离心15 min,离心半径8.5 cm。取上清于另一新离心管中,加入等体积异丙醇混匀,-20 ℃静置30 min。4 ℃,于12 000 r/min,离心15 min,离心半径8.5 cm,弃上清液。加入75%乙醇,使沉淀漂浮起来洗涤。4 ℃,12 000 r/min,离心15 min,离心半径8.5 cm,弃上清,重复步骤1次。空管离心,吸尽液体,晾干。用RNase free水溶解沉淀。核酸蛋白定量仪检测RNA纯度,琼脂糖凝胶电泳检测RNA完整性。剩余RNA置于-80 ℃保存或直接反转录成第一链cDNA,用于后续实验。第一链cDNA合成混匀后25 ℃反应10 min,42 ℃反应30 min,85 ℃反应5 s取出,结束反转录实验。将反转录得到的cDNA置于-80 ℃保存,用于后续实验。荧光定量引物信息见表1。

表1 荧光定量引物信息

2 结果
2.1 一般观察 未发现大鼠一般形态外观、状况活动、饮食情况、分泌物、排泄物等异常。给药结束解剖大鼠观察,结果蒺藜生药粉、蒺藜水提取物均可引起大鼠肝脏颜色变深,但与正常对照组比较,给药各组肝重量、肝系数均无明显变化。见表2。
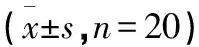
表2 蒺藜对SD大鼠肝脏系数的影响
2.2 血液生化学检测结果 与正常对照组比较,给药各组TBIL、ALP无显著变化,差异无统计学意义(P>0.05);JLF高剂量组GOT显著升高,差异有统计学意义(P<0.01),JLS高剂量组GOT、GPT显著升高,差异有统计学意义(P<0.05,P<0.01)。见表3。
2.3 肝组织能量代谢相关指标检测结果 与正常对照组比较,蒺藜生药粉各剂量组大鼠肝组织中GSH、MDA、SOD蛋白表达均差异无统计学意义;蒺藜水提取物高剂量组GSH表达显著升高(P<0.05),中、高剂量组MDA蛋白表达显著升高(P<0.01),低剂量组SOD显著降低(P<0.05)。见表4。
2.4 FXR、CYP7A1、PPAR α蛋白表达结果 与正常对照组比较,蒺藜生药粉各剂量组大鼠肝组织中FXR、PPAR α蛋白表达,差异无统计学意义(P>0.05),蒺藜生药粉中、高剂量组CYP7A1表达显著升高,差异有统计学意义(P<0.05或P<0.01)。与正常对照组比较,蒺藜水提物各剂量组大鼠肝组织中FXR蛋白表达,差异无统计学意义(P>0.05),蒺藜中剂量组CYP7A1表达显著升高(P<0.01),蒺藜高剂量组PPARα显著降低(P<0.01)。见表5。
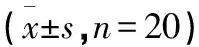
表3 蒺藜生药粉及水提取物对SD大鼠血生化指标的影响

表4 蒺藜生药粉及水提取物对SD大鼠肝组织能量代谢相关指标的影响
2.5 组织病理学结果 蒺藜生药粉、蒺藜水提取物分别以相应浓度经口给予SD大鼠1个月,结果蒺藜生药粉、蒺藜水提取物均可引起大鼠肝脏颜色变深。组织病理学检查JLF中、高剂量组及JLS各剂量组均可见肝细胞水肿、肝细胞脂肪变性,灶状炎症细胞浸润,且蒺藜水提取物程度更深。组织病理学结果显示,蒺藜可能对肝脏具有一定的毒性作用。见图1。
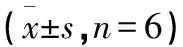
表5 蒺藜生药粉及水提取物对SD大鼠肝组织FXR、 CYP7A1、PPAR α表达的影响
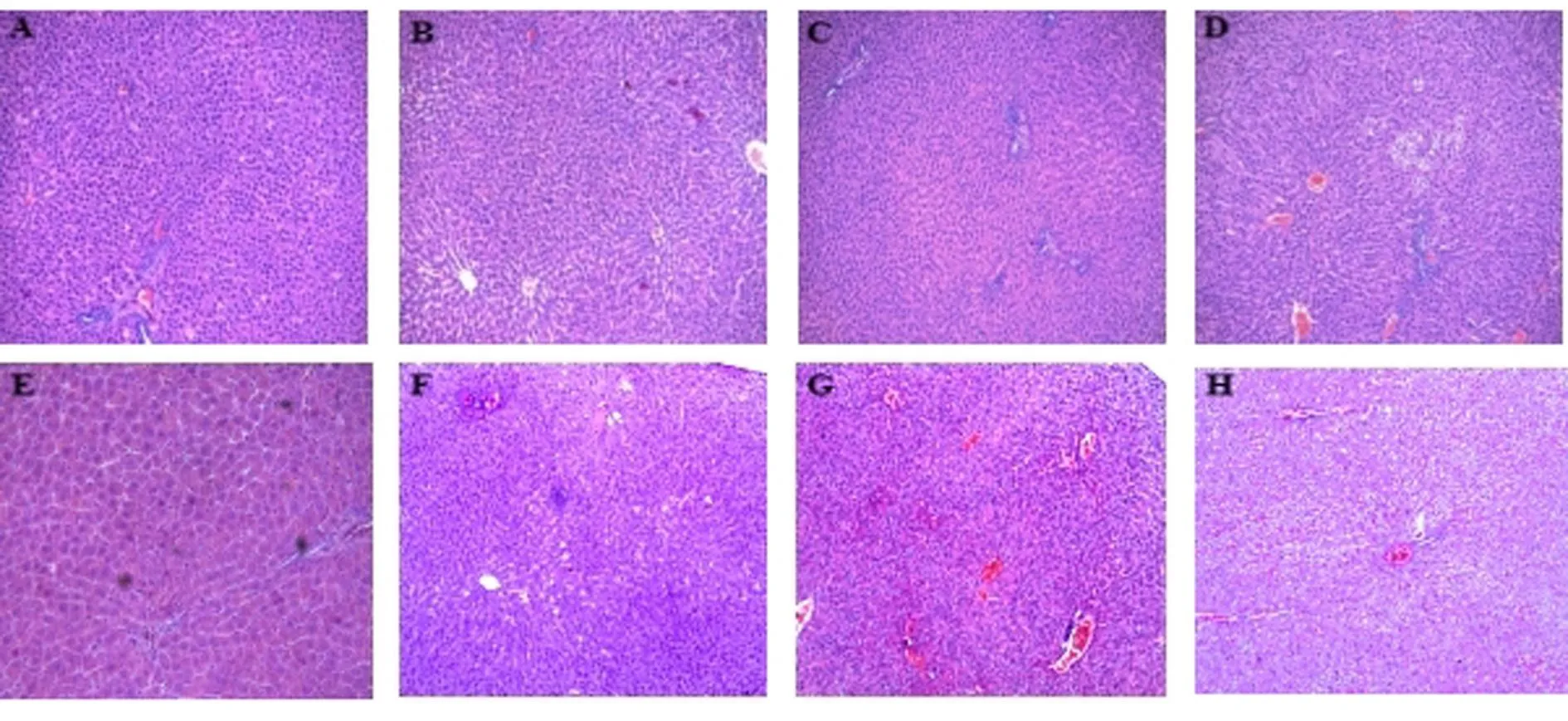
图1 蒺藜生药粉及水提物对SD大鼠肝脏组织形态学影响(HE染色,×100)
3 讨论
中药药源性肝损伤是药物及其代谢物直接损害肝脏所致,可细分为肝细胞型、胆汁淤积型和混合型肝损伤[8-9]。中药肝毒性的评价多以肝细胞直接毒性为考察指标[10],当肝脏受到一定损伤时,会导致肝细胞变性、坏死,使细胞内容物溢出进入血液,而血清或者血浆中GOT、GPT等相关酶含量或活性变化是临床评价肝细胞受损程度的重要指标[11-13]。NO是一种活性很强的自由基[14],在体内的最终氧化产物为MDA,而MDA具有潜在的细胞毒性,可攻击神经元细胞功能蛋白,改变其活性,进而影响细胞的正常功能,其含量高低反映了组织过氧化损伤的程度[15-16]。CYP7A1是CYP450酶系中重要的亚型,在肝脏中,CYP7A1的活性与药物的毒性密切相关[17-18]。PPAR α是由配体激活的转录调节因子,参与炎症反应、凋亡和脂质代谢[19],对药物性肝毒性等具有调控作用,当激活PPAR α后,会抑制肝细胞缺氧/复氧损伤后SOD和GSH的失活,减少活性氧生成并加速其消除,同时降低细胞内MDA的含量,抑制肝细胞缺氧/复氧损伤的脂质过氧化反应,减轻大鼠肝细胞缺氧/复氧损伤的氧化应激损伤,保护肝脏功能[20]。
本实验结果显示,蒺藜粉高剂量组可引起大鼠GOT的显著升高,而蒺藜水提物高剂量组大鼠GOT、GPT的均显著升高,表明高剂量的蒺藜粉末和蒺藜水提物均能对大鼠肝脏产生影响,且蒺藜水提物对大鼠肝脏的影响更为严重。通过对大鼠肝组织能量代谢相关指标和相关因子检测表明,蒺藜水提物组大鼠PPAR α表达显著降低,而CYP7A1、MDA的表达显著升高。因此,抑制PPAR α表达,促使CYP7A1、MDA的过盛表达可能是蒺藜引起肝毒性的原因之一。而实验中GSH呈现升高趋势、SOD未见明显的变化趋势,这可能是药物有效成分对肝脏的影响,具体GSH的升高是否与药物有效成分有关,还需要进一步研究。
利益冲突声明:无。
