超高效液相色谱—三重四极杆质谱法测定黄瓜中双炔酰菌胺残留
2023-12-28张周莉罗星宇
张周莉 黎 东 罗 斯 罗星宇 雍 萍 易 达
(南充市食品药品检验所,四川 南充 637000)
双炔酰菌胺(mandipropamid,MPD)是一种商品化的扁桃酸酰胺类杀菌剂[1],属于羧酸酰胺类(carboxyl acid amide, CAA)杀菌剂族[2],目前主要应用于黄瓜霜霉菌[3]、荔枝霜疫霉菌[4]、葡萄霜霉病[5]、辣椒疫霉病[6]、马铃薯晚疫病[7]、番茄晚疫病[8]、“烂芋皮”病[9]等的防治。MPD是通过干扰致病真菌的磷脂生成,以及阻止细胞壁沉积物的生物合成,来达到抑制孢子囊产生和菌丝体生长[10-11]的目的,表现出对游动孢子的萌发有明显抑制作用[12],尤其是对由卵菌引起的叶部和果实病害具有较好的防治效果。
2019年2月13日,欧洲食品安全局(EFSA)修订了MPD在各种蔬菜中的最大残留限量[13];2019年3月22日,美国环保署发布的2019-05406号文件中,规定了MPD在部分豆类及蔬菜中的残留限量[14]。研究表明,MPD易在果蔬中残留[15],会对环境、土壤造成一定程度的污染,且其降解过程缓慢,主要依靠微生物进行降解[16]。同时,MPD的残留也会对食品的香气成分的潜在变化造成一定程度的影响,影响产品品质。González-lvarez等[17]研究发现,由MPD处理后的葡萄加工制得的葡萄酒中的2-苯乙醇含量明显增加。GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》中,虽然规定了MPD在20种食品或农产品、药用植物中的残留限量,但均为临时限量且未匹配相应的检测方法。此外,GB 23200.113—2018和GB/T 20769—2008中均未涉及MPD的检测,GB 23200.121—2021中虽有列出MPD的检测方法,但其洗脱时间长,易受基质物质干扰。
目前,有关MPD的分析方法主要有液相色谱法(LC)[18-19]和液相质谱法(LC-MS)[20-21]。MPD常常被用于治疗黄瓜霜霉病[22],但其在黄瓜中的半衰期长[18]。课题团队[23]前期通过高效液相色谱法建立了一种准确度和精密度高,线性关系良好的黄瓜中MPD残留量的测定方法。研究拟采用乙腈提取样品,QuEChERS法净化提取液, UPLC-MS方法检测,开发一种黄瓜中MPD残留量的定性及定量分析方法,旨在为MPD的安全使用和风险监测提供一定的参考。
1 材料与方法
1.1 材料与试剂
MPD标准品:100 μg/mL,北京坛墨质检科技有限公司;
乙腈、甲酸:色谱纯,美国Fisher公司;
无水硫酸镁、氯化钠:分析纯,成都市科隆化学品有限公司;
柠檬酸钠二水化合物、柠檬酸二钠盐倍半水化合物:分析纯,中国医药集团有限公司;
乙二胺-N-丙基硅烷化硅胶(PSA,40~60 μm)、石墨化炭黑(GCB,40~120 μm):深圳逗点生物技术有限公司;
0.22 μm有机过滤膜:美国Ameritech公司;
实验室用水为Milli-Q超纯水;
黄瓜:市售。
1.2 仪器与设备
三重四极杆液质联用仪:QTRAP®4500型,美国AB SCIEX公司;
精密分析天平:ML203/02型,上海Mettler Toledo公司;
涡旋振荡器:Multi-Reax型,德国Heidolph公司;
冷冻离心机:5810R型,德国Eppendorf公司;
超声仪:KQ-700DE型,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 样品前处理 按GB 2763—2021中附录A的规定执行。
1.3.2 样品处理 在前期试验[23]的基础上稍加改进。称取匀浆后的10 g(精确至0.001 g)试样于50 mL离心管中,精确加入10 mL乙腈,剧烈振荡2 min,超声5 min,加入提取包(4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠二水化合物、0.5 g柠檬酸二钠盐倍半水化合物),剧烈振荡混匀2 min,4 000 r/min离心10 min。定量吸取5 mL上清液,依次加入150 mg无水硫酸镁、25 mg PSA、2.5 mg GCB,涡旋混匀2 min,4 000 r/min离心10 min,吸取上清液过 0.22 μm有机微孔滤膜,待上机测定。
1.3.3 标准溶液配制 准确吸取1 mL MPD标准溶液于100 mL容量瓶中,用超纯水定容,得到1 μg/mL的MPD标准储备溶液。
(1) 溶剂标准溶液配制:精确吸取一定量的标准储备溶液,分别用50%乙腈水溶液稀释成0.01,0.05,0.10,0.20,0.50 μg/mL的溶剂标准工作液。
(2) 黄瓜基质标准溶液配制:称取空白样品,依次按1.3.1和1.3.2的方法处理,得到空白基质溶液,按V超纯水∶V空白基质溶液为1∶1混合并充分混匀,得到50%空白基质溶液。精确吸取一定量的标准储备溶液,用50%空白基质溶液配制成质量浓度分别为0.01,0.05,0.10,0.20,0.5 μg/mL的基质匹配标准工作溶液。
1.3.4 液相色谱—串联质谱分析
(1) 液相色谱条件:色谱柱为Shim-pack GIST C18柱(2.1 mm×100 mm,2.0 μm);流动相A为0.1%甲酸水,流动相B为乙腈;洗脱速度0.3 mL/min;进样体积1 μL;柱温40 ℃。液相色谱洗脱程序见表1。
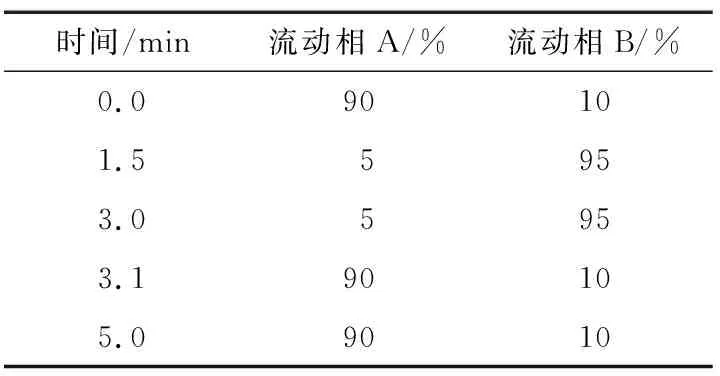
表1 液相色谱洗脱程序
(2) 质谱条件:ESI离子源;正离子模式:检测方式为MRM;气帘气0.207 MPa;离子化电压5 500 V;离子源温度450 ℃;喷雾气0.345 MPa;辅助加热气0.345 MPa;母离子、子离子、去簇电压和碰撞能量见表2。
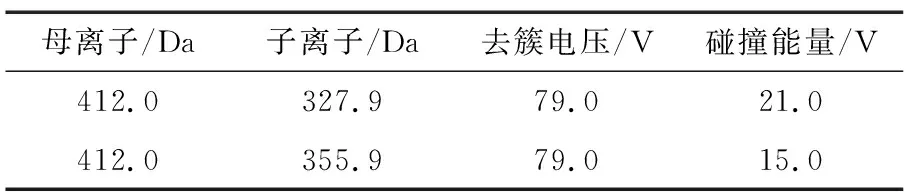
表2 质谱条件
1.4 定性判断
试样中MPD色谱峰的保留时间与MPD标准溶液的保留时间应当一致,变化范围在±2.5%以内,且同时应检测到2对离子。样品中MPD的2对离子的相对丰度比与浓度相当标准溶液的相对丰度比符合表3规定,则判定该样品中存在MPD为阳性。

表3 定性判断依据
1.5 回收率和精密度
称取阴性黄瓜样品3份,分别加入0.1,0.5,1.0 mL的MPD标准储备溶液,其他处理步骤同样品处理。
1.6 检出限与定量限
取标准曲线第1个点的标准溶液,通过UPLC-MS仪进行分析,测其信噪比,以S/N=3计算检出限(LOD),以S/N=10计算定量限(LOQ)。
1.7 数据处理
通过Analyst®软件采集试验数据,通过Sciex OS-MQ软件进行数据分析处理,结果使用外标法进行定量计算,并按式(1)计算样品中MPD含量。
(1)
式中:
X——样品中MPD含量,mg/kg;
c——测得质量浓度,μg/mL;
V——定容体积,mL;
m——称样量,g;
f——稀释倍数。
2 结果与分析
2.1 质谱条件优化
将0.1 μg/mL的MPD标准溶液以针泵注射的方式进行MPD的一级质谱母离子全扫描,确定出准分子离子质量数为412.0 Da。由图1可知,MPD具有一个手性碳原子,由一对对映异构体组成,结合化学结构分析,母离子受到电子轰击后,极易失去末端丙炔的碳原子或造成末端乙炔断裂,分别生成醇或酚[24]。

图1 双炔酰菌胺可能的裂解途径
将准分子离子作为母离子进行二级质谱扫描,经质谱扫描后得到离子碎片如图2所示。其中,355.9,327.9,204.0,125.1 Da的响应值明显高于其他碎片离子的。
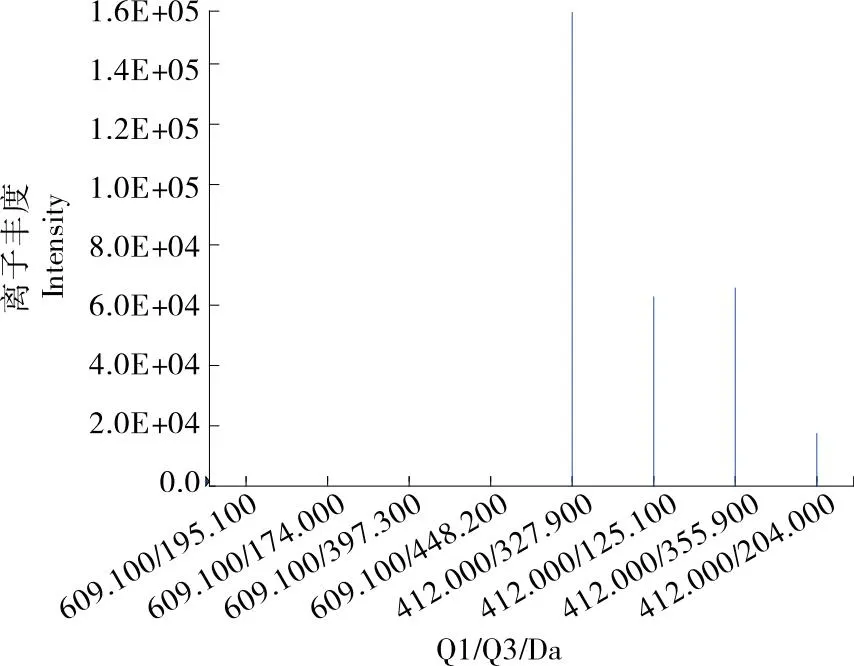
图2 双炔酰菌胺的子离子碎片
将得到的4组离子对分别固定去簇电压和碰撞能量,并对其进行优化,使离子碎片的响应达到最高,优化后的质谱条件见表4。

表4 质谱条件
2.2 色谱条件优化
查阅相关文献发现,当在正离子模式下采用MRM方式扫描目标化合物时,有机相通常选用乙腈或甲醇溶液[25],水相通常选用甲酸水、乙酸铵水溶液或两者的混合溶液[26]。分别采用甲醇—水、乙腈—水作为流动相,考察不同流动相条件下MPD的分离和响应情况。结果表明,在相同的仪器条件下,当流动相为乙腈时,MPD的响应更高且峰型良好。因此,采用乙腈—水体系作为流动相。进一步对乙腈—水、乙腈—0.1%甲酸水、乙腈—乙酸铵水的体系进行比较,随着甲酸的加入,MPD的分离度更高、峰型更好且保留时间稳定,响应值较高。通过对乙腈—甲酸水体系和乙腈—乙酸胺水体系的比较,发现乙腈—0.1%甲酸水体系的峰型更好,分离度更高。因此,选择乙腈—0.1%甲酸水溶液作为流动相。
2.3 离子对的选择
通过查阅文献发现,有学者[27]将412.0/327.9,412.0/125.1分别作为定量离子对和定性离子对的情况,也有学者[28]将412.0/327.9,412.0/355.9分别作为定量离子对和定性离子对的情况。这是由于在不同的仪器条件和试验环境下,不同离子对的响应有所不同。将质量浓度为0.01 μg/mL的MPD标准溶液在优化后的质谱和色谱条件下进行分析,提取离子流色谱图和信噪比如图3所示。
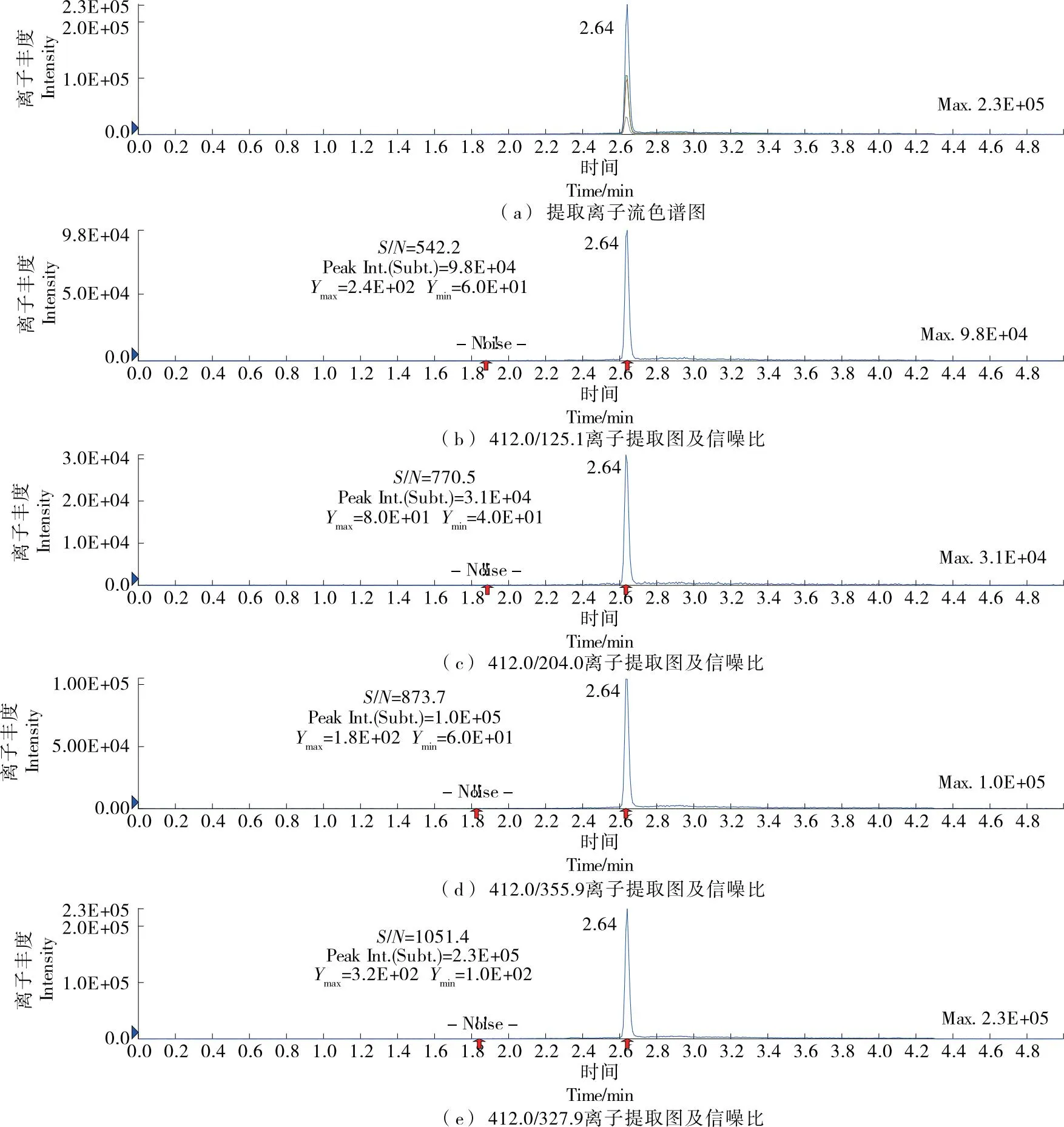
图3 双炔酰菌胺XIC图及信噪比图
由图3可知,412.0/327.9,412.0/355.9两对离子对具有较强的信号强度和较高的信噪比,与李建敏[28]的结果相似,这可能与所采用的仪器品牌和型号比较接近,MPD响应具有一定相似性有关。通常将响应强度相对较大的离子碎片设定为定量离子,响应强度相对较弱的离子碎片设定为定性离子,由图3可知,327.9离子碎片的响应值较355.9离子碎片的高,故选取412.0/327.9作为定量离子对,412.0/355.9作为定性离子对。
2.4 基质效应
分别配制黄瓜基质标准曲线和溶剂标准曲线,采用标准曲线斜率比较法来进行基质效应评价。将溶剂标准溶液和黄瓜基质标准溶液分别注入仪器进行测定,以MPD浓度为X轴、412.0/327.9定量离子峰面积为Y轴作标准曲线。结果表明,在0.01~0.50 μg/mL范围内,两组标准工作液的标准曲线线性关系均良好。黄瓜基质标准曲线斜率对溶剂标准曲线斜率的比值为 0.95,在0.8~1.2范围内,基质效应不明显,说明黄瓜基质对MPD含量检测结果的影响较小。这可能是由于试验过程中在样品提取净化后加入一定量的超纯水对样品进行稀释后再上机检测,使得进入检测仪器的基质浓度降低,减弱了基质干扰。因此,结合试验操作的简便和检测结果的准确性等综合因素考察,采用50%乙腈水作为溶剂配制标准曲线。
2.5 标准曲线
将溶剂标准曲线注入UPLC-MS中,以标准工作液质量浓度为X轴,以MPD定量离子的质量色谱峰面积为Y轴进行线性回归建立标准曲线,结果见图4。

图4 双炔酰菌胺标准曲线图
由图4可知,在优化后的仪器条件下,MPD保留时间为2.64 min,峰型较好,无明显拖尾或前移等情况,也未出现异常峰,响应值能满足定量需求。通过相对丰度比计算,符合表3的判定要求。当MPD质量浓度为0.01~0.50 μg/mL时,标曲的线性关系良好,其回归方程为Y=16 969X-11 086,R2=0.999 8,符合试验要求。
2.6 回收率和精密度
在阴性黄瓜样品中分别添加1,5,10倍定量限浓度的MPD标准溶液进行回收率试验,计算出精密度结果见表5。

表5 黄瓜中添加双炔酰菌胺标准品的回收率和精密度试验结果
由表5可知,黄瓜中MPD的回收率分别为89.6%,93.8%,96.0%,RSD为0.72%~1.80%。彭茂民等[29]用酸化后的乙腈提取番茄并通过分散固相萃取法(QuEChERS)净化,再采用UPLC-MS-MS测定其中MPD残留量,平均回收率为84.5%~98.4%,与试验结果相似。MPD回收率为89.6%~96.0%,说明试验方法对黄瓜的处理步骤能在有效排除杂质干扰的基础上,尽可能地弱化其他试验因素对MPD残留量检测的影响,测定结果与真实值接近。
2.7 检出限
取标准曲线第1个点的标准溶液,即质量浓度为0.01 μg/mL的MPD溶液注入UPLC-MS,测得信噪比。以正离子模式信噪比为响应,按照S/N=3或10代入计算,测得LOD值和LOQ值分别为0.003,0.009 mg/kg。
2.8 实际样品检测
随机在市场上抽取10份黄瓜作为待测样品,按照试验步骤处理、上机分析,样品中MPD含量结果见表6。
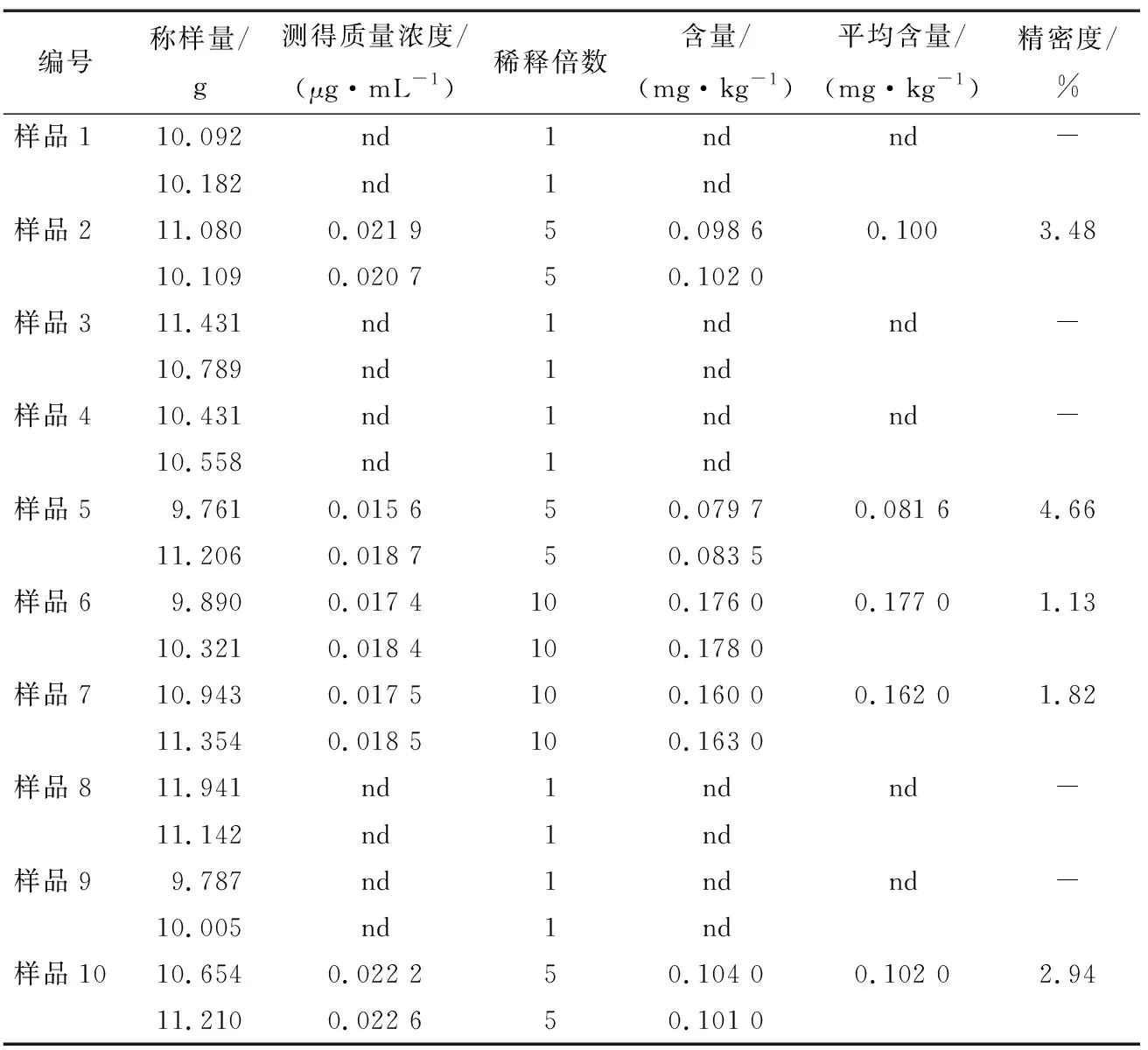
表6 黄瓜中双炔酰菌胺含量测定结果†
抽检的10份黄瓜中,有5份样品中检出MPD残留,范围为0.081 6~0.177 mg/kg,检出率达50%。GB 2763—2021中规定,MPD的ADI值为0.2 mg/kg·BW,且黄瓜中MPD的临时最大残留限量为0.2 mg/kg,说明此次抽检的样品存在不同程度使用MPD农药的情况,但是均未超出标准所允许残留的最大限值。
3 结论
采用UPLC-MS法对黄瓜中双炔酰菌胺进行检测,分别优化了质谱、色谱条件并考察了不同流动相的洗脱效果以及基质效应的影响。结果表明,样品经QuEChERS法净化后用0.1%甲酸水和乙腈作为流动相进行测定,线性关系良好,回收率及精密度等符合分析要求。该方法操作简便快捷、准确度高、稳定性好、用时短,满足黄瓜中双炔酰菌胺残留量的分析测定。后续可考察试验方法对其他品种的水果或蔬菜中双炔酰菌胺残留量的测定,不断优化检测方法,加强对双炔酰菌胺应用的风险监测。
