钙型糖柱—高效液相色谱—蒸发光散射检测器法测定牛乳中的乳糖
2023-12-28朱小朋付尚辰牛鹏飞刘永峰
朱小朋 付尚辰 郝 果 牛鹏飞 刘永峰
(1. 陕西师范大学食品工程与营养科学学院,陕西 西安 710062;2. 富平县检验检测中心,陕西 渭南 711700)
乳糖是牛乳中存在的主要碳水化合物[1]。乳糖检测方法多样,主要包括酶法、生物传感器法、核磁共振法、红外光谱法、分光光度法等[2]。传统的酶法通常先将乳糖水解为葡萄糖和半乳糖,然后用葡萄糖试剂盒或半乳糖试剂盒通过测量还原态烟酰胺腺嘌呤二核苷酸来定量乳糖。然而在实际应用中酶法检测存在虚高现象,因为低乳糖样品中存在低聚半乳糖,其在试剂盒的初始反应中也被β-半乳糖苷酶水解,导致葡萄糖或半乳糖的测量结果偏高,乳糖结果也相应偏高[3]。生物传感器法快速易操作且成本低,通过增加葡萄糖浓度来分析监测水解过程中的乳糖水平,但是较高浓度的葡萄糖会产生干扰[4]。核磁共振法可直接对样品进行测定,但是有研究[5]发现,当乳糖质量浓度<100 mg/L时,与乳糖相关的质子信号与来自牛乳基质的其他信号重叠,无法可靠定量。红外光谱法需要大量样本建立预测模型,过程复杂耗时较长,水分子对红外的吸收也会干扰液体样品检测[6]。分光光度分析方法简便、快捷,但是不适合大样本的分析[7]。
为实现乳糖含量的准确快速检测,试验选用高效液相色谱法(high performance liquid chromatography,HPLC)。它是分析碳水化合物最常用的技术,其检测效率高、灵敏度高、易于操作。其中检测器的选择决定检测结果的可靠性,色谱柱的选择决定分离组分的分离度以及达到的检测限[8-9]。示差折光检测器(refractive index detector,RID)对糖类检测灵敏度较高,但是RID易受温度、流速、流动相等因素影响,存在基线稳定性差、灵敏度低、与梯度洗脱不相容等问题[10]。蒸发光散射检测器(evaporative light scattering detector,ELSD)与RID相比具有较好的稳定性和分离能力,灵敏度高、基线稳定、无溶剂峰干扰,对糖类的测定有良好的应用前景[11]。糖类色谱分析中常用凝胶柱、氨基柱和糖分析柱。凝胶柱常以聚合凝胶作为柱填料,但其孔径较大适用于多聚糖和高聚糖的测定。氨基柱以多孔硅胶为基质,但由于其键合的氨丙基易水解从而缩短了氨基柱的使用寿命[12]。而糖柱分离条件简单、专一性强[13-14]。钙型糖柱常用于检测糖和糖醇,具有较高的分离效率和分辨率、检测快、再生方法简单,已有研究[15]将钙型糖柱用于菊芋块茎中菊粉的定量分析。
现有研究方法检测耗时较长、还存在检测结果偏高的现象[2-7]。因此,需要一种快速准确的方法实现乳糖含量的检测。研究以钙型糖柱结合HPLC-ELSD建立牛乳中乳糖的测定方法,为牛乳质量控制及合理利用提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
生牛乳:采集于陕西省西安市长安区奶牛养殖场的健康泌乳期奶牛,采集后放在冰盒中(4 ℃)带回放入-80 ℃冰箱备用(用于钙型糖柱法的相关试验);
11种商品液态乳(编号1~11,其中:6号样品为鲜牛乳,10号样品为无乳糖牛乳):市售;
钙型糖柱:300 mm×7.8 mm,5 μm,美国飞诺美公司;
ZORBAX氨基柱:250 mm×4.6 mm,5 μm,美国安捷伦公司;
乳糖标准品、葡萄糖标准品、半乳糖标准品:纯度≥99%,上海源叶生物科技有限公司;
乙腈:色谱纯,湖北弗顿科技术有限公司;
其他试剂均为分析纯。
1.2 仪器与设备
高效液相色谱仪:ΜltiMate3000型,美国赛默飞公司;
蒸发光散射检测器:ELSD6000型,美国赛默飞公司;
数显电子天平:BSA224S-CW型,赛多利斯科学仪器有限公司;
高速台式冷冻离心机:TGL-16gR型,上海安亭科学仪器厂;
超声清洗器:KQ3200B型,昆山市超声仪器有限公司。
1.3 钙型糖柱法测定乳糖
1.3.1 样品溶液制备 生牛乳混匀后称取5.000 g于50 mL容量瓶中,加入不同质量浓度(0.2,0.3,0.4 g/mL)三氯乙酸溶液(trichloroacetic acid,TCA)5 mL,震荡摇匀并用水定容至50 mL,随后用滤纸过滤除去沉淀。取适量滤液稀释100倍后用0.45 μm微孔滤膜过滤后进行检测。空白样品称取水5.000 g于50 mL容量瓶中,后续步骤同上。
1.3.2 乳糖标准品溶液制备 准确称取乳糖标准品20.0 mg,加入2.0 mL水溶解,得到质量浓度为10.0 mg/mL的乳糖标准储备液,将乳糖标准储备液分别稀释500,250,200,125,100倍,以此来配制质量浓度分别为20.0,40.0,50.0,80.0,100.0 mg/L的乳糖标准工作液。于4 ℃冰箱中贮藏备用。
1.3.3 液相色谱条件 色谱柱为钙型糖柱(300 mm×7.8 mm,5 μm);流动相为纯水;柱温60 ℃;进样量20 μL;蒸发光散射检测器条件:飘移管温度115 ℃;气流量3.2 L/min,撞击器关闭;流速:使用0.9,1.0 mL/min进行优化。
1.3.4 方法学考察
(1) 线性关系:将1.3.2配制的20.0,40.0,50.0,80.0,100.0 mg/L乳糖标准工作液按照1.3.3色谱条件进行测定,记录峰面积并按式(1)计算乳糖质量浓度,以乳糖质量浓度(X1)为横坐标、乳糖峰面积(Y1)为纵坐标进行线性回归分析。
(1)
式中:
X1——试样中乳糖的含量,mg/g;
C1——样液中乳糖质量浓度,mg/L;
C0——空白中乳糖质量浓度,mg/L;
V1——试样定容体积,L;
n1——样液稀释倍数;
m1——试样质量,g。
(2) 定量限和检出限:选取信噪比(S/N)为10时的乳糖质量浓度作为定量限,信噪比(S/N)为3时的乳糖质量浓度作为检出限。
(3) 精密度和重复性:精密度考察按照1.3.1所述前处理方法制备1份供试品溶液连续进样测定6次,然后依据1.3.3色谱条件进样检测;重复性考察按照1.3.1所述前处理方法制备6份供试品溶液分别进样测定,然后依据1.3.3色谱条件进样检测;记录峰面积并按式(1)计算乳糖含量。
(4) 加标回收率试验:精确称取生牛乳5.000 g再加入不同水平(15,40,80 mg/g)的乳糖标准品后,按照1.3.1优化方法制备待测样品并用1.3.3色谱条件进样检测,记录峰面积并按式(1)计算乳糖含量再计算乳糖回收率。
1.4 氨基柱法测定乳糖
1.4.1 样品溶液和乳糖标准品溶液的制备 参考GB 5009.8—2016第一法。
1.4.2 液相色谱条件 参考GB 5009.8—2016第一法。
1.5 市售液态乳的乳糖含量检测
采用GB 5009.8—2016第一法对试验所建立的方法进行验证,将购买的11种市售液态乳参照1.3.1所述前处理方法提取乳糖并用1.3.3所述液相色谱条件进行检测,记录峰面积并按式(1)计算乳糖含量;参照1.4.1所述前处理方法提取乳糖并用1.4.2所述液相色谱条件进行检测,记录峰面积并按式(2)计算乳糖含量。
(2)
式中:
X2——试样中乳糖的含量,mg/g;
C2——样液中乳糖质量浓度,mg/mL;
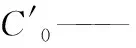
V2——试样定容体积,mL;
n2——样液稀释倍数;
m2——试样质量,g。
1.6 数据分析
通过SPSS Statistics 24.0对数据进行显著性分析,其结果表示为“平均值±标准差”,输出数据由Origin 2018软件绘图。
2 结果与分析
2.1 钙型糖柱法条件优化
2.1.1 样品提取优化 采用三氯乙酸溶液对样品进行前处理使蛋白质沉淀,该试剂是常用的蛋白质沉淀剂,沉淀效果好、准确度高[16]。由表1可知,TCA质量浓度不同时,所得乳糖含量无显著性差异(P>0.05),相对标准偏差(relative standard deviations,RSDs)为1.48%~2.17%。TCA具有较强腐蚀性,需同时考虑样品提取操作的安全性,因此选取最低质量浓度0.2 g/mL进行提取。

表1 不同浓度TCA处理后乳糖含量
2.1.2 流动相流速优化 钙型糖柱的典型流动相为纯水,以纯水作为流动相时色谱图基线平滑噪音小。然而流动相流速的变化会影响保留时间、柱压、分离度和基线稳定性[17],流速过大会导致色谱图拖尾和基线不稳[18]。图1中,流速为1.0 mL/min时乳糖保留时间为5.008 min,流速为0.9 mL/min时保留时间为5.513 min,可见流速增大保留时间前移。但流速1.0 mL/min时,色谱柱的压力会过高,不宜进行大量的样品分析,同时会影响色谱柱寿命。因此,0.9 mL/min为最适宜流速。

图1 不同流速下乳糖标准品图谱
2.2 方法学验证
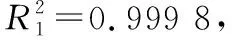
2.2.2 重复性和精密度 重复性试验中所得乳糖含量分别为35.30,37.34,35.67,36.74,37.22,37.71 mg/g,其平均值为(36.66±0.97) mg/g,RSDs为2.65%,表明该方法重复性较好。精密度试验中所得乳糖含量为35.77,36.41,36.83,36.60,36.73,34.53 mg/g,其平均值为(36.16±0.89) mg/g,RSDs为2.45%。表明在该色谱条件下,高效液相色谱仪精密度良好。
2.2.3 乳糖加标回收率 表2中,牛乳样品在3个不同加标水平下(15,40,80 mg/g)的乳糖回收率为90.96%~98.23%,结果表明,方法具有很高的准确度,适用于实际样品的测定。
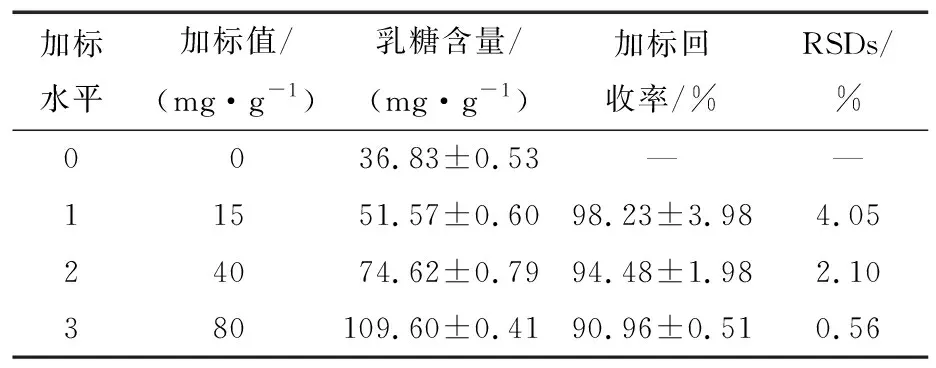
表2 乳糖加标回收率结果
2.3 钙型糖柱法和氨基柱法的比较
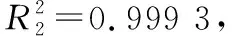

表3 钙型糖柱和氨基柱对乳糖的线性范围、检出限及定量限对比
2.3.2 检测耗时对比 图2(a)中,氨基柱法检测的乳糖标准品保留时间为12.577 min并且在3.0 min出现未知杂峰,牛乳样品中乳糖保留时间为12.502 min。图2(b)中,钙型糖柱法检测的乳糖标准品的保留时间为5.515 min,牛乳中的乳糖保留时间为5.420 min。并且在乳糖的保留时间内,其他组分未出现杂质峰干扰,表明方法的专属性较好。图2(a)中基线噪音较大,可能是由于漂移管的温度变化使乙腈没有完全蒸发[19]。因此,钙型糖柱法与氨基柱法相比,极大缩短了检测时长,提高了检测效率,实现了乳糖含量的快速检测。
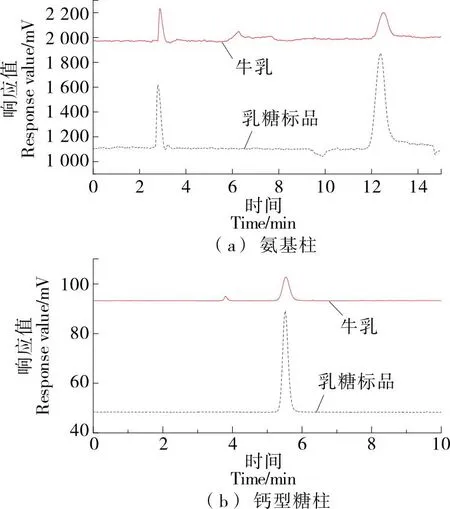
图2 牛乳样品及乳糖标准品的保留时间图谱
2.4 市售液态乳的检测结果对比
2.4.1 乳糖含量分析 由表4可知,氨基柱法的检测结果为33.93~50.72 mg/g,钙型糖柱法的检测结果为33.86~49.55 mg/g。为更好地比较两种方法所测乳糖含量的差异,对表4数据进行独立样本t检验。结果表明,两种方法所测11种市售液态乳的乳糖含量之间均无显著性差异(P>0.05)。6号样品(鲜牛乳)乳糖含量最高,两种方法所得结果一致。
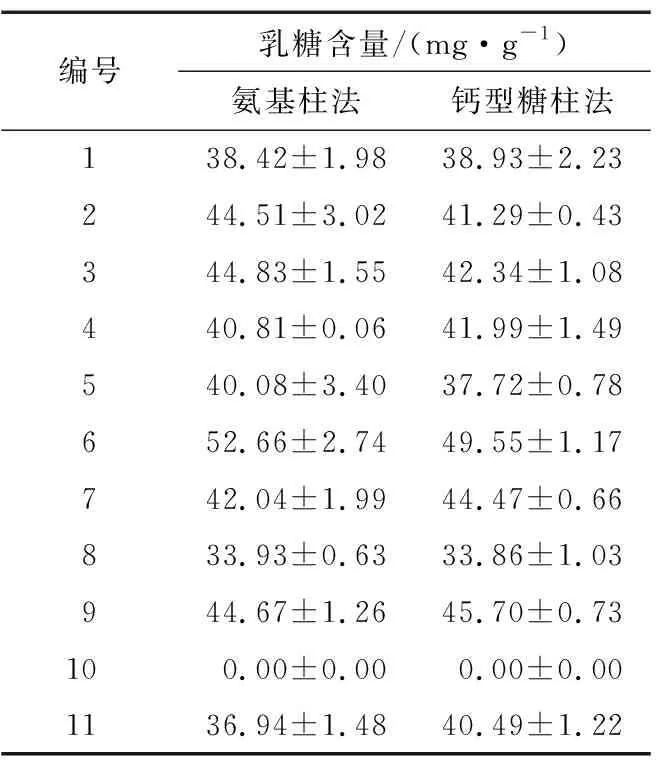
表4 11种市售液态乳的乳糖含量检测结果
2.4.2 色谱图分析 图3(a)中,所有样品的色谱图峰形对称无拖尾,基线平稳噪音小,无杂峰干扰,保留时间一致。10号样品在5.5 min时未出现色谱峰,表明该样品中无乳糖,随后相继出现两个色谱峰,经标准品验证分别是葡萄糖(6.518 min)和半乳糖(7.217 min),葡萄糖、半乳糖之间分离效果良好。图3(b)中,10号样品中未检测出乳糖和半乳糖,7.8 min的色谱峰为葡萄糖。图3(b)中8号样品在10.0 min的色谱峰为蔗糖。钙型糖柱法乳糖的保留时间在5.5 min处呈现高度的一致性(RSDs为0.06%)而国标方法中保留时间在12.5 min处偏移程度相对较大(RSDs为0.84%),可能是流动相中乙腈挥发使保留时间发生了漂移[20]。
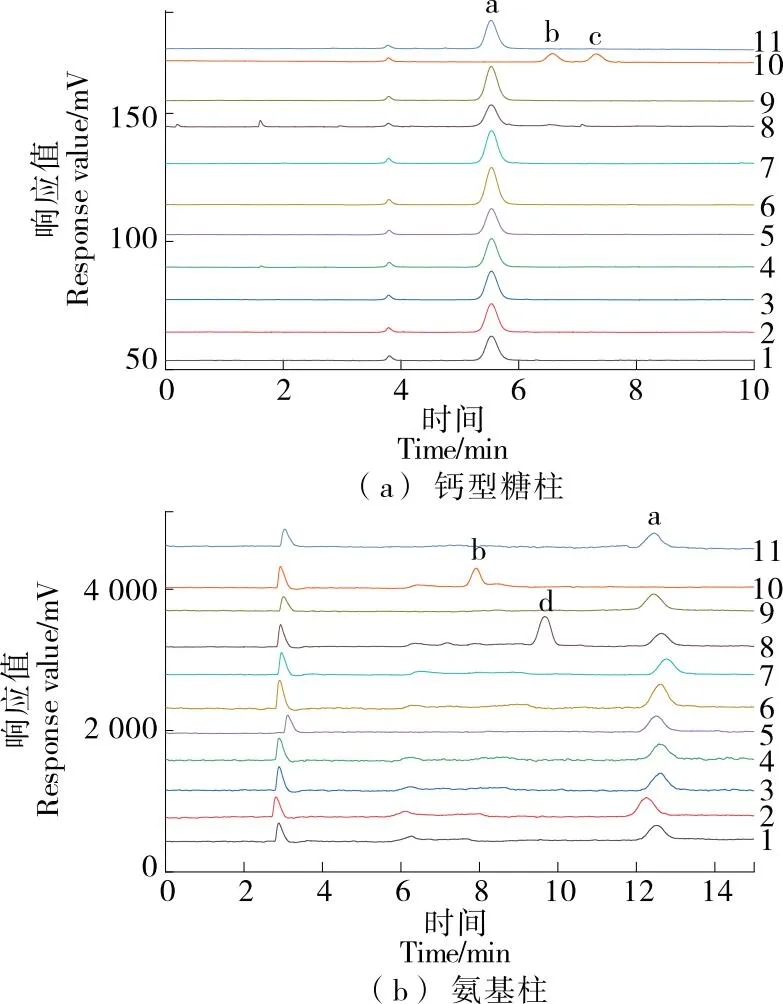
a. 乳糖 b. 葡萄糖 c. 半乳糖 d. 蔗糖
3 结论
研究建立了以0.2 g/mL三氯乙酸溶液进行蛋白质沉淀,钙型糖柱法测定牛乳中乳糖含量的方法。该方法前处理简单且6 min内可以实现乳糖含量检测,其选择性好、灵敏度较高、检出限低(3.6 μg/g)、回收率高、精密度和准确性良好、峰面积和乳糖含量之间存在良好线性关系,测定结果具有较高准确度且与国标(GB 5009.8—2016)测量结果基本一致。该方法能够满足牛乳中定量检测乳糖的需要并为产品质量控制方面提供技术支持,还可用于牛乳中葡萄糖、半乳糖的测定,具有可行性和适用性。
