热毒宁注射液联合亚胺培南西司他丁治疗重症肺炎的临床研究
2023-12-27王世刚纪放李萍林浩吴泽
王世刚,纪放,李萍,林浩,吴泽
1.南京市中西医结合医院 重症医学科,江苏 南京 210014
2.南京市浦口区中心医院 感染科,江苏 南京 211899
重症肺炎通常是由病毒、细菌等病原菌感染引起的呼吸系统危急重症,是导致人类死亡的主要感染性病变之一。重症肺炎通常是由一般肺炎发展而来,主要症状包括咳嗽、咯痰、高热、呼吸困难等,严重者可导致多器官功能障碍[1]。临床上治疗重症肺炎通常采用头孢类、阿奇霉素类、喹诺酮类、碳青酶烯类抗菌药物,并与β-内酰酶抑制剂联合使用,发挥协同抗菌作用[2]。亚胺培南西司他丁是复方抗菌药物,具有广谱抗菌效果,还能抑制β-内酰氨酶的活性,对多种病原菌感染具有良好的抗菌活性,临床广泛用于重症肺炎的治疗[3]。热毒宁注射液处方由青蒿、金银花、栀子组成,可清热、疏风、解毒,用于外感风热所致感冒、咳嗽,症见高热、微恶风寒、头痛身痛、咳嗽、痰黄,临床上用于重症肺炎的治疗[4]。本研究选择在南京市中西医结合医院就诊的94 例重症肺炎患者作为研究对象,使用热毒宁注射液与注射用亚胺培南西司他丁钠联合治疗,分析其临床治疗效果。
1 资料与方法
1.1 一般资料
选择2020 年7 月—2023 年2 月在南京市中西医结合医院就诊的94 例重症肺炎患者作为研究对象。其中男58 例,女36 例;年龄41~69 岁,平均年龄(53.12±5.55)岁;病程4~37 h,平均病程(20.43±5.81)h。
纳入标准:(1)经主治医师确诊为重症肺炎,符合重症肺炎的标准[5];(2)生命体征基本稳定;(3)患者阅读知悉本研究的相关内容,并签订知情同意书。
排除标准:(1)既往重症肺炎患者;(2)心、肝、肾等主要器官严重病变;(3)肺结核、肺肿瘤、肺不张等病变;(4)明确对热毒宁注射液、注射用亚胺培南西司他丁钠过敏;(5)精神异常;(6)自身免疫系统、内分泌系统病变。
1.2 药物
热毒宁注射液,规格10 mL/支,由江苏康缘药业股份有限公司生产,产品批号 20200601、20210416、20220308。注射用亚胺培南西司他丁钠,规格1.0 g/支,韩国江泰株式会社生产,产品批号20030、21040、22010。
1.3 分组与治疗方法
参考随机数字表法将94 例患者分为对照组(n=47)和治疗组(n=47)。对照组男28 例,女19例;年龄42~67 岁,平均(53.04±5.42)岁;病程5~36 h,平均(20.35±5.72)h。治疗组中男30 例,女17 例;年龄41~69 岁,平均(53.20±5.68)岁;病程4~37 h,平均(20.61±5.90)h。两组的资料无明显差异,存在可比性。
对照组静脉滴注注射用亚胺培南西司他丁钠,1.0 g 加入100 mL 生理盐水中,1 次/12 h。治疗组在对照组治疗的基础上静脉滴注热毒宁注射液,20 mL 热毒宁注射液加入250 mL 葡萄糖溶液中,滴速30~60 滴/min,1 次/d。两组连续治疗10 d。
1.4 临床疗效评价标准[6]
治愈:无机械通气、意识清晰,肾功能正常,症状、肺啰音均完全消退,肺功能正常,肺阴影吸收;好转:症状显著减轻,肺功能好转,血压正常,肺阴影部分吸收;无效:未达到以上标准。
总有效率=(治愈例数+好转例数)/总例数
1.5 观察指标
1.5.1 病情严重程度 采用序贯性脏器功能衰竭(SOFA)评估患者的病情严重程度。SOFA 评分包括心血管、呼吸、肝脏、肾脏、凝血、神经6 个条目,各条目分值0~4 分,SOFA 评分分值越小则功能越轻[7]。
1.5.2 症状消失时间 观察和记录患者高热、咳嗽、喘息、肺啰音消失时间。
1.5.3 肺通气功能 在治疗前后,使用瑞迈特G2 SB20A 型全自动呼吸机评估患者的肺通气功能,记录气道阻力、吸气峰压、平均气道压。
1.5.4 血清指标 患者在治疗前后于血液检验科采集外周血,在赛默飞Multiska FC 型酶标仪上采用酶联免疫法测定血清高迁移率族蛋白 B1(HMGB1)、白细胞介素-18(IL-18)、可溶性髓系细胞触发受体-1(sTREM-1)水平,试剂盒均购自上海科培瑞生物公司。
1.6 不良反应观察
记录患者出现血栓静脉炎、肝肾损伤、头晕、肌痉挛、胃肠道反应等不良反应的情况。
1.7 统计学处理
计数资料比较使用χ2检验,计量资料比较使用t检验,所有试验数据由SPSS 25.0 处理。
2 结果
2.1 两组临床疗效比较
治疗后,治疗组总有效率与对照组总有效率组间比较差异显著(P<0.05),见表1。
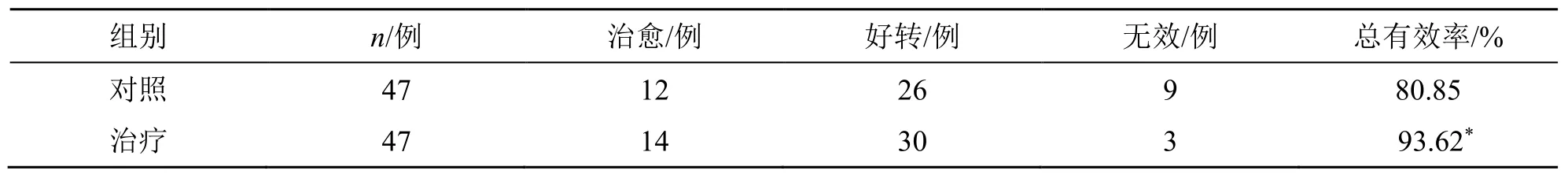
表1 两组总有效率比较Table 1 Comparison on total effective rates between two groups
2.2 两组病情严重程度比较
治疗后,两组的SOFA 评分显著减少(P<0.05),治疗组的SOFA 评分小于对照组(P<0.05),见表2。
表2 两组SOFA 评分比较()Table 2 Comparison on SOFA scores between two groups ()

表2 两组SOFA 评分比较()Table 2 Comparison on SOFA scores between two groups ()
与同组治疗前相比较:*P<0.05;与对照组治疗后相比较:▲P<0.05*P<0.05 compared with the same group before treatment;▲P<0.05 compared with the control group after treatment
2.3 两组症状消失时间比较
治疗后,治疗组高热、咳嗽、喘息、肺啰音消失时间明显短于对照组(P<0.05),见表3。
表3 两组高热、咳嗽、喘息、肺啰音消失时间比较()Table 2 Comparison on disappearance time of high fever,cough,and wheezing and pulmonary rales between two groups()
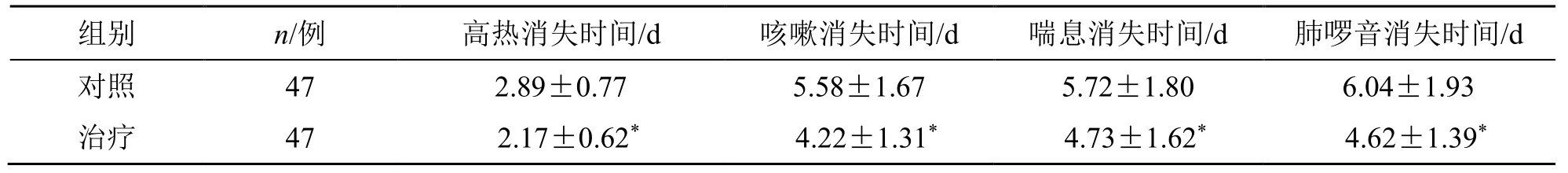
表3 两组高热、咳嗽、喘息、肺啰音消失时间比较()Table 2 Comparison on disappearance time of high fever,cough,and wheezing and pulmonary rales between two groups()
与对照组相比较:*P<0.05*P<0.05 compared with control group
2.4 两组的肺通气功能比较
治疗后,两组的气道阻力、吸气峰压、平均气道压显著降低(P<0.05),治疗组气道阻力、吸气峰压、平均气道压明显低于对照组(P<0.05),见表4。
表4 两组气道阻力、吸气峰压、平均气道压比较()Table 4 Comparison on airway resistance,peak inspiratory pressure and average airway pressure between two groups ()

表4 两组气道阻力、吸气峰压、平均气道压比较()Table 4 Comparison on airway resistance,peak inspiratory pressure and average airway pressure between two groups ()
与同组治疗前相比较:*P<0.05;与对照组治疗后相比较:▲P<0.05(1 cmH2O=98 Pa)*P<0.05 compared with the same group before treatment;▲P<0.05 compared with the control group after treatment (1 cmH2O=98 Pa)
2.5 两组血清指标比较
治疗后,两组患者的血清HMGB1、IL-18、sTREM-1 水平均显著降低(P<0.05),治疗组的血清HMGB1、IL-18、sTREM-1 水平明显低于对照组(P<0.05),见表5。
表5 两组血清HMGB1、IL-18、sTREM-1 水平比较()Table 5 Comparison on serum levels of HMGB1,IL-18,and sTREM-1 between two groups ()

表5 两组血清HMGB1、IL-18、sTREM-1 水平比较()Table 5 Comparison on serum levels of HMGB1,IL-18,and sTREM-1 between two groups ()
与同组治疗前相比较:*P<0.05;与对照组治疗后相比较:▲P<0.05*P<0.05 compared with the same group before treatment;▲P<0.05 compared with the control group after treatment
2.6 两组不良反应比较
治疗期间两组患者的不良反应无明显差异,见表6。

表6 两组不良反应比较Table 6 Comparison on the incidence of adverse drug reactions between two groups
3 讨论
重症肺炎是由一般肺炎恶化发展而来的急危重症,具有发病急、进展迅速、并发症多等特点,可造成多器官功能衰竭、意识障碍、甚至休克,严重者危及患者生命[8]。该病发病人群以老年、儿童为主。随着年龄的增大,老年患者机体功能减退,身体抵抗力显著下降,显著增加发生感染性疾病的临床风险[9]。
亚胺培南西司他丁是新型β-内酰胺类抗生素,具有头孢菌素对革兰阳性菌、阴性菌的强效抗菌效果,且对β-内酰氨酶具有高度稳定性,对多种病原菌具有强效抗菌作用,还能避免亚胺培南被水解,显著提高了抗菌效果[10]。中医认为重症肺炎的主要病机为素体虚弱,肺卫不固,火热毒邪蕴结于肺,导致肺络痹阻,形成此症[11]。热毒宁注射液能疏风、清热、解毒、泻火、凉血,符合该病的病机[12]。本研究结果显示,治疗组患者的总有效率明显高于对照组,并且高热、咳嗽、喘息、肺啰音消失时间明显短于对照组,提示热毒宁注射液联合亚胺培南西司他丁有助于提高重症肺炎患者的临床疗效,进一步减轻临床症状。
SOFA 是反映重症肺炎器官功能障碍的重要指标,能从呼吸、肾脏、肝脏、凝血、心血管等方面反映患者病情严重程度,与患者预后密切相关[13]。本研究结果显示,治疗后治疗组的SOFA 评分、气道阻力、吸气峰压、平均气道压低于对照组。结果提示,热毒宁注射液联合亚胺培南西司他丁有助于降低重症肺炎患者的病情严重程度,能显著改善患者的肺通气功能。有助于促进病情的恢复。
sTREM-1 是新型炎症标志物,在重症肺炎患者血清中呈高表达,与病情的严重程度呈正相关[14]。HMGB1 具有较高的迁移能力,肺组织在受到病原菌感染后,淋巴细胞释放HMGB1,进而诱发局部或全身炎症反应[15]。IL-18 是一种中性粒趋化因子,能促使中性粒细胞向炎症部位聚集,诱发炎症级联反应、组织炎症损伤[16]。本研究结果显示,治疗后治疗组的血清HMGB1、IL-18、sTREM-1 水平低于对照组。结果表明,热毒宁注射液联合亚胺培南西司他丁可显著降低重症肺炎患者的炎症反应,进而减轻肺组织损伤。
可见热毒宁注射液联合注射用亚胺培南西司他丁钠可显著提高重症肺炎的临床疗效,缓解患者的临床症状和病情严重程度,改善肺通气功能,显著减轻炎症反应。
利益冲突所有作者均声明不存在利益冲突
