芩百清肺浓缩丸对肺炎支原体CARDs TX 的抑制作用及机制研究
2023-12-27蒙艳丽孙一雷敏瑞姜焱王萍王晓溪王欣王伟明
蒙艳丽,孙一,雷敏瑞,姜焱,王萍,王晓溪,王欣,王伟明
黑龙江省中医药科学院,黑龙江 哈尔滨 150036
肺炎是影响全球儿童健康的一个公众问题,随着肺炎相关疫苗的应用,肺炎的常见病原谱正在发生变化,肺炎支原体(MP)已成为社区获得性肺炎的最常见病原之一,占社区获得性肺炎的10%~40%,在部分封闭人群中可高达70%。近年来,我国北方地区MP 感染的发病率在不断增加,每2~3 年有1 次流行,流行季节多在秋冬季[1]。
社区获得性呼吸窘迫综合征毒素(CARDs TX)蛋白被认为是目前为止肺炎支原体体内单一的毒力因子[2],是由肺炎支原体MPN372 基因编码的蛋白,在肺炎支原体的致病过程中起到了至关重要的作用[3]。CARDs TX 能够引起多种炎症因子释放,导致相关组织病理的改变[4]。此外,CARDs TX 作为一种可溶性的炎症触发因子,在MP 感染控制稳定一段时间后仍具有激发气道神经源性炎症的功能[5],如缓激肽及其缓激肽受体,可引发患者剧烈咳嗽。目前的临床用药常选用阿奇霉素等大环内酯类抗生素,由于临床不规范化及反复使用,导致肺炎支原体耐药性剧增,中国尤为突出,耐药率接近90%[6-7],使其临床应用受到限制。无痰而剧烈的干咳往往需镇咳药缓解症状,但镇咳药主要为中枢性镇咳药(可待因、吗啡、右美沙芬等)、周围性镇咳药(那可丁、苯丙哌林)等,属特殊药品,有成瘾性或较大不良反应,儿童不宜服用[8]。因此,开发既能杀灭肺炎支原体又能治疗其感染引起干咳的药物是临床的迫切需求。
芩百清肺浓缩丸是国家批准的第1 个用于小儿肺炎支原体肺炎治疗的中药,已完成Ⅲ期临床,前期作为医院制剂用于临床10 余年,疗效确切,患儿咳痰喘等症状能够快速缓解,避免了抗生素不良反应及耐药性,是黑龙江省呼吸科应用量最大的医院制剂。本研究通过验证芩百清肺浓缩丸对CARDs TX、缓激肽受体B2(BDKRB2)表达的影响,探讨芩百清肺浓缩丸减缓患者咳嗽治疗肺炎支原体肺炎的作用机制,为芩百清肺浓缩丸的临床使用提供理论依据。
1 材料与仪器
1.1 菌株与质粒
肺炎支原体菌株(批号ATCC15531)购自美国Type Culture Collection 公司,大肠杆菌表达菌株BL21(DE3)、pET28α 质粒由本实验室保存。
1.2 主要药品和试剂
LB 培养基购自青岛高科技工业园海博生物技术有限公司;卡那霉素(批号2021/12)购自索莱宝公司;还原型谷胱甘肽(批号2021/12)、氧化型谷胱甘肽(批号2021/12)、异丙基-β-D硫代半乳糖苷(IPTG)(批号410H052)、溶菌酶(批号2020/12)购自北京博奥拓达科技有限公司;胎牛血清(批号11011-8611)购自浙江天杭生物科技股份有限公司;RT-PCR 试剂盒(批号15322、17122)购自江苏康为世纪生物科技有限公司。
芩百清肺浓缩丸(规格 6 g,批号 CXZS 1000045)购自天合力药业有限公司;阿奇霉素分散片(规格0.25 g,批号274150404)购自石药集团欧意药业有限公司。
1.3 主要仪器
MDF-382E-80 ℃低温冰箱(日本三洋公司);多功能酶标仪(瑞士TECAN 公司);DP73 显微镜成像系统(日本奥林巴斯公司);BP211D 型电子天平(Sartorius 公司);GT16-3 型离心机(北京时代北利离心机有限公司);超声波细胞粉碎机(宁波新芝生物科技有限公司)。
1.4 实验动物
清洁级雄性BALB/c 小鼠,日龄4~6 周,体质量18~22 g,56 只,购自哈尔滨医科大学,实验动物生产许可证号SCXK(黑)2019-001,实验单位使用许可证号SYXK(黑)2019-007,动物实验伦理批准单位为黑龙江省中医药科学院实验动物伦理委员会,动物实验伦理批号SY3R-2021021。
2 方法
2.1 CARDs TX 蛋白的获取与纯化
2.1.1 CARDs TX 表达质粒的构建 从NCBI 上获取MPN372 基因序列,按照大肠杆菌密码子偏好进行序列优化,合成目的片段,链接于pET28α 质粒,得到pET28α-CARDs TX 重组质粒。
2.1.2 pET28α-CARDs TX 重组质粒的表达 将pET28α-CARDs TX 重组质粒转化大肠杆菌BL21,涂布于含卡那霉素的LB 固体培养基37 ℃培养过夜。随机挑取饱满的单克隆菌落接种于含1 μg/mL卡那霉素的LB 液体培养基,37 ℃、220 r/min 至600 nm 处吸光度(A600)值为0.4~0.6 时,加入终浓度0.25 mmol/L 的IPTG 诱导6 h 收菌。
2.1.3 CARDs TX 蛋白的纯化 收集诱导表达后的菌液,4 ℃、7 000 r/min、10 min 离心收集沉淀;按照湿质量每100 毫克加2 mL 的量,加入含有10 mmol/L 咪唑的PBS 溶液,按照1 mg/mL 的量加入溶菌酶,于冰上放置30 min 后,进行超声破碎;破碎后进行离心,分离上清与含有包涵体的沉淀;使用复性液洗涤包涵体3~5 次后离心,弃上清取沉淀,加入3 mL 变性液变性12 h 后,再次离心并取上清;缓慢加入10 倍体积复性液,于4 ℃冰箱复性24 h 之后,离心取上清;将液体转移置透析袋中,将装满溶液的透析袋置于含大体积PBS 的烧杯中透析24 h;透析后离心去除沉淀,取上清加入超滤离心管中浓缩,收样用于后续实验。
2.2 Biacore 实验
2.2.1 CARDs TX 蛋白的预富集试验 将CARDS TX 蛋白溶液用pH 值为4.0、4.5、5.0 的醋酸钠溶液充分溶解,用蛋白与氨基直接偶联的方法将CARDs TX 固定在CM5 芯片表面(将1 通道视为参比通道,2 通道作为样本的偶联通道)。
2.2.2 CARDs TX 蛋白的配体偶联试验 使用EDC、NHS 活化芯片。依据2.2.1 项下结果配制CARDs TX 蛋白溶液(pH 值4.0 醋酸盐缓冲溶液)用于与芯片偶联。
2.2.3 芩百清肺浓缩丸进样及结合能力检测 使芩百清肺浓缩丸溶液流经CM5 芯片表面。pH 为2.5甘氨酸–盐酸溶液作为再生试剂流经CM5 芯片表面。观察芩百清肺浓缩丸溶液与CARDs TX 蛋白结合的响应曲线变化情况。
2.3 动物实验
2.3.1 肺炎支原体肺炎模型的建立 小鼠自适应饲养7 d 后,56 只BALB/c 小鼠被随机分为对照组(9 只)与模型组(47 只)。将除对照组外的小鼠用乙醚麻醉后,每只从鼻滴入20 μL 1×106CCU 肺炎支原体,每天1 次,共3 d[9]。剔除实验过程中死亡的小鼠剩余45 只(造模成功率为96%),将造模成功的小鼠平均分为模型组、阿奇霉素组、以及芩百清肺浓缩丸(4.6、2.3、1.15 g/kg)组,每组9 只。给药剂量均按照药品说明书上的人用剂量换算为小鼠剂量ig 给药。阿奇霉素组ig 0.03 g/kg 阿奇霉素,芩百清肺浓缩丸(4.6、2.3、1.15 g/kg)组分别ig 4.6、2.3、1.15 g/kg 芩百清肺浓缩丸。对照组与模型组小鼠给予等体积生理盐水。每天1 次,连续给药7 d。末次给药24 h 后,眼球取血,摘除小鼠肺组织,一半用甲醛固定,另一半冻存备用。
2.3.2 引咳实验 小鼠末次给药后被置于内有氨水浸润棉球的倒扣的密闭容器中,用秒表计时。将小鼠从被放入密闭容器开始到第1 次出现咳嗽的时间称为咳嗽潜伏期,记录小鼠从第1 次咳嗽开始的2 min 内的咳嗽总次数。
2.3.3 小鼠肺组织病理学检测 取各组小鼠肺组织,用4%甲醛固定,用于病理学检测,显微镜下观察各组肺组织苏木素–伊红(HE)染色、Masson 染色的肺组织变化情况。
2.3.4 免疫组化方法检测各组肺组织BDKRB2 的表达 取各组小鼠肺组织,进行石蜡包埋并切片制片。将片子脱蜡后冲洗,进行抗原修复处理,孵育一抗、二抗,最后终止反应。在电子显微镜下观察各组组织BDKRB2 的染色情况,每张切片分别在不同的位置选取3 个视野,以着色深浅程度及面积进行评分,浅色为弱阳性为1 分,棕黄色为中等阳性为2 分,褐色为强阳性为3 分;着色细胞面积数在25%以下为1 分,在25%~49%为2 分,在50%以上为3 分。最终以二者相乘的综合积分计量,若≤3 为阴性,若≥4 为阳性,若≥6 为强阳性[9]。
2.3.5 RT-PCR 法测定小鼠肺组织中MPN372、BDRKD2mRNA 表达水平 取各组小鼠肺组织,根据RNA 提取试剂盒提取各组小鼠肺组织总RNA,酶标仪检测各组RNA 浓度。依照One-step reverse transcription PCR kit 说明书检测MPN372、BDRKD2mRNA 的表达水平。其中各引物基因序列如下:
MPN372 正向:5’-CCGGATCCATGCCAAATC CTGTTAG-3’;反向:5’-CTCCTCGAGCTAAAAG CGATCAAA-3’。BDKRB2 正向:5’-CCGAAAGA AGTCTTGGGAGGT-3’;反向:5’-CTGGCGTTCC ACGGAGATG-3’
2.4 统计学方法
3 结果
3.1 CARDs TX 蛋白的获取与纯化
经目的蛋白获取与纯化过程中各步留样的SDS-PAGE 电泳可知,加入IPTG 诱导可明显提高转入重组质粒的大肠杆菌的目的蛋白表达量(图1B、C);破碎菌体并离心后,发现目的蛋白存在于沉淀中,表明目的蛋白为包涵体表达(图1D、E);变性后得到可溶性蛋白(图1F);复性离心后、透析后得到纯度较高的可溶性目的蛋白(图1G、H)。
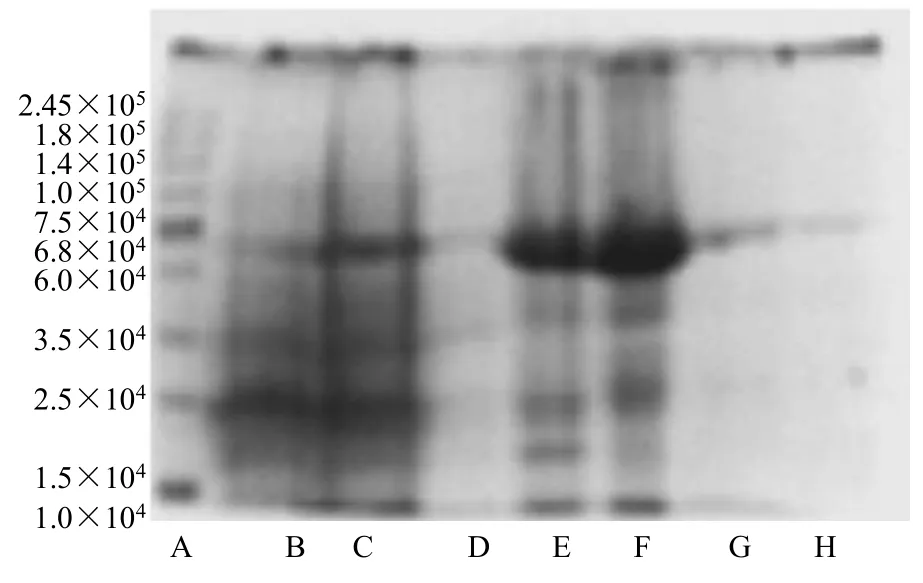
图1 重组质粒的表达及蛋白纯化Fig.1 Recombinant plasmid expression and protein purification
3.2 Biacore 验证芩百清肺浓缩丸与CARDs TX 结合结果
3.2.1 CARDs TX 预富集实验 将CARDs TX 蛋白分别用pH 值为4.0、4.5、5.0 的醋酸钠溶液中充分溶解,用蛋白与氨基直接偶联的方法将CARDs TX固定在CM5 芯片表面。图2 显示当醋酸钠溶液的pH 值为4.0 时(0~250 s),CARDs TX 的富集效果最佳。则pH 值4.0 醋酸钠溶液即为正式偶联时的实验条件。

图2 CARDs TX 蛋白预富集Fig.2 CARDs TX protein preenrichment
3.2.2 CARDs TX 蛋白与CM5 芯片的偶联 结果显示CARDs TX 蛋白与CM5 芯片的偶联值为953.5。
3.2.3 Biacore 验证芩百清肺浓缩丸与CARDs TX蛋白的结合结果 图3 为芩百清肺浓缩丸溶液与CARDs TX 蛋白结合的相应曲线。图中显示通道中CARDs TX 蛋白与芩百清肺浓缩丸溶液的结合曲线有上升趋势,且始终高于通道1。当结合状态稳定时,通道2-1 结合值为130.5 RU(RU>100 即有效结合)。因此芩白清肺浓缩丸在体外能与CARDs TX存在分子间结合作用,故CARDs TX 可能是芩百清肺浓缩丸治疗肺炎支原体肺炎作用的靶点。
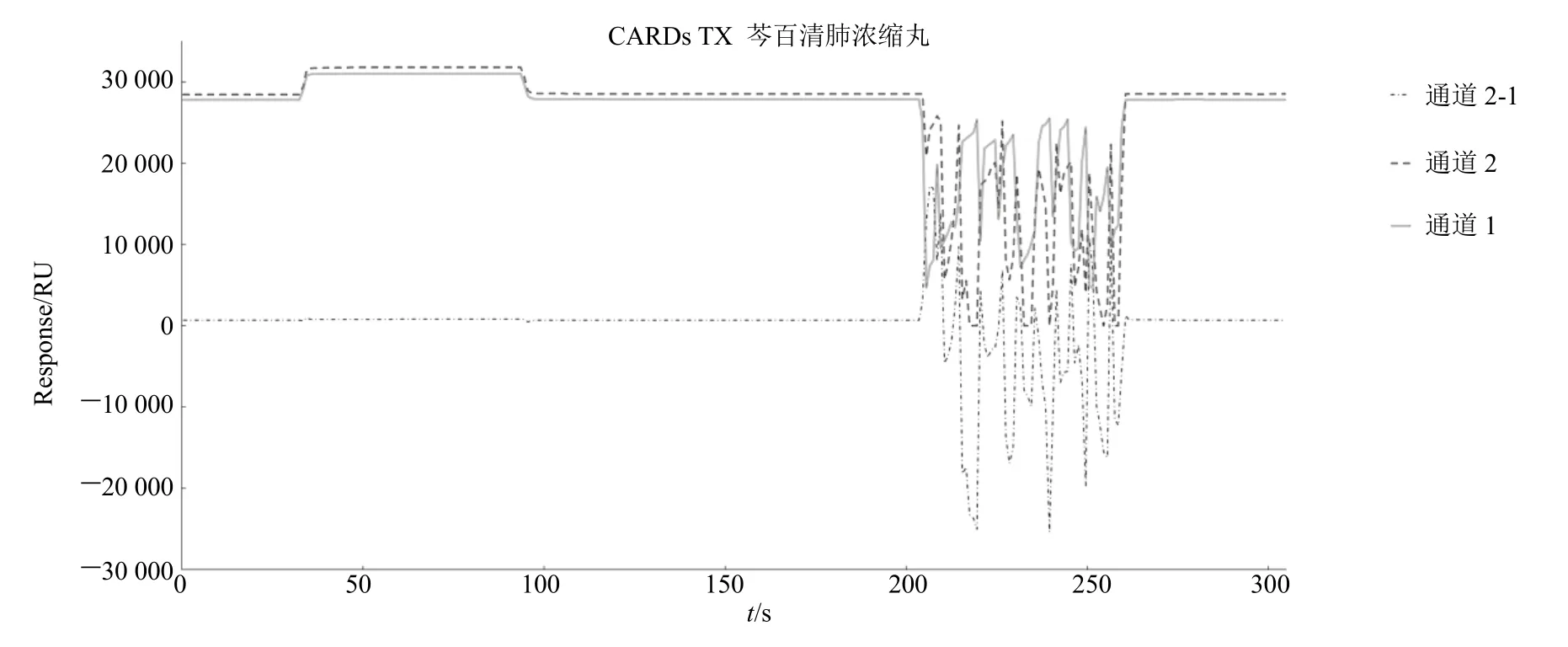
图3 Biacore 验证芩百清肺浓缩丸与CARDS TX 蛋白的结合Fig.3 Biacore verified the combination of Qinbai Qingfei Concentrated Pills and CARDs TX protein
3.3 动物实验结果
3.3.1 小鼠氨水引咳实验结果 如表1 所示,与模型组比较,芩百清肺浓缩丸各剂量组小鼠的咳嗽潜伏期显著延长(P<0.01);芩百清肺浓缩丸4.6、2.3 g/kg 组2 min 内咳嗽次数显著减少(P<0.05)。
表1 小鼠氨水引咳实验结果(,n=9)Table 1 Experimental results of cough induced by ammonia water in mice (,n=9)

表1 小鼠氨水引咳实验结果(,n=9)Table 1 Experimental results of cough induced by ammonia water in mice (,n=9)
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01**P<0.01 vs control group;#P<0.05 ##P<0.01 vs model group
3.3.2 芩百清肺浓缩丸对小鼠肺组织病理状态的影响 如图4 所示,对照组小鼠无感染现象,其肺组织结构完整。模型组小鼠肺组织明显有大量炎细胞浸润,肺泡壁充血严重,肺泡出现塌陷,支气管上皮大量脱落,还伴有黏膜水肿以及间隙变窄等情况。阿奇霉素组小鼠肺组织结构较模型组有所好转,炎细胞浸润程度降低。芩百清肺浓缩丸各剂量组小鼠肺组织结构的完整性、支气管肺组织的水肿情况、炎细胞浸润程度等都较模型组有显著改善。
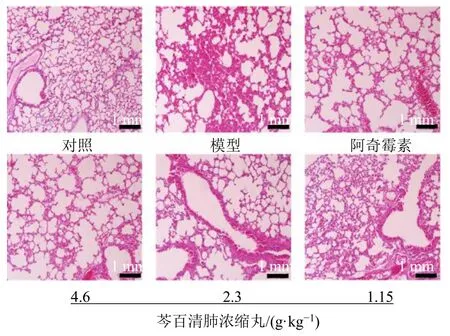
图4 各组小鼠肺组织HE 染色显微图(×200)Fig.4 HE staining micrograph of lung tissue in each group(×200)
3.3.3 芩百清肺浓缩丸对小鼠肺组织纤维化的影响 如图5 所示,对照组小鼠支气管壁胶原表现正常,肺泡有较少量胶原纤维;模型组小鼠肺实质、支气管有大量胶原纤维增生且肺纤维化呈弥漫性;阿奇霉素组、芩百清肺浓缩丸各剂量组小鼠肺泡间隔、支气管纤维化都得到缓解。
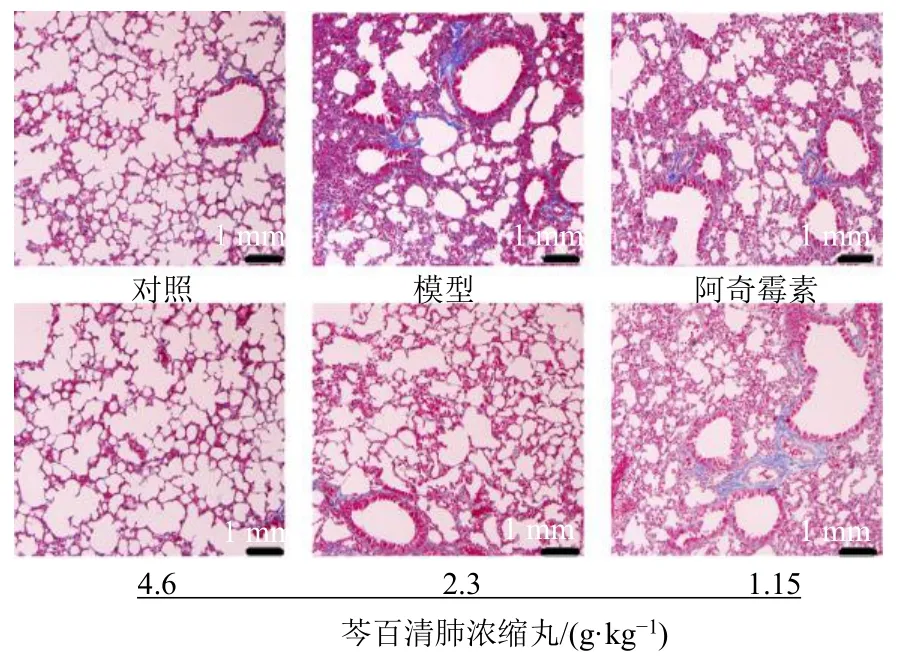
图5 各组小鼠肺组织Masson 染色显微图(×200)Fig.5 Masson staining micrograph of lung tissue of mice in each group (×200)
3.3.4 芩百清肺浓缩丸对小鼠肺组织BDKRB2 表达的影响 如图6、7 所示,与对照组比较,模型组小鼠肺组织中细胞着色程度以及着色面积数最高,BDKRB2 蛋白表达评分显著升高(P<0.01)。与模型组比较,阿奇霉素组、芩百清肺浓缩丸各剂量组BDKRB2 蛋白表达评分显著降低(P<0.05、0.01)。

图6 芩百清肺浓缩丸对小鼠肺组织BDKRB2 表达的影响(×200)Fig.6 Effect of Qinbaiqingfei Concentrated Pills on the expression of BDKRB2 in lung tissue of mice (×200)
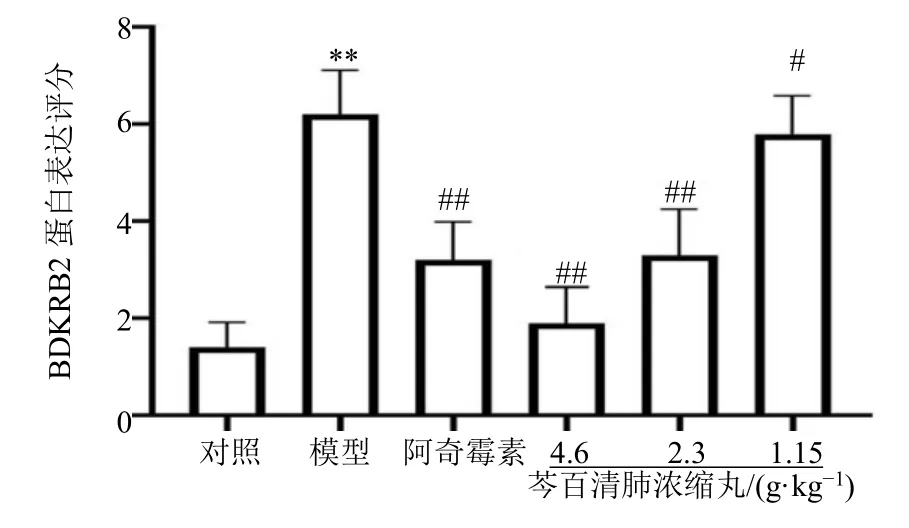
图7 芩百清肺浓缩丸对小鼠肺组织BDKRB2 表达的影响(IHC 评分)Fig.7 Effect of Qinbaiqingfei Concentrated Pills on the expression of BDKRB2 in mouse lung tissue (IHC score)
3.3.5 芩百清肺浓缩丸对小鼠肺组织MPN372、BDKRB2 mRNA 表达的影响
如表2 所示,与模型组比较,阿奇霉素组、芩百清肺浓缩丸各剂量组小鼠肺组织中MPN372、BDKRB2mRNA 表达显著降低(P<0.05、0.01)。
表2 芩百清肺浓缩丸对小鼠肺组织MPN372、BDKRB2 mRNA 表达的影响(,n=9)Table 2 Effects of Qinbaiqingfei Concentrated Pills on MPN372 and BDKRB2 mRNA expression in mouse lung tissue (,n=9)

表2 芩百清肺浓缩丸对小鼠肺组织MPN372、BDKRB2 mRNA 表达的影响(,n=9)Table 2 Effects of Qinbaiqingfei Concentrated Pills on MPN372 and BDKRB2 mRNA expression in mouse lung tissue (,n=9)
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01**P<0.01 vs control group;#P<0.05 ##P<0.01 vs model group
4 讨论
芩百清肺浓缩丸最早由黑龙江省中医药科学院研发,作为院内制剂在临床上治疗小儿肺炎支原体肺炎10 余年,疗效确切。前期研究证实芩百清肺浓缩丸有抑制纤维素沉积的作用[9],能促进肺组织修复[10-11]。
CARDs TX 毒素是由MPN372 基因编码的毒素蛋白,在肺炎支原体肺炎发病中发挥着重要作用,与表面活性蛋白A 结合,黏附气道表面,刺激气道神经源性炎症介质缓激肽及其BDKRB2 表达,BDKRB2 的激活会导致阵发性咳嗽,因此选择CARDs TX 与BDKRB2 为靶蛋白,研究芩百清肺浓缩丸治疗肺炎支原体肺炎缓解咳嗽症状的效果。
本研究通过前期所做的芩百清肺浓缩丸与CARDs TX 的Biacore 实验以及后续的体内动物实验,探讨芩百清肺浓缩丸干预后小鼠肺组织咳嗽相关蛋白与mRNA 表达水平的变化并得出结论。HE染色检测实验小鼠肺结构变化,结果表明,芩百清肺浓缩丸各剂量组小鼠肺组织结构的完整性、支气管肺组织的水肿情况、炎症细胞浸润程度等都较模型组有显著的改善。Masson 染色检测实验小鼠肺组织纤维化程度,结果显示模型组病变明显,肺组织中出现大量的胶原纤维增生,且肺纤维化呈弥散性;芩百清肺浓缩丸各剂量组小鼠肺泡间隔、支气管纤维化都得到缓解,胶原含量降低。免疫组化实验检测BDKRB2 在小鼠肺组织内蛋白量表达,结果表明与模型组比较,芩百清肺浓缩丸各剂量组BDKRB2 表达显著降低。
综上所述,芩百清肺浓缩丸可以抑制肺炎支原体CARDs TX 蛋白的作用,具有抑制MPN372、BDKRB2 的表达的作用,减缓患者咳嗽症状治疗肺炎支原体肺炎。
利益冲突所有作者均声明不存在利益冲突
