依达拉奉对脑梗死大鼠神经髓鞘再生、认知功能及VEGF/Notch1 信号通路的影响
2023-12-27林怀印孟肖赵智东
林怀印,孟肖,赵智东
1.衡水市第二人民医院,河北 衡水 053000
2.衡水市中医医院,河北 衡水 053000
脑梗死是指脑局部供血障碍导致的脑组织缺血、缺氧引起的脑组织坏死、软化,从而产生相应脑功能缺损症状的综合征[1]。多数患者是因为脑动脉粥样硬化、血管狭窄或闭塞所致,还可能是身体其它部位血栓脱落,阻塞脑血管所致。脑梗死又称缺血性脑卒中,主要因高血压、动脉瘤、动静脉畸形等原因引起脑血管破裂,形成脑血栓和脑栓塞。其病因包括血管壁病变,心脏病和血流动力学改变,血液成分和血液流变学改变以及脑血管痉挛,受压或外伤等,可引发高血压、心脏病、糖尿病及高血脂症等危险因素,降低认知功能,损伤血管内皮细胞受损,加重机体炎症反应,具有发病率高、死亡率高和致残率高的特点[2]。神经髓鞘是包裹在神经细胞轴突周围的一层膜,可以防止轴突之间的干扰,增加传导速度,对轴突修复有促进作用[3]。跨膜体受体蛋白(Notch1)信号通路维持神经元,平衡正常生长发育的神经胶质细胞,而血管内皮生长因子(VEGF)促进内皮细胞分裂及血管生长,二者参与中枢神经系统病变,通过调节脑部炎性因子,参与脑缺血缺氧的损伤过程。随着医疗技术的发展进步,对脑卒中的靶向药物研究逐渐丰富,依达拉奉是一种新型自由基清除剂,能捕获新生的高活性自由基,减轻脑缺血引起的脑水肿以及脑组织损伤,目前用于临床治疗脑梗死等颅脑损伤疾病[4]。临床缺乏采用依达拉奉治疗脑梗死髓鞘再生、认知功能及VEGF/Notch1 信号通路的定向研究,故本研究主要讨论不同浓度的依达拉奉,对脑卒中大鼠神经髓鞘再生、认知功能及VEGF/Notch1 信号通路的作用机制,为相关研究提供依据。
1 材料与方法
1.1 实验动物
50 只SPF 级SD 雄性大鼠,鼠龄4~6 周,体质量(220±20)g,由广西医科大学实验动物中心提供[动物许可证编号SYKG(桂)2018-0005],大鼠于本院实验动物中心饲养,温度(24±2)℃,湿度50%~80%,12 h 昼夜交替,正常饮食及摄水,该动物实验在河北医科大学动物实验室完成,按照《实验动物管理条例》规定进行实验。动物实验经河北医科大学实验动物伦理委员会批准(伦理批准号2016-0106)。
1.2 药物、主要试剂与仪器
依达拉奉注射液由昆明积大制药有限公司提供,批号2004L00488,规格:5 mL∶10 mg;阿司匹林肠溶片购于拜耳医药保健有限公司,批号BJ16177,规格:100 mg。
戊巴比妥钠(批号57330)购于BIOCAM 公司;苏木素–伊红(HE)染色液(批号20190472)购于湖南金盛徕生物科学有限公司;DAB 试剂盒(货号DA1010)购于北京索莱宝科技有限公司;二抗IgG(货号A21020-1)购于亚科因(武汉)生物技术有限公司;甘油醛-3-磷酸脱氢酶(GAPDH)(批号C1319-100)购于北京普利莱基因技术有限公司;;VEGF 一抗(货号K106558P)购于北京索莱宝科技有限公司Notch1 一抗(货号Sfk13818)购于上海士锋生物科技有限公司。
DYCZ-24DN 垂直电泳槽、DYCZ-40 电泳仪均购于中国北京六一仪器厂;TDZ4-WS 低速离心机购于上海卢湘仪离心机仪器有限公司;RT-6100 酶标分析仪购于Rayto 公司;BX53 光学显微镜购于上海通灏光电科技有限公司;UNION-A 免疫分析仪购于深圳市亚辉龙生物科技有限公司。
1.3 大鼠分组及动物模型建立
对参与实验的大鼠常规饲养,设立对照组、模型组、阿司匹林组和依达拉奉1.5、3 mg/kg 组,每组10 只。除对照组外,其余大鼠均建立大脑中动脉梗死模型[5]。用40 mg/kg 剂量2%戊巴比妥钠对大鼠进行ip 麻醉后,将大鼠固定于动物手术台消毒,确保术区的无菌状态,于颈部皮肤行正中纵向切口,暴露并钝性分离左侧颈总动脉,用动脉夹暂夹闭。颈外动脉远端结扎并切断,颈外动脉残端系丝线以阻止血液流出,而后松开夹闭颈总动脉的动脉夹。线栓由颈外动脉残端插入颈内动脉,插入距颈总动脉分叉约18 mm 处,遇阻力则停止插入。大鼠向对侧转弯、同侧眼裂减小和对侧肢体瘫痪,提示脑卒中大鼠模型复制成功。造模期间动物膝关节无破损症状,动物无死亡,实验数据完整无脱落。
1.4 给药方法[6]
建模成功后,将依达拉奉注射液用生理盐水稀释成0.5 mg/mL 浓度备用,依达拉奉1.5、3 mg/kg组大鼠分别尾iv 1.5、3 mg/kg 依达拉奉注射液,2次/d,连续7 d。阿司匹林组将阿司匹林以生理盐水配成10 mg/mL 混悬液,造模后第7 天注射4 mg/kg的阿司匹林溶液,给药1 次,其余大鼠尾iv 等量(约2 mL)的生理盐水。
1.5 穿梭箱联合水迷宫实验观察大鼠认知功能
在穿梭箱的顶部装置蜂鸣报警器,在底部在穿梭箱的铺一层电栅。用食物将大鼠引导至穿梭箱内部的任一侧10 s 后,打开蜂鸣报警,待警报铃声响5 s 后,经过穿梭箱底部的电栅给电刺激大鼠,大鼠逃到箱内另一侧时,蜂呜自动停止。观察大鼠蜂鸣期间主动逃避次数以及被电次数,1 次/d,10 个循环/次。
设置水深52 cm、水温25 ℃的水迷宫,安全岛高度低于液面,设置成50 cm。记录各组大鼠游到安全岛的时间,在第20 天时统计训练所用的时间结果,比较学习潜伏期及记忆潜伏期所用时间,时间越长表明认知功能损伤越重。
1.6 ELISA 法检测各组大鼠血清髓鞘碱性蛋白(MBP)含量
大鼠尾静脉采血1 mL,收集血清备用。待血液凝固离心5 min 后,取塑料EP 管,将凝固血液倒入管中封口,于-20 ℃冰箱保存。按照试剂盒说明书操作。
1.7 Pal-Weigert 染色观察大鼠神经髓鞘形态
麻醉大鼠,切开胸膛暴露心脏,从心尖插入灌注针至主动脉,灌注100 mL、4 ℃的4%多聚甲醛。然后对大鼠开颅取脑,参照大鼠脑立体定位图谱,切取大鼠内囊前囟尾侧大约2.5 mm 的脑组织,放入4 ℃的4%多聚甲醛进行固定,12 h 后将脑组织经蔗糖脱水,切片机切取厚冠状切片(厚30 mm),重铬酸钾水溶液预染3 d,0.5%的铬酸中放置1 h,蒸馏水再次漂洗后,放入染液(用10%苏木素醇10 mL+冰醋酸1 mL+蒸馏水100 mmL 混匀调配)6 h 进行染色,用4%的高锰酸钾水溶液分色30 s,看见清晰的灰白质后再放入0.01 mol/L 的PBS 中,再用脱色液(1%草酸+1%亚硫酸钾混匀调配)分色5 min 至白质清晰可见,用饱和碳酸锂1 mL+500 mL蒸馏水返蓝,正常神经髓鞘呈深蓝色,于0.01 mol/L PBS 中漂洗20 min 后,用2%伊红水溶液复染5 min,乙醇脱水3 min 后,光镜下观察Pal-Weigert 髓鞘染色。
1.8 2,3,5-氯化三苯基四氮唑(TTC)染色测定各组大鼠脑梗死体积
大鼠于给药后12 h 做深度麻醉,0.9%氯化钠注射液200 mL 心脏灌注后,断头取脑,-20 ℃快速冷冻15 min,由前向后每隔2 mm 冠状行脑组织切片,将脑片置于2% TTC 生理盐水溶液中(对照组织染成红色,模型组织苍白),37 ℃避光孵育30 min,期间每隔8 min 翻动1 次,显色完毕后10%福尔马林固定3~5 h,数码相机拍照。用Image-Pm Plus6.0图像分析系统计算脑梗死体积。
1.9 免疫印迹法检测各组大鼠VEGF/Notch1 水平
将组织样品剪切为细小碎片,加入裂解液,于12 000 r/min 离心10 min,留取上清液,收集蛋白,采用Bradford 法检测。每100 μL 的蛋白混合等体积5×上样缓冲液,100 浴箱中100 ℃加热5 min,待变性发生后,进行10% SDS-PAGE 凝胶电泳,通过转膜、封闭及洗膜后加一抗VEGF(1∶500)、Notch1(1∶500),4 ℃孵育过夜,过氧化物酶抗兔IgG 二抗(1∶2 500),2 h 封闭完成后加入洗涤液进行洗涤,10 min/次,重复3 次。用DAB 显色试剂盒在X 胶片感光、显影、定影完成后在暗室中完成显色。以GAPDH 蛋白为内参,IPP 6.0 软件检测蛋白电泳带灰度值与GAPDH 条带灰度值比值,比较对比值。
1.10 统计学分析
采用GraphPadPrism 软件进行分析,所有数据符合正态分布,采用表示,组间采用独立样本t检验,多组间采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组大鼠认知功能比较
与对照组比较,模型组主动逃避次数减少,被电次数、学习和记忆潜伏时间增加(P<0.05);与模型组比较,依达拉奉1.5、3 mg/kg 组主动逃避次数增加,被电次数、学习和记忆潜伏时间减少(P<0.05),且呈剂量相关性,见表1。
表1 各组大鼠认知功能比较(,n=10)Table 1 Comparison of cognitive function in each group (,n=10)

表1 各组大鼠认知功能比较(,n=10)Table 1 Comparison of cognitive function in each group (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与依达拉奉1.5 mg·kg-1 组比较:&P<0.05*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs edaravone 1.5 mg·kg-1 group
2.2 各组大鼠血清MBP 含量比较
与对照组比较,模型组血清MBP 含量显著升高(P<0.05);与模型组比较,依达拉奉1.5、3 mg/kg组血清MBP 含量均显著下降(P<0.05),且呈剂量相关性,见图1。

图1 各组大鼠血清MBP 水平比较(,n=10)Fig.1 Comparison of serum MBP levels in each group(,n=10)
2.3 各组大鼠神经髓鞘形态比较
对照组内囊神经纤维髓鞘染成深蓝色,且着色清晰,背景为极浅的淡黄色;模型组髓鞘崩解、破坏、脱失严重,髓鞘稀疏,部分区域有髓鞘断裂缺失,染色变浅;依达拉奉1.5、3 mg/kg 组及阿司匹林组内囊的髓鞘脱失明显减少,髓鞘分布较致密,染色较深,且以依达拉奉3 mg/kg 组尤其明显,见图2。

图2 各组大鼠神经髓鞘形态比较(×200)Fig.2 Comparison of nerve myelin morphology of rats in each group (×200)
2.4 各组大鼠脑梗死体积比较
与对照组比较,模型组梗死体积升高(P<0.05),与模型组比较,依达拉奉1.5、3 mg/kg 组梗死体积均显著下降(P<0.05),见表2、图3。

图3 各组大鼠脑梗死体积比较Fig.3 Comparison of cerebral infarction volume in each group
表2 各组大鼠脑梗死体积比较(,n=10)Table 2 Comparison of cerebral infarction volume of rats in each group (,n=10)

表2 各组大鼠脑梗死体积比较(,n=10)Table 2 Comparison of cerebral infarction volume of rats in each group (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与依达拉奉1.5 mg·kg-1组比较:&P<0.05*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs edaravone 1.5 mg·kg-1 group
2.5 各组大鼠VEGF/Notch1 水平比较
与对照组比较,模型组VEGF 水平下降,Notch1水平升高(P<0.05);与模型组比较,依达拉奉1.5、3 mg/kg 组VEGF 水平升高,Notch1 水平下降(P<0.05),见表3、图4。

图4 各组大鼠VEGF/Notch1 水平Fig.4 VEGF/Notch1 levels in each group
表3 各组大鼠VEGF/Notch1 水平比较(,n=10)Table 3 Comparison of VEGF/Notch1 levels in each group(,n=10)
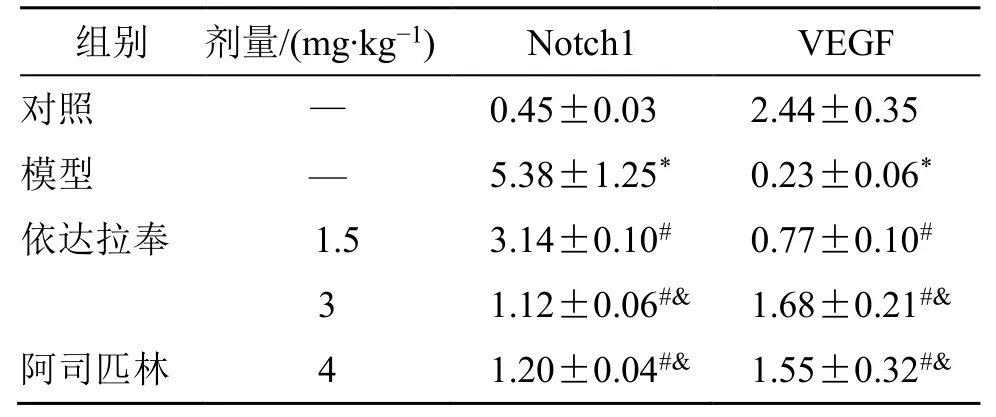
表3 各组大鼠VEGF/Notch1 水平比较(,n=10)Table 3 Comparison of VEGF/Notch1 levels in each group(,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与依达拉奉1.5 mg·kg-1组比较:&P<0.05*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs edaravone 1.5 mg·kg-1 group
3 讨论
我国属于脑梗死高发病率国家,有较高的致残率和致死率,对人类健康产生威胁,降低人类生活质量[7]。临床对脑梗死的治疗多从抑制神经元凋亡、清除自由基及降低神经炎症反应等进行溶栓,但因大部分患者去医院就诊的时效性影响,致使疗效不明显[8]。依达拉奉作为一种神经保护剂在脑梗死治疗中开始广泛,本研究发现依达拉奉调控Notch 信号通路促使血管新生,改善脑认知功能。
本研究结果显示,通过水迷宫联合穿梭箱实验,与模型组比较,依达拉奉干预后,大鼠主动逃避次数增加,被电次数、学习和记忆潜伏时间减少,说明依达拉奉治疗组大鼠的学习、记忆、行为能力提升,改善认知功能。当患者发生脑出血时,依达拉奉发挥清除氧自由基的生物活性,控制脂质过氧化的产生,对神经细胞及内皮细胞产生的氧化作用进行有效抑制,降低发生脑水肿发生几率,保护神经系统及神经元结构。有研究证实,当对机体静脉注射依达拉奉时,大部分药物都会通过血脑屏障发挥作用,降低钙离子、镁离子水平紊乱水平,恢复脑组织正常供血,抑制神经炎性反应,从多方面改善神经认知功能[9]。对血管性痴呆大鼠进行迷宫、穿梭箱实验研究发现,依达拉奉组大鼠电击次数明显减少,动逃避次数增加,说明依达拉奉组大鼠能改善血管性痴呆大鼠包括记忆、学习和行为方面的认知能力,发挥对大鼠的脑保护作用[10]。有研究表明,通过定位航行及空间探索的水迷宫实验,依达拉奉组大鼠逃避潜伏期明显缩短,在原平台象限内的游泳时间明显延长,穿环数明显增多,说明经依达拉奉干预后,可部分改善由于长期、反复的慢性痫性发作引起的认知功能减退,学习记忆能力下降情况,减少认知功能障碍[11]。
本研究结果显示,与模型组相比,依达拉奉各剂量组血清MBP 含量显著逐渐降低,对神经髓鞘Pal-Weigert 染色后发现,对照组内囊神经纤维髓鞘染成深蓝色,且着色清晰,模型组染色变浅,存在髓鞘稀疏有缺失情况,经药物干预后,髓鞘脱失缓解,染色加深,以依达拉奉3 mg/kg 组更为明显,说明经依达拉奉可调控MBP 蛋白含量,改善神经髓鞘形态。正常生理下的髓鞘结构紧凑,对有髓神经纤维起到高膜阻抗和低电容作用,有利于跳跃式神经冲动传导的正常发生。MBP 属于强碱性膜蛋白中的神经髓鞘所特有的、重要的脂蛋白,主要由少突胶质细胞分泌[12]。在正常情况下MBP 蛋白在血液中的含量非常少,脑卒中时,脑组织缺氧,少突胶质细胞开始凋亡,MBP 脱落于脑脊液并从血脑屏障漏到血液,使得血清MBP 蛋白水平异常升高。有研究显示,缺血性脑卒中的发生,会造成脑组织缺血损伤和出现过量氧自由基,髓鞘脱失,MBP 穿过血脑屏障于脑脊液中大量释放,升高血清MBP 水平,说明未经治疗的大鼠在脑缺血早期髓鞘和血脑屏障破坏严重[13]。依达拉奉具有捕获自由基的优势,调控机体内黄嘌呤氧化酶和次黄嘌呤氧化酶活性,对缺血再灌注损伤中产生自由基进行有效清除,抑制神经细胞过氧化,降低神经细胞的死亡率,减轻机体因脑缺血或脑缺血引起的脑水肿及神经细胞损伤。脑的缺血缺氧性损伤通过依达拉奉干预,使位于前脑室下区的神经干细胞激活,出现少突胶质祖细胞,再迁移到内囊区分化为成熟的少突胶质细胞,调控MBP 蛋白含量,促进髓鞘再生,减轻脑损害。相关研究表明,依达拉奉在脑梗死的治疗中,通过调节花生四烯酸代谢水平,实现抑制脑缺血所致的脑水肿及大脑皮质水肿的目的,清除自由基,降低MBP 含量,实现维持中枢神经系统髓鞘结构和功能的稳定[14]。研究发现,依达拉奉联合相关神经因子联合治疗脑出血,能有效清除氧自由基,降低MBP 蛋白水平,改善神经功能缺损[15]。
Notch 信号通路维持神经元和神经胶质细胞的正常生长发育,调节微血管形成,在γ-分泌酶作用下激活,裂解释放出Notch1 受体胞内活性片段(NICD),可不经其他信号转导分子的作用而直接进入细胞核,与转录因子或其他调节子结合,从而调节各种细胞活动。VEGF 是近年来发现的生长因子,具有促内皮细胞分裂的作用,正常情况下VEGF并不在脑内表达,多数血管新生处于静息状态,在梗死发生后,VEGF 开始大量合成分泌,促进内皮细胞的分裂和血管生长,建立起梗死后的侧支循环结构。本文研究结果显示,与模型组相比,依达拉奉组VEGF 升高,Notch1 水平下降,脑梗死体积减少,并有浓度有相关性,说明依达拉奉可通过下调Notch 信号通路,促进VEGF 活性,改善脑梗死体积。依达拉奉利用分子量小、脂溶性高的特点,可快速穿透血脑屏障进行氧自由基的清除,保护细胞膜免受损伤,对小胶质细胞的活化进行抑制,减少炎症介质释放,实现治疗缺血性脑损伤的作用,缩小脑梗死后半暗带范围,减少梗死体积,改善血管修复功能[16]。动物实验证实,依达拉奉对VEGF 的生物活性进行促进,通过分泌VEGF抑制神经炎症,修复血管功能,发挥脑保护作用[17]。相关研究表明,经依达拉奉干预后,慢性脑缺血大鼠VEGF 活性升高,抑制炎症反应,降低白细胞介素(IL-1β)、肿瘤坏死因子-α(TNF-α)水平,提高血管修复的功能,发挥脑保护作用[18]。研究显示,Notch 通路的激活会促进活化小胶质细胞,导致炎性介质浸润组织,损伤神经元,在脑缺血发生早期对Notch 通路进行抑制,可大大降低炎症损伤,有利于组织的修复[19]。有研究表明,依达拉奉干预后,通过抑制Notch 信号通路表达,影响小胶质细胞的激活,调控核因子-κB(NF-κB)介导,减少炎性因子的产生,进而引起Notch1 信号通路下游NICD 水平下调,减轻激活小胶质细胞介导的炎性反应,减轻神经损伤[20]。有研究发现,依达拉奉治疗缺血性脑损伤大鼠,其机制可能是通过抑制Notch 信号通路的表达,降低小胶质细胞的活化性,减少Notch1、NICD、转录因子(Hes-1)及小胶质细胞标记物离子钙接头蛋白(Iba1)水平,从而降低白细胞介素(IL-6)、IL-1β、TNF-α 水平,减少炎症因子释放,改善神经损伤[21]。
综上所述,依达拉奉可促进VEGF 活性,抑制炎症反应,调控Notch1 信号通路,影响小胶质细胞的激活,降低MBP 蛋白表达,促进神经髓鞘再生,提升认知功能。
利益冲突所有作者均声明不存在利益冲突
