液相色谱串联质谱法和电化学发光免疫分析法检测25-羟维生素D的一致性评价
2023-12-26任伟丹刘玉霞岳文兵韩雪莹丁利霞
赵 柯,任伟丹,刘玉霞,岳文兵,韩雪莹,丁利霞
郑州金域临床检验中心有限公司,河南郑州 450000
维生素D是一种脂溶性甾体激素前体,主要包括维生素D2(麦角钙化醇)、维生素D3(胆钙化醇),其主要功能为促进小肠黏膜细胞吸收磷及钙离子,还可减轻炎症反应,调控免疫系统功能及帮助控制血糖水平[1]。25-羟维生素D[25(OH)D]是维生素D在人体内的主要作用形式,其在血液中的浓度较高且半衰期较长,是监测体内维生素D水平及营养状况的可靠指标[2]。
随着临床实验室维生素D检测的大范围开展,不同检测方法间结果不一致的情况愈来愈多,甚至部分结果差异会影响临床对维生素D缺乏的诊断。故本研究使用液相色谱串联质谱法(LC-MS/MS)和电化学发光免疫分析法(ECLIA)这两种方法检测临床血清标本中的25(OH)D,并对测定结果进行分析和比较,评价这两种方法检测结果的相关性和差异性,以期指导临床选择合适的项目,合理解读这两种方法结果差异的原因。
1 材料与方法
1.1标本来源 收集本实验室临床血清标本94例,分别用ECLIA与LC-MS/MS两个检测系统检测25(OH)D浓度,并对结果相关性进行分析,入组的所有标本均为单纯随机抽样的方法挑选。
1.2仪器与试剂 LC-20ADXR 液相色谱仪(日本岛津公司)、API3200质谱仪(美国AB公司)、Milli-Q Gradient超纯水机、默克Ascentis Express C18(5.0 cm×2.1 mm×2.7 μm)色谱柱、电化学发光免疫分析仪(罗氏E602)。甲醇、乙腈、正己烷均为色谱纯,购自德国默克公司;甲酸(分析纯)购自广东光华化学厂有限公司;25(OH)D2和25(OH)D3标准品、色谱纯购自西格玛中国有限公司;d6-25(OH)D2和d6-25(OH)D3内标品购自美国Medical Isotopes公司;25(OH)D检测试剂盒购自罗氏诊断产品有限公司。
1.3方法 (1)25(OH)D检测采用ECLIA:使用电化学发光免疫分析仪和配套试剂盒,依据试剂盒说明书的标准操作流程进行标本的处理和检测。检查仪器清洗液、反应杯、缓冲液等是否足够使用,开机后在仪器试剂盘中加入平衡至室温的相应试剂(避免产生气泡),仪器将自动按照设定程序进行检测。LC-MS/MS,色谱条件:色谱柱柱温50 ℃;流速:0.55 mL/min;进样量为40 μL;流动相A相为含0.1%甲酸的去离子水,B相为含0.1%甲酸的甲醇,采用梯度洗脱模式。质谱参数:采用正离子电喷雾电离离子化的多反应监测模式,25(OH)D2和25(OH)D3定量离子通道质荷比分别为413.3∶395.4和401.3∶383.4;定性离子通道质荷比分别为413.3∶355.4和401.3∶365.4;内标离子通道质荷比分别为416.3∶398.4和407.3∶389.4。离子源温度:550 ℃,离子源电压5 500 V,气帘气20,雾化器55,辅助气55。实验步骤:吸取200 μL血清标本至2 mL离心管中,加入400 μL的内标工作液[含50.0 ng/mL的d6-25(OH)D2、50.0 ng/mL的d6-25(OH)D3及1.00 μg/mL雌三醇的乙腈溶液],充分震荡5 min,加入800 μL正己烷震荡10 min后,室温10 000 r/min离心10 min;吸取700 μL上清液60 ℃加热氮气吹干,加入100 μL复溶液,可得待测标本,转移至进样瓶后上机检测。进样顺序为空白样品-标准工作曲线-空白样品-质控-空白样品-待测血清标本-空白样品-质控-空白样品,查看标准曲线及质控是否在控,查看质谱图峰形、出峰时间及分离度是否正常,确认后导出数据。(2)维生素D营养状况判定:根据血清25(OH)D浓度,将血清25(OH)D<20.0 ng/mL判定为维生素D缺乏,20~<30.0 ng/mL判定为维生素D不足。
1.4质量控制
1.4.1LC-MS/MS 25(OH)D2和25(OH)D3检出限分别为0.31 ng/mL、0.46 ng/mL,定量限分别为1.56 ng/mL、1.66 ng/mL。25(OH)D2重复性精密度为12.03%(低浓度)、9.57%(高浓度),25(OH)D2中间精密度为8.90%(低浓度)、8.78%(高浓度);25(OH)D3重复性精密度为4.64%(低浓度)、2.26%(高浓度),25(OH)D3中间精密度为4.76%(低浓度)、2.47%(高浓度)。该检测通过国家卫生健康委临床检验中心(NCCL)组织的室间质评及正确度验证。
1.4.2ECLIA 25(OH)D检出限为3.00 ng/mL,定量限为4.39 ng/mL,重复性精密度为5.99%(低浓度)、4.58%(高浓度),中间精密度为7.98%(低浓度)、5.92%(高浓度),该检测通过NCCL组织的室间质评。
1.5统计学处理 采用Medcala11.0及SPSS18.0软件进行统计分析。使用配对t检验分析两种方法检测结果差异是否有统计学意义;使用Passing-Boblok回归分析两种检测方法之间的相关性;Bland-Altman及Mountain plot进行两种方法的一致性检验;使用Kappa分析判断两种方法评估维生素D营养状况的诊断符合率。以P<0.05为差异有统计学意义。
2 结 果
2.1两种方法的检测结果 本实验室LC-MS/MS与ECLIA法均经过严格的方法学验证,并参与了NCCL的室间质评,使用LC-MS/MS与ECLIA检测25(OH)D,当日质控结果均在控。使用LC-MS/MS与ECLIA检测94例血清标本25(OH)D浓度,两种方法测定的25(OH)D浓度结果比较,差异有统计学意义(P<0.05)。LC-MS/MS系统检测25(OH)D最低值为4.82 ng/mL,最高值为76.23 ng/mL。ECLIA系统检测最低值为6.41 ng/mL,最高值为127.78 ng/mL。见表1。

表1 LC-MS/MS与ECLIA对94例血清标本25(OH)D浓度的检测结果比较(ng/mL)
2.2两种方法的相关性和一致性 Passing-Bablok 回归分析显示两种方法检测25(OH)D浓度的回归方程为YECLIA=-4.558 1+1.719 8XLC-MS/MS,斜率为1.719 8(95%CI1.586 3~1.828 4),不包含1,截距为-4.558 1(95%CI-7.692 2 ~ -2.122 1),不包含0,提示两种方法存在系统差异或比例差异,见图1。Bland-Altman图显示两种方法差值的均值为-12.7,差值的95%CI为-35.7~10.4,有3个点[界外点数(比率)为3.19%]落在95%一致性界限以外,见图2。山形图的山顶值为-9.17 ng/mL,偏离0较多,见图3。以上结果显示两种方法检测的结果一致性较差。

图1 ECLIA与LC-MS/MS检测25(OH)D浓度的Passing-Bablok回归图
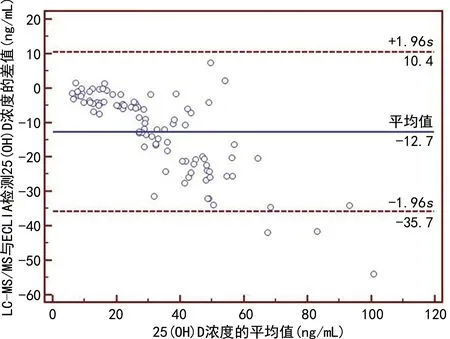
图2 ECLIA与LC-MS/MS法检测25(OH)D浓度的Bland-Altman 图
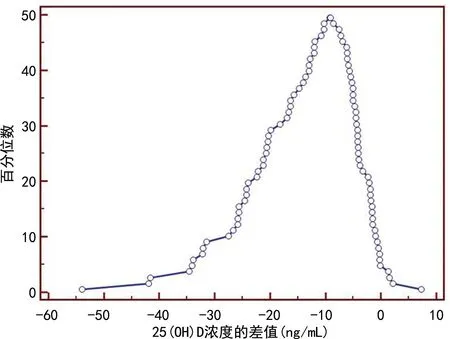
图3 ECLIA与LC-MS/MS法检测25(OH)D浓度的山形图
2.3两种方法诊断维生素D缺乏的一致性评价 将94例血清标本LC-MS/MS与ECLIA检测结果进行比较,判断受检者维生素D营养状况。使用Kappa分析判断两种方法诊断维生素D营养状况的符合率。两种方法判断维生素D缺乏的符合率为94.68%,Kappa=0.875≥0.750,P<0.001,表明两种方法诊断结果具有一致性,一致性较好[3]。两种方法判断维生素D不足的符合率为75.53%,Kappa=0.538,0.400 研究表明,维生素D不仅可以维持体内钙磷平衡及骨骼代谢,其在免疫调节、癌症、抗炎及心血管健康等方面也起着至关重要的作用[5]。维生素D缺乏或不足易导致佝偻病及骨质疏松症等常见病的发生,过量也会导致高钙血症等相关疾病[6]。相关研究指出,血清25(OH)D浓度检测已被公认为反映维生素D状态的最合理指标[7]。因此,需要选择合适的25(OH)D检测方法以辅助临床进行疾病诊断及预防。 目前临床实验室25(OH)D检测方法主要有放射免疫法(RIA)、酶联免疫吸附试验(ELISA)、ECLIA、高效液相色谱法(HPLC)及LC-MS/MS等[8]。不同检测系统由于采用的方法学不同,抗干扰能力也不同,会出现同一标本在不同检测系统上得到不同的检测结果,这种结果差异的出现可能会影响临床对疾病的判读。为了改变不同检测系统结果差异的这种情况,有机构成立了维生素D标准化项目,其宗旨是促进全球所有实验室25(OH)D检测方法(包括商业化和自建方法)的标准化,从而提高医疗安全,保障全民健康[9-10]。目前越来越多厂商及大型临床实验室加入美国疾病控制和预防中心标准化认证程序的行列中,参加实验室数与日俱增,但距离25(OH)D检测结果一致的目的仍任重而道远[11]。因此,对不同检测系统所得到的结果之间的相关性及一致性进行评估是非常有意义的工作。 本研究采用LC-MS/MS与ECLIA这两种方法检测血清中25(OH)D浓度,LC-MS/MS测定25(OH)D浓度明显低于ECLIA,统计分析结果显示两种方法一致性较差。引起这种结果差异的原因可能有以下几点:ECLIA原理为利用抗原抗体反应进行有效结合,易受基质及抗体状态影响,特异性较差,而LC-MS/MS经过对血清标本前处理、色谱分离、串联质谱根据分子量进行区分检测,可实现25(OH)D2、25(OH)D3的精准检测,从方法学角度来分析,ECLIA较之LC-MS/MS测定结果偏高[7,12-13]。再者,ECLIA无法避免25(OH)D3的3-epi-25(OH)D3异构体造成的影响,导致交叉反应,从而可能使得检测结果较高[14]。25(OH)D与维生素D结合蛋白是否解离完全,也是影响其检测结果准确性的重要影响因素,受试者维生素D结合蛋白浓度差异也导致了其对维生素D代谢物的亲和力不同,这也是ECLIA与LC-MS/MS产生检测结果差异的可能原因[15]。 两种方法在诊断维生素D缺乏时诊断符合率为94.68%,Kappa系数为0.875,一致性较好,诊断维生素D不足的诊断符合率为75.53%,Kappa系数为0.538,一致性中等,整体来看,依据营养状况诊断维生素D缺乏与不足的符合率较高。LC-MS/MS因其高灵敏度、特异度等优势,被认为是血清25(OH)D检测的金标准,但目前质谱仪器价格较高,且对实验室环境条件及人员技术要求较高,在大型医院及第三方医学检验实验室应用较多,在小型医院暂未广泛使用。而ECLIA自动化程度高,成本较低,适用于小型医院及健康体检。这两种方法在应用和选择时,临床应考虑可能存在的干扰因素,根据实际情况选择合适检测系统。在进行维生素D检测时,25(OH)D2虽检出率较高,但大多数标本浓度较低,对无LC-MS/MS检测能力的实验室可选择传统免疫方法作为替代方法;当受试者服用过25(OH)D2时,LC-MS/MS是更可靠的检测方法。在解读维生素D报告时,应充分考虑所选用的检测方法,建立本实验室所用方法检测25(OH)D的参考范围,并尽快实施维生素D检测一致化计划。 本研究尚有不足,仅比对了罗氏电化学发光免疫分析仪与LC-MS/MS检测25(OH)D的一致性,入组样本量不大,后续可进行其他平台的比对。3-epi-25(OH)D3是25(OH)D3的同分异构体,在结构上仅有一个羟基空间方向上的差异,需高灵敏度质谱仪器才能将其分离检测,它的存在会造成25(OH)D检测结果的假阳性,3-epi-25(OH)D3在一岁以下婴幼儿中浓度较高,影响更为明显。同时检测25(OH)D2、25(OH)D3、3-epi-25(OH)D3的浓度有助于真实准确地评估维生素D营养水平,对于骨质疏松、佝偻病的治疗防治可提供有效诊断依据,同时可为心血管及肿瘤疾病等提供辅助诊断。后续仍需继续开发可分离3-epi-25(OH)D3的LC-MS/MS检测方法,助力实现25(OH)D的精准检测。同时提示检验实验室应定期进行比对,保证检测结果的准确性。临床在解读报告时也应考虑到不同检测系统对检测结果的影响。 综上所述,ECLIA与LC-MS/MS检测结果一致性较差,但依据营养状况诊断维生素D缺乏与不足的符合率较高。两种检测方法都可以应用于临床检测,临床可根据实际需求选择相应检测方法。3 讨 论
