不同磷水平土壤以碳促磷效应研究
2023-12-25徐达兼孟鹏飞
徐达兼,杨 锴,孟鹏飞,朗 明,郭 涛
(西南大学资源环境学院,重庆400716)
磷(P)是构成生物许多重要化合物(如ATP、磷脂、DNA、RNA 等)的组成成分[1],在生命活动中发挥着重要作用。磷在土壤中存在多种形态,不同形态磷的可利用率不同,生物化学转化过程也不一样[1-3]。水溶性磷能被植物通过截获质流直接利用,无机沉淀弱结合状态下的磷需要通过有机酸溶解释放,吸附于矿物表面难以利用的磷需要强酸或酶活化。土壤有机磷在土壤全磷中的占比大约为20%~40%[4],成分复杂,至今依然存在大量未被鉴明的组分[5]。在自然状态下,土壤往往是处于磷素缺乏状态,农业生产通常施用磷肥来缓解农田中的磷缺乏。进入土壤中的磷经过一系列物理化学过程后往往被固定,成为难以被利用的闭蓄态磷[6],降低了磷的利用率。磷在土壤中固定过程不可避免,只能通过提高其利用效率来改善,目前的方法主要通过优化种植施肥管理制度[7-8],筛选具有磷高效利用基因的作物品种[9-10],以及施用豆科绿肥、接种菌根等方法提高土壤磷的可用性[11-13]。
微生物是地球化学循环的关键驱动因素,农田土壤中的微生物可改善磷的有效性[14]。微生物群落具有能够在磷有效性极低的土壤中生存的能力[15],原因是它们能够从难溶性含磷化合物中释放磷[16]。比如,丛枝菌根真菌菌丝可以通过释放有机酸来溶解土壤中的无效磷[17],多黏杆菌产生的多糖素能够增强植物根部细胞透性,导致根系分泌较多的氨基酸,溶解土壤中难溶性磷[18]。缺磷条件下,部分微生物会上调可缓解磷胁迫基因的表达,诱导或增强各种磷酸酶活性,实现强化磷循环[19]。外源碳添加可以通过刺激微生物的生命周期运转改变微生物群落结构,影响土壤中微生物介导的磷周转[20-21],促使更多的难溶形态的磷转化为可供植物吸收的有效磷形态[22]。添加外源碳提高土壤有效磷的含量与微生物群落组成变化已有许多报道[11-12,23],反过来,测定有效磷含量的变化也可分析外源碳对微生物群落结构的影响,帮助我们理解微生物在磷有效性改变这一过程中扮演的角色。
由于农业管理方式的不同,土壤磷水平往往存在较大的差异,外源碳在不同磷水平土壤上引起的磷有效性改变是否有所差异尚未可知。我们假设外源碳的加入可以改变微生物群落,启动微生物介导的磷形态变化,从而改变土壤磷库组成和磷的有效性,且这种改变在不同磷水平土壤中有所差异,探索外源碳加入后微生物群落与土壤磷库变化关系,为未来进一步研究磷素高效利用措施、改进管理方法提供理论支撑。
1 材料与方法
1.1 试验设计与材料
供试土壤为采自重庆市北碚区农户玉米地的低磷紫色土(A)和露天菜地的高磷紫色土(B),供试土壤基本性质见表1,土壤风干后过1 cm 筛网备用。

表1 供试土壤基本性质Table 1 Basic properties of soils
以容量为2 L 的黑色聚乙烯塑料瓶作试验容器,两种土壤上设添加葡萄糖处理(+G)和不添加葡萄糖(-G),其中添加葡萄糖处理的碳(C)添加量为500 mg/kg,每个处理均设置4 个重复。将各处理土壤保持田间最大持水量的50%于避光下预培养5 天后,在添加外源碳处理的容器上盖上提前浸润葡萄糖溶液的纱布,将葡萄糖溶液少量多次浇到纱布上;不添加外源碳的对照组添加等量的去离子水,最终使所有处理土壤含水量为最大田间持水量的60%。在处理的第0、2、15 和60 天从瓶中采集土样,每次在盆栽四周、中心点等位置采样,均匀地深挖5—10 cm,将所有土壤样品放在同一自封袋中,轻轻混合,共采集约150 g 鲜土。取土壤前后称量瓶子的总重,以差减法准确计算采集的鲜土质量;取少量瓶中土壤通过烘干法测定剩余土壤的含水量,计算瓶中剩余土壤质量,以便于准确维持土壤含水率。将每次采集的新鲜土壤样品分为3 份:一份保存于4℃冰箱,用以土壤微生物量磷的测定;一份保存于-80℃,样品全部取完后提取土壤总DNA 扩增V3~V4 区域,通过illumina Miseq 平台测序,测序工作由广州基迪奥生物科技有限公司完成;一份风干后磨碎过1 mm 和0.25 mm 筛,用于Olsen-P、磷酸酶、BBP 磷分级磷的测定。
1.2 样品测定与分析
采用BBP 磷分级方法[24]测定不同生物有效性磷,准确称取0.5 g 风干土壤样品置于15 mL 离心管,依次加入10 mL 0.01 mol/L CaCl2、10 mmol/L 柠檬酸、0.02 EU/mL 酸性磷酸酶、1 mol/L 盐酸4 种提取液。按顺序提取的磷组分为:可溶性磷(CaCl2-P);柠檬酸溶性磷(Citrate-P)、酶磷(Enzyme-P)和无机磷(HCl-P)。采用NaHCO3浸提—钼锑抗比色法测定Olsen-P,采用灼烧法测定有机磷。
采用氯仿熏蒸法测定土壤微生物生物量磷(microbial biomass phosphorus,MBP)[25]。称取5 g 土壤放入真空干燥器,同时放入一小烧杯去乙醇的氯仿及一小烧杯2 mol/L NaOH,抽真空保持氯仿沸腾5 min,避光培养24 h。培养结束后向样品中添加25 mL 0.5 mol/L NaHCO3振荡30 min 后过滤。称取两份5 g 鲜土,均不进行氯仿熏蒸,一份作为对照,另一份加入125 μg P 用于微生物生物量磷回收率的计算,后续浸提步骤同上。3 份滤液中的磷含量使用钼蓝法测定。按以下公式计算微生物生物量磷:
式中:F为熏蒸土壤的磷含量;UF为未熏蒸土壤的磷含量;Kp为转换系数,取0.4;R为回收率,即加入的无机磷的回收百分比。
磷酸酶活性的测定方法[26]:称取0.5 g 过0.25 mm筛的风干土样于15 mL 离心管,加入0.5 mL 甲苯,放置15 min 再加入1 mL 磷酸苯二钠和1 mL 对应土壤pH 的缓冲液,酸性磷酸酶采用pH 5.0 醋酸盐缓冲液(0.2 mol/L 醋酸钠和0.2 mol/L 醋酸的体积比7∶3 的混合液),中性磷酸酶采用pH 7.0 柠檬酸盐缓冲液(0.1 mol/L 柠檬酸和0.2 mol/L 磷酸氢二钠体积比为3.63∶16.37 的混合液),碱性磷酸酶采用硼酸盐缓冲液(1.91% 硼砂和0.4% 氢氧化钠体积比为50∶43 的混合液),摇匀后于37℃培养24 h。培养结束后加3 mL 去离子水,摇匀后过滤。取一定体积滤液于25 mL 容量瓶,加入1.25 mL pH 9.0 硼酸盐缓冲液,再加入3 mL 2.5%铁氰化钾和3 mL 0.5%4-氨基安替吡啉,定容摇匀,30 min 后在570 nm 波长比色测定酚含量。
土壤呼吸使用NaOH 溶液吸收—标准酸滴定法测定。在加入葡萄糖后的前两天,瓶内放入盛有50 mL 0.25 mol/L NaOH 用以吸收土壤微生物呼吸所释放的CO2,每12 h 更换1 次。每次吸取5 mL 溶液于三角瓶中,加入2.5 mL 1 mol/L 的BaCl2溶液及3 滴酚酞指示剂,使用0.05 mol/L 的标准硫酸滴定,计算土壤呼吸所生成的CO2的量。
1.3 数据处理与分析
使用 Microsoft Excel 2010 对土壤理化性质数据进行统计和处理,数据分析使用R4.2.0 进行处理;使用R 包rstatix 进行t检验和双因素方差分析;使用R 包vegan 进行PCoA 分析;使用R 包picante分析群落α 多样性;使用R 包edgeR、indicspecies、igraph 进行共发生网络的绘制和差异物种分析。使用R 包plspm 进行偏最小二乘路径分析,分析结果使用cytoscape3.9.1 可视化。
2 结果与分析
2.1 添加葡萄糖对土壤中Olsen-P 和有机磷的影响
供试土壤在添加葡萄糖后,低磷水平土壤添加葡萄糖的处理组的Olsen-P 含量表现出明显的先降低后回升的趋势,同对照组相比,土壤Olsen-P 含量在第2 天、第15 天显著降低(图1A),相比未添加葡萄糖处理的土壤,Olsen-P 含量分别降低了41.44%和40.32%,在第60 天取样时处理组和对照组的Olsen-P 含量回复到了处理前的水平,且两组不存在显著性差异;高磷紫色土(B)的处理组和对照组相比,在第2 天和第15 天的Olsen-P 含量同样存在显著性差异,分别降低了18.90%和3.54%。两种磷水平土壤在添加葡萄糖后Olsen-P 含量的变化趋势表现出了一致性,即添加外源性碳后都表现为先降低后回复到处理之前的水平。低磷紫色土处理组与对照组有机磷含量在取样过程中整体波动较小,在试验第60 天取样时处理组的有机磷含量相较于对照组显著上升,土壤有机磷含量比对照处理高18.52%;高磷水平土壤在60 天处理组相比于对照组土壤有机磷含量平均值降低,减少了24.43 mg/kg,但是整个试验过程对照组和处理组未表现出统计学上的显著性差异(图1B)。
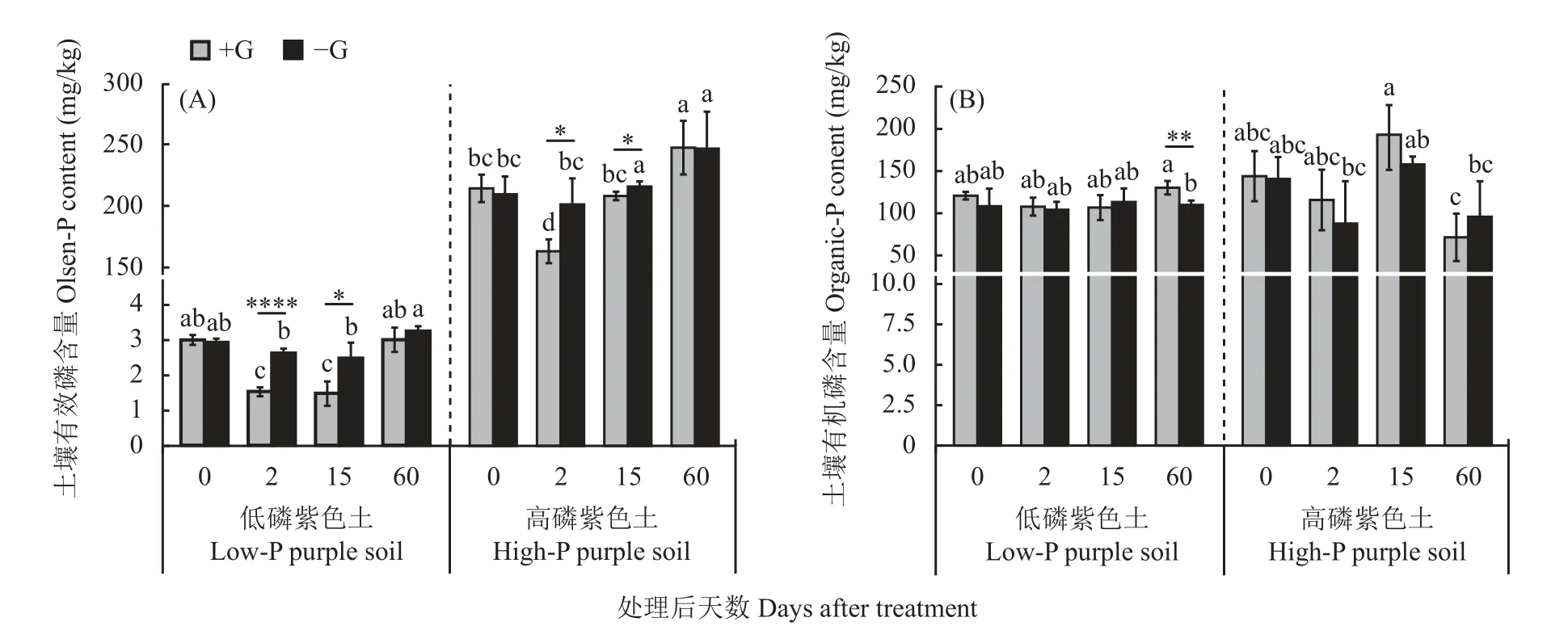
图1 低磷和高磷土壤添加和不添加葡萄糖处理Olsen-P 和有机磷含量随培养时间的变化Fig.1 The dynamics of Olsen-P and organic P content with incubation days in the high and low P soils with and without glucose addition
2.2 添加葡萄糖对土壤中BBP 磷分级磷的影响
从图2A 可以看出,两种磷水平紫色土经培养后CaCl2-P 含量表现出增加的趋势。高磷紫色土经葡萄糖处理后CaCl2-P 含量在第2 天、第60 天呈显著性降低,第2 天处理组的CaCl2-P 相比于对照组下降了12.18%,第60 天下降了22.34%,低磷紫色土培养前后差异多不显著,但是总体上有上升趋势。柠檬酸提取的磷如图2B 显示,两种磷水平紫色土在添加葡萄糖后第2 天Citrate-P 含量处理组相对于对照组均显著降低,低磷紫色土中降低了20.40%,高磷紫色土中降低了3.54%;低磷紫色土在第15 天取样测定时处理组相比于对照组显著降低了23.50%,第60 天取样时处理组和对照组没有显著差异;高磷紫色土在第60 天取样时Citrate-P 含量显著降低17.03%。Enzyme-P 含量在低磷紫色土中添加葡萄糖处理和对照组对比,虽然在第2 天有显著性下降,但是整个培养过程未表现出明显的上升或下降的趋势;高磷紫色土对照组和处理组在试验期间始终没有显著差异,但从含量平均值的变化可以看出添加葡萄糖有提高高磷紫色土Enzyme-P 含量的趋势,第60 天添加葡萄糖处理组与对照组Enzyme-P 磷含量均值与培养前相比高出了19.47%。HCl-P 的含量变化在两种供试土壤中都未达到显著水平,高磷紫色土处理组和对照组的HCl-P 含量整个过程几乎无变化,低磷紫色土则是表现出添加葡萄糖后的处理组中HCl-P含量降低的趋势。

图2 低磷和高磷土壤添加和不添加葡萄糖处理BBP 磷含量变化Fig.2 The dynamics of BBP phosphorus content with incubation days in the high and low P soils with and without glucose addition
2.3 添加葡萄糖对磷酸酶、微生物生物量磷和土壤呼吸的影响
低磷紫色土培养期间微生物生物量磷(MBP)含量变化较大(图3A),第60 天添加葡萄糖处理组土壤MBP 含量显著高于不添加处理,为3.38 mg/kg,比不添加处理高出53.64%。高磷紫色土中,添加葡萄糖和对照处理土壤相比,MBP 在试验期间均无显著差异,仅在均值上表现出一定的添加葡萄糖后MBP增加的趋势。

图3 低磷和高磷土壤添加与不添加葡萄糖处理MBP 含量和磷酸酶活性随培养时间的变化Fig.3 The dynamics of MBP content and phosphatase activity with incubation days in low and high P soils with and without glucose addition
从图3B 可以看出,低磷紫色土和高磷紫色土磷酸酶活性相似,添加葡萄糖后土壤的磷酸酶活性改变趋势表现为低磷土壤中处理组较为显著增加了磷酸酶活性,高磷土壤处理组代表酶活性的酚产生量均值表现出了上升特征,但是在试验过程中与不添加葡萄糖的对照组相比并未表现出显著差异。低磷紫色土加入葡萄糖第2 天和第60 天时,磷酸酶活性与对照相比显著提高,第2 天酚产生量为81.26 μg/(g·24 h),相比于对照组上升了16.94%,第60 天低磷紫色土处理组酚产生量为90.64 μg/(g·24 h),与对照相比提高了24.15%。
土壤呼吸强度在整个培养过程中的变化如图4所示,在添加葡萄糖后的两天内土壤呼吸强度上升较快,随后减缓,随培养天数的增加,处理组与对照组土壤微生物释放的CO2累计积累量稳定增加。低磷紫色土的土壤呼吸强度始终高于高磷紫色土,同种土壤的处理组与对照组相比,添加葡萄糖后土壤呼吸强度上升,CO2释放量达到了极显著差异水平。低磷紫色土添加葡萄糖处理累计C O2释放量为856.06 mg/kg,对照为510.56 mg/kg,处理组相比对照组增加了67.67%;高磷紫色土添加葡萄糖处理累计CO2释放量为662.64 mg/kg,对照组为375.09 mg/kg,处理组相比对照组增加了76.66%。
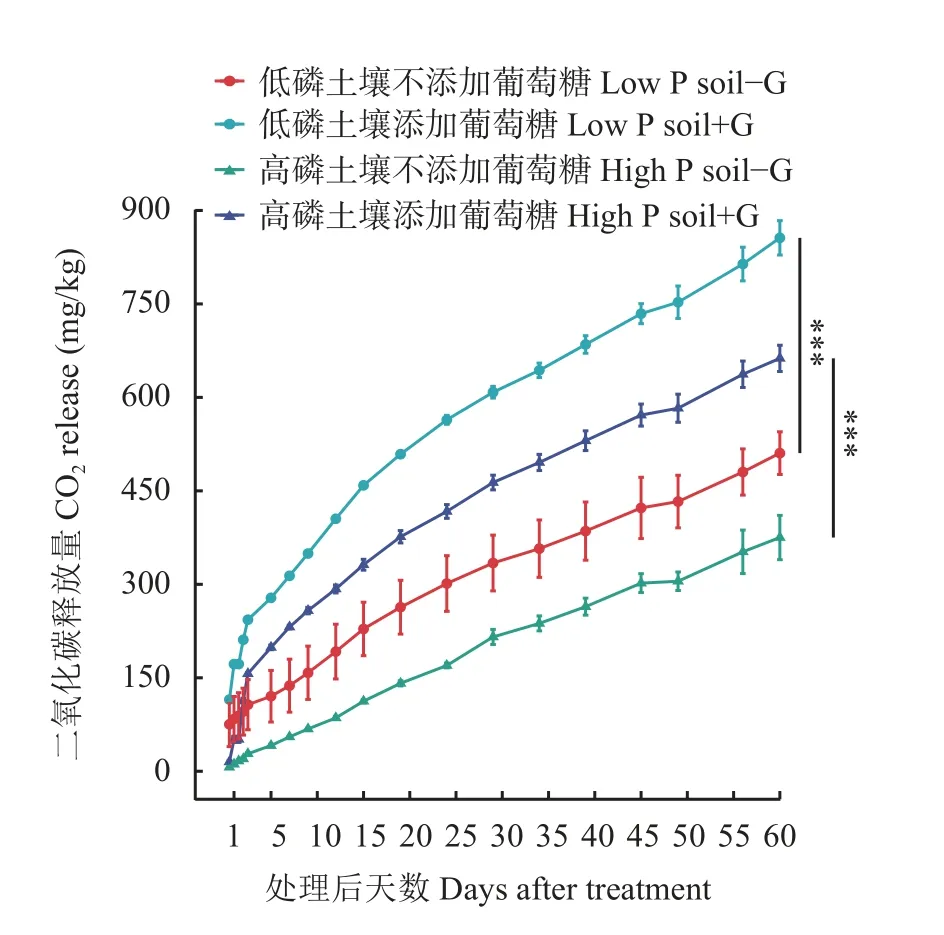
图4 添加葡萄糖对不同磷水平土壤呼吸强度的影响Fig.4 Effects of glucose addition on soil respiration intensity at different phosphorus levels
2.4 细菌群落对添加葡萄糖的响应
2.4.1 细菌群落的结构差异 使用PCoA 分析添加葡萄糖组与对照组细菌群落的差异性,图5 结果显示,PC1 和PC2 两个主坐标轴累计分别解释了低磷和高磷土壤群落结构变化信息的62%和68%,其中在低磷水平土壤添加葡萄糖后微生物群落结构在PC1(47%)变化显著,高磷水平土壤在PC2(20%)变化显著,结合置换多元方差分析结果,低磷条件下添加葡萄糖后土壤细菌群落与未添加葡萄糖的土壤细菌群落分离趋势明显(P=0.044),显示低磷条件下添加葡萄糖对细菌群落影响更大。使用Shannon 指数表示细菌群落的α 多样性,添加葡萄糖后,低磷水平紫色土中的细菌群落Shannon 指数显著上升(P<0.05),高磷水平紫色土中的细菌群落没有显著差异,这表明低磷紫色土中添加葡萄糖更能增加细菌群落的多样性。

图5 两种土壤添加葡萄糖前后微生物群落结构变化Fig.5 Microbial community structure in low and high P soils before and after glucose addition
两种土壤中相对丰度处于前十位的菌门有变形杆菌门(Proteobacteria),浮霉菌门(Planctomycetes),放线菌门(Actinobacteria),酸杆菌门(Acidobacteria),芽单胞菌门(Gemmatimonatetes),绿弯菌门(Chloroflexi),Parcubacteria 菌门,螺旋体菌门(Saccharibacteria),拟杆菌门(Bacteroidetes),疣微菌门(Verrucomictobia)。在两种磷水平土壤添加葡萄糖前后变形杆菌门都是主导菌门,其相对丰度显著高于其他菌门,低磷水平土壤经过葡萄糖处理后变形杆菌门、拟杆菌门、Paracubacteria 菌门相对丰度上升,绿弯菌门相对丰度有所下降;高磷水平土壤经过葡萄糖处理后放线菌门相对丰度下降,Paracubacteria 菌门相对丰度上升。
2.4.2 添加葡萄糖后土壤细菌的共发生网络分析为进一步研究添加葡萄糖前后细菌群落的变化,利用OTUs 数据构建了两种土壤的细菌共现网络。由图6 可以看出,两种磷水平的土壤添加葡萄糖后,均出现了部分差异OTUs,且模块化特征明显,在生态功能上具有相互联系的微生物子集共同出现和消失。共发生网络中模块按模块中微生物丰度从高到低排列为模块1~模块5,在低磷水平的土壤细菌网络中,添加葡萄糖后显著性增加的大量差异OTUs位于模块2 和模块3 中,显著性减少的大量差异OTUs位于模块1、模块5 中;在高磷水平的土壤细菌网络中,添加葡萄糖后显著性增加的大量差异OTUs 位于模块1、模块4、模块5 中,显著性减少的大量差异OTUs 位于模块2、模块3 中;这些模块中的微生物丰度差异反映,外源性添加的葡萄糖会驱动大量有互作关系的差异OTUs 出现。不同磷水平土壤添加葡萄糖后差异OTUs 的物种变化有所不同,在目水平上,低磷水平紫色土添加葡萄糖后显著增加了伯克氏菌目(24.4%)等菌目,在添加葡萄糖后相较于未添加时减少了JG30-KF-AS9 目(16.7%)等菌目。高磷水平紫色土添加葡萄糖后显著增加了浮霉菌目(29.6%)等;显著减少了Gaiellales菌目等。

图6 添加葡萄糖后的共生网络图和差异OTUsFig.6 Co-occurrence network diagram and differential OTUs after adding glucose
2.5 细菌群落属水平的差异分析
对目水平的已鉴定物种进行更进一步的差异比较,结果显示低磷水平土壤中在属水平上最能表征两种处理差异的物种为伯克霍尔德菌属Paraburkholderia,高磷水平土壤中最能表征两种处理差异的物种为Mucilaginibacter。可以看出两种磷水平土壤在添加葡萄糖后细菌群落中新增和减少的土壤细菌种类有显著差异(图7)。
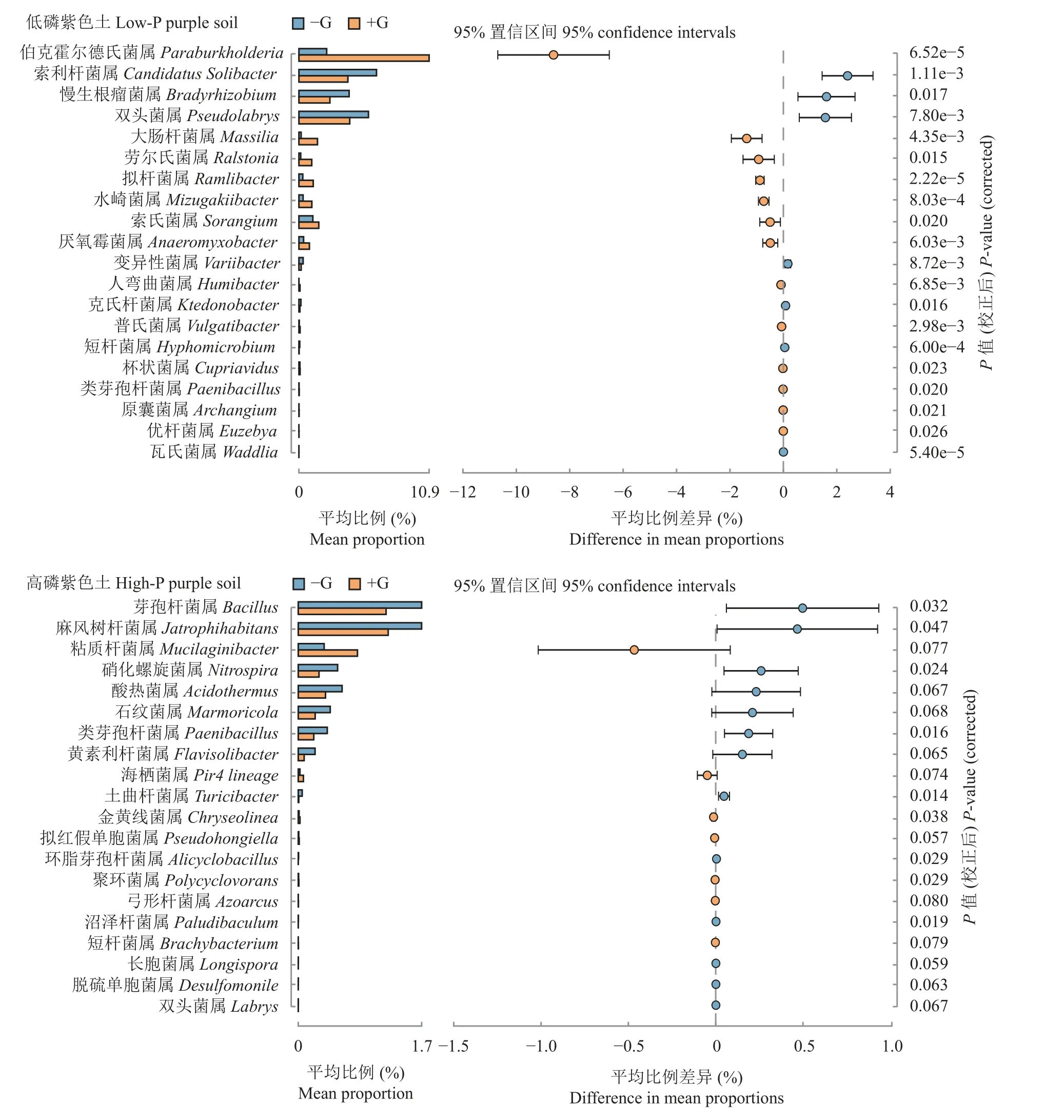
图7 两种磷水平土壤添加葡萄糖前后的组间细菌群落水平差异分析Fig.7 Analysis of bacteria community differences in the two phosphorus levels soils before and after adding glucose
2.6 细菌群落与土壤不同形态磷的偏最小二乘路径模型
添加葡萄糖改变了BBP 磷分级和其他形态磷以及细菌群落的结构,为了进一步研究细菌群落的变化与不同形态磷含量变化的关系,对数据进行了偏最小二乘路径建模(图8),将磷酸酶活性和样品中微生物群落系统发育距离作为观测变量定义潜变量微生物群落变化,并舍弃变化不显著的磷形态的含量变化。低磷水平土壤的模型拟合优度为0.82(GOF),高磷水平土壤的模型拟合优度为0.73(GOF)。根据模型可以看出两种磷水平的土壤中微生物群落的改变,都会正向促进参与土壤有机磷循环重要途径的微生物生物量磷增加。在形成磷周转的过程中,两种磷水平土壤中不同形态磷含量发生的变化有些许不同。低磷情况下微生物群落结构的变化使Olsen-P、Citrate-P、Enzyme-P 含量减少,有机磷和微生物生物量磷含量增加。高磷情况下微生物群落的结构变化使Olsen-P、CaCl2-P、Citrate-P 含量减少,Enzyme-P、有机磷和微生物生物量磷含量增加,表明不同磷水平土壤对外源性葡萄糖添加的响应情况具有一定的差异性。

图8 低磷和高磷土壤不同磷组分与微生物群落的PLS-PM 模型Fig.8 The plspm models of different phosphorus fractions and microbial communities in low and high P soils
3 讨论
3.1 添加葡萄糖对不同磷水平土壤中磷形态的影响
本研究中添加葡萄糖造成了土壤磷库中的不同形态磷含量显著动态变化(图1~图3),证明了我们关于碳添加会导致土壤磷组分变化的假说,这与部分前人的研究结果[27-29]相符合。土壤磷水平导致添加葡萄糖引发的磷形态变化的差异,低磷紫色土添加葡萄糖后短期内4 种BBP 磷含量均值均减小,到第60 天时CaCl2-P 含量恢复,Enzyme-P 和HCl-P 一直保持降低的趋势。高磷紫色土添加葡萄糖到第60 天时CaCl2-P、Citrate-P 显著降低,而Enzyme-P 则显著升高,HCl-P 作为稳定态磷在两种土壤中都未出现显著性变化。低磷紫色土添加葡萄糖处理有机磷含量增加,而高磷紫色土则降低,说明在磷匮乏的土中添加外源碳增加了土壤微生物数量,提高了土壤生物有效性磷组分和有机磷含量。试验过程两种土壤中BBP 磷组分的变化差异体现了土壤磷库周转的差异,这可能是由于低磷土壤有机碳含量相对高磷土壤较低,添加葡萄糖显著解除了低磷土壤对微生物的碳限制,导致低磷土壤添加葡萄糖后微生物群落结构较高磷土壤差异更大导致的[30]。向土壤添加营养物质后,土壤中的部分物种对营养物质反应迅速,进而迅速繁殖抢占生态位,导致整个群落结构的变化[31-32],plspm 模型显示两种土壤中微生物群落对磷库中不同形态磷的影响过程有些不同,低磷土壤中微生物受碳源刺激后改变磷库的过程几乎不涉及CaCl2-P,在高磷土壤中却显著改变了CaCl2-P。由试验过程中添加葡萄糖后的土壤磷酸酶活性变化和不同形态磷的变化,特别是土壤磷循环功能关键周转部分的微生物生物量磷和土壤有效性Olsen-P 含量变化可以看出,相同水平的外源碳的添加对低磷水平土壤中磷形态和磷周转的影响要大于高磷水平土壤。
相关研究也显示了外源性碳添加介导土壤磷组分由非活性磷库向更多活性磷形态的转化,Sun 等[33]的研究结果证明,纤维素的添加促使微生物推动土壤中Citrate-P 和HCl-P(较稳定磷形态)向微生物P(不稳定磷形态)的转化,本研究中对Olsen-P 和BBP 的测定有相似结果,不管在低磷还是高磷土壤中Citrate-P 都在试验过程中出现了显著性降低;与之不同的是在存在较多土壤易利用磷的高磷土壤中, CaCl2磷在培养第2 天显著降低,而低磷土壤在试验过程中未出现显著性变化,表明在易利用的磷余量较大时添加外源性碳会减少易利用的磷储量[31]。与不添加葡萄糖的对照组相比,添加葡萄糖的处理组土壤微生物生物量磷均值在整个试验过程上升,两种磷水平土壤的微生物生物量磷的变化趋势保持了一致性,说明外源碳的加入在酸性紫色土中均能有效增加微生物生物量磷[29]。与低磷土壤添加外源碳后微生物生物量磷的显著性变化相比,高磷土壤在整个试验阶段未表现出显著性的MBP 含量变化,这可能是由于高磷土壤在磷含量较高之外同时具有较高的有机质含量和微生物量,导致同样的外源碳添加后在高磷土壤中碳的增加量相对于原有量变化不如在低磷土壤中显著。相关研究也表明土壤与碳含量不同的作物残茬混合后,混合后低碳含量土壤与高碳含量土壤相比更易被诱导增加有效性磷含量[34];使用不同的有机物料处理同种土壤,土壤中有效磷、微生物生物量磷的含量改变有所不同[35-36],表明在土壤环境中碳含量是影响以碳促磷效果的因素之一。在低有机质土壤中,土壤黏粒对磷酸盐的束缚作用强于有机质中有机酸对磷酸根离子的交换作用,致使磷酸根离子往往很难被释放出来[37],所以自然环境土壤低碳与低磷通常是一起出现,本研究所使用两种磷水平土壤为玉米地土和菜地土,在磷含量差异极大的情况下,还存在有一定的有机质含量差异,这可能也是导致两种磷水平土壤对外源碳添加的响应存在一定差异的部分原因。
结合本研究结果对照推断以碳促磷的效果,在磷水平外,可能同时会受到土壤原本有机质含量的影响,这也为后续研究指明了方向。在农田生态系统中,由于耕作措施的不同,土壤有机质含量和品质存在较大的差异,以碳促磷的试验中需要将土壤有机质的含量、品质与磷含量结合考虑,量化外源碳添加时不同土壤条件下磷含量变化及土壤基础磷含量和有机质含量的变化关系,更好的提升土壤磷有效性和降低碳成本。
3.2 外源性葡萄糖添加对不同磷水平土壤细菌群落的影响
外源性葡萄糖的加入显著增加了两种土壤的土壤呼吸强度和磷酸酶活性,与前人[38-40]研究结果保持了一致,说明微生物的生命活动因外源碳的添加得到增强,低磷土壤中添加葡萄糖显著改变了细菌群落结构,Shannon 指数显著变大,PCoA 图显示微生物群落在PC1 轴分离明显,PERMANOVA 结果表明添加葡萄糖后群落差异明显(P<0.05);高磷土壤在添加葡萄糖后α 多样性无显著变化,在PCoA 分析中在PC2 轴具有分离趋势,群落整体不具有明显的分离趋势(P>0.05)。其他研究者也发现外源性碳的添加会显著改变微生物群落结构[10,41-42],本研究中低磷水平土壤发生的变化与其一致,高磷水平土壤发生变化不明显,可能是因为高磷紫色土中原本占优势地位的类群同时是利用碳源能力强的类群[18,43],外源碳的加入并没有改变它们的优势生态位。
本研究中,低磷水平土壤添加葡萄糖后差异物种的数量和模块化程度都要大于高磷水平土壤(图6),说明低磷水平添加葡萄糖改变的OTUs 联系更紧密,受外界因素驱动而一起改变的可能性更大。在差异物种的分布上,低磷土壤添加葡萄糖后增加了以伯克氏菌目、粘球菌目等的一些细菌,减少了JG30-KF-AS9 目、根瘤菌目等的一些细菌;高磷土壤增加了浮霉菌目、红螺菌目等的一些细菌,减少了Gaiellales 菌目、芽孢杆菌目等的一些细菌,不管是新增物种还是减少的物种,两种磷水平的土壤都有极大的差异,低磷水平土壤添加葡萄糖后出现的属水平丰度最高的差异物种为伯克霍尔德菌属Paraburkholderia,Yang 等[43]研究证明了其具有溶解土壤中闭蓄态磷的作用,可以对两种土壤添加外源碳后土壤磷库不同形态磷含量的变化特征的差异做出一定的解释。
4 结论
外源碳对低磷土壤磷库和微生物群落的影响大于高磷土壤。低磷土壤添加外源碳引起土壤磷库发生较大波动,提高微生物群落物种丰富度,增加群落物种组成差异,尤其富集了一类已知的溶磷菌属Paraburkholderia,因而提升磷有效性的效果更好。
