稀土元素对L-酪氨酸发酵的影响研究
2023-12-25王硕时唐恩赵春光徐庆阳
王硕 时唐恩 赵春光 徐庆阳

摘要:目前工业上主要采取微生物发酵法生产L-酪氨酸,此工艺存在生产周期长、糖酸转化率低等问题。因此,该研究以发酵过程中菌体量、L-酪氨酸产量、糖酸转换率以及耗糖速率为指标,通过单因素实验和正交实验探究La3+、Ce3+、Nd3+对L-酪氨酸发酵的影响并最终确定了稀土元素的添加组合,提高了菌体的活力,缩短了延滞期,延长了产酸高峰期。实验结果表明,向L-酪氨酸发酵培养基中添加80 mg/L La3+、2 mg/L Ce3+、0.3 mg/L Nd3+对发酵有利。发酵耗时35 h,缩短了2.2%;最高菌体量达到80.3,提升了10.8%;产酸量达到55.7 g/L,提升了9.7%;糖酸转化率为23.4%,提升了6.4%。验证了添加稀土元素的可行性,为L-酪氨酸大规模工业化生产提供了依据。
关键词:大肠杆菌;L-酪氨酸;稀土元素;耗糖速率
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2023)12-0001-06
Study on Effect of Rare Earth Elements on Fermentation of L-Tyrosine
WANG Shuo1, SHI Tang-en1, ZHAO Chun-guang2, XU Qing-yang1,3,4*
(1.College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China;
2.Ningxia Eppen Biotech Co., Ltd., Yinchuan 750100, China; 3.National and Local
United Engineering Laboratory of Metabolic Control Fermentation Technology,
Tianjin 300457, China; 4.Tianjin Engineering Laboratory of Efficient and
Green Amino Acid Manufacturing, Tianjin 300457, China)
Abstract: At present, microbial fermentation method is the main method to produce L-tyrosine in industry, which has problems such as long production cycle and low sugar-acid conversion rate. Therefore, in this study, with the bacterial biomass, L-tyrosine yield, sugar-acid conversion rate and sugar consumption rate in the fermentation process as the indexes, the effects of La3+, Ce3+ and Nd3+ on the fermentation of L-tyrosine is explored through single factor experiment and orthogonal experiment. Finally, the addition combination of rare earth elements is determined, which has improved the bacterial vitality, shortened the lag period and extended the peak period of acid production. The results show that adding 80 mg/L La3+, 2 mg/L Ce3+ and 0.3 mg/L Nd3+ into L-tyrosine fermentation medium is beneficial to fermentation. Fermentation time is 35 h, which is shortened by 2.2%. The maximum bacterial biomass reaches 80.3, increasing by 10.8%. Acid yield reaches 55.7 g/L, increasing by 9.7%. The sugar-acid conversion rate is 23.4%, increasing by 6.4%. The feasibility of adding rare earth elements is verified, which has provided a basis for large-scale industrial production of L-tyrosine.
Key words: Escherichia coli; L-tyrosine; rare earth element; sugar consumption rate
L-酪氨酸是一种对人体起着重要作用的芳香族氨基酸[1],属于三大芳香族氨基酸之一,广泛应用于化工、食品、医药、饲料等行业[2]。L-酪氨酸有助于加快新陈代谢,刺激人体神经系统,辅助治疗慢性疾病。除此之外,L-酪氨酸可以作為一种重要的大脑化学物质来帮助调节人体的情绪、食欲以及人体对外界压力的应激反应等[3],L-酪氨酸还是多种医药化工产品的制备原料,在农业中作为肥料增加农作物的抗旱性,在化妆品行业中起到美白和调理皮肤的作用[4]。
稀土元素被发现于18世纪末,包括铜、钴、钦等17种元素,21世纪初有人开始对稀土元素的医学作用进行研究[5]。我国是首个将稀土元素应用于农业的国家,并取得了良好的效果。马文彬等[6]通过研究稀土在畜牧业养殖中的应用发现,稀土有促进动物分泌生长素的作用。除了动、植物外,早在20世纪末,有研究表明稀土元素对微生物的生长也起到一定的作用,王燕等[7]通过研究稀土元素对谷氨酸发酵及谷氨酸脱氢酶的作用,发现稀土元素能促进谷氨酸棒杆菌的生长和酶活力。也有报道表明,稀土配合物对黑曲霉、黄曲霉等真菌的生长有抑制作用。根据已有研究[8],少量稀土可以作为一种生理激活剂,起到激活生物体内生长因子的作用,有关稀土生物效应的研究越来越受到人们的关注。因此,探究稀土元素对大肠杆菌发酵生产L-酪氨酸的作用具有现实意义。
目前生产L-酪氨酸最主要的方法为微生物发酵法[9],该方法原材料廉价,且发酵成本低,原料易获得,反应所需能耗小,对环境污染很小。在合适的发酵条件下,菌株经过发酵可直接获得L-酪氨酸。大肠杆菌成为生产L-酪氨酸的主要微生物,主要是由于大肠杆菌具有生长速率快、易于培养的优点,是目前大规模工业化生产的理想菌株之一[10]。现已有众多科研人员开展了微生物发酵法生产L-酪氨酸的研究[11],但发酵技术仍然不成熟。针对发酵过程中生物量低、生产速率低、糖酸转化率低等问题,本研究以L-酪氨酸生产菌——大肠杆菌为供试菌株,探究稀土元素对该菌株的生长及其合成产物的影响,通过单因素实验和正交实验初步确定了稀土元素的最适添加量以及生产L-酪氨酸的最适培养基的组成成分。
因此,为了缓解L-酪氨酸发酵后期菌体活力下降的问题,本研究以La3+、Ce3+、Nd3+3种稀土元素为基础,探究稀土元素对L-酪氨酸发酵的影响,并优化其用量,为L-酪氨酸及其他芳香族氨基酸的低成本、高效率工业化生产提供了一定的依据。
1 材料与方法
1.1 菌种
L-酪氨酸生产菌:大肠杆菌TYR-05(PT7-aroGfbr+PT7-tyrAfbrtyrB+PxylF-T7RNAP+ApheLA),天津科技大学代谢工程研究室保藏。
1.2 培养基
1.2.1 种子培养基
葡萄糖25 g/L,酵母粉4 g/L,柠檬酸盐2 g/L,(NH4)2SO4·7H2O 2.5 g/L,KH2PO4·3H2O 3 g/L,MgSO4·7H2O 2 g/L,FeSO4·7H2O 5 mg/L,MnSO4·7H2O 1 mg/L,VH 0.5 mg/L,VB混0.5 mg/L,微量元素混合液1 mL/L。
1.2.2 发酵培养基
葡萄糖20 g/L,酵母粉4 g/L,(NH4)2SO4 3 g/L,KH2PO4·3H2O 1.5 g/L,柠檬酸盐1.8 g/L,蛋氨酸1 g/L,苯丙氨酸0.8 g/L,FeSO4·7H2O 30 mg/L,MnSO4·H2O 10 mg/L,VB混0.5 mg/L,微量元素混合液1.5 mL/L(除对稀土元素添加方式进行探究外,其他成分均相同)。
1.3 主要仪器
Biotech-JG/JGY/BG发酵罐 上海保兴生物设备工程有限公司;SBA-40ES生物传感分析仪 济南延和生物科技有限公司;BT-4电子天平 深圳博途科技有限公司;75UV分光光度计 上海菁华科技仪器有限公司;MiniSpin 离心机 德国Eppendorf 公司;Agilent 1200型高效液相色谱仪、ZW型色谱柱温箱 安捷伦科技(中国)有限公司;pH 计、Direct-Q3超纯水机 美国Mettler Toledo公司。
1.4 培养方法
1.4.1 菌种活化
从-80 ℃冰箱中取出菌株,在超净台中于酒精灯火焰旁用接种环取3环于试管斜面上,于32 ℃培养箱中培养12~14 h。
1.4.2 一级种子培养
待菌种活化好后,在超净台中于酒精灯火焰旁用接种环取3环于茄形瓶斜面培养基上,于32 ℃培养箱中过夜培养。
1.4.3 二级种子培养
待一级种子活化好后,用灭菌的细菌水洗菌株,在发酵罐补料口于酒精灯火焰旁倒入发酵罐中,于36 ℃、pH 7.0中性环境中培养。
1.4.4 发酵培养
当菌体量OD600 nm达到要求时,按相应要求的接种量放液,同时加入发酵培养基于发酵罐中,加入底糖,流加氨水来调节pH,使其维持在7.0~7.2,調节搅拌轴控制罐内溶氧,调节通风控制罐压,使罐压维持在0.04 MPa,发酵温度36 ℃,发酵周期35 h。
1.5 稀土元素添加控制发酵实验
在培养基成分和其他发酵条件不变的前提下,分别探究培养基中添加不同添加量的3种稀土元素对L-酪氨酸发酵的影响。
1.6 发酵检测方法
1.6.1 发酵过程中pH的测定
采用Hamilton pH电极实时检测,精密pH试纸辅助测定。
1.6.2 发酵过程中残糖的测定
于罐中取样,用离心机离心留上清液,将上清液稀释100倍,用SBA-40ES生物传感仪测定残糖含量。
1.6.3 发酵过程中菌体量的测定
每2 h于发酵罐中取样,吸取原样稀释相应倍数,用75UV分光光度计测定菌体量,菌体量可用吸光度OD600 nm表示,其计算方式为:
菌体量=OD600 nm×稀释倍数。
1.6.4 发酵过程中L-酪氨酸的测定
发酵开始,每2 h取样,发酵液用pH 10~12的NaOH溶液稀释一定倍数后,经0.45 μm膜过滤。高效液相色谱测定:层析柱:Phenomenex C18 110 (250 mm×4.6 mm,5 μm);流动相1 mL/min 10%的乙腈;温度30 ℃;检测波长230 nm;进样量20 μL。
2 结果与讨论
2.1 不同La3+添加量对L-酪氨酸发酵的影响
在5 L的发酵罐中进行不同La3+添加量的分批发酵,在发酵过程中每2 h测定菌体量(OD600 nm)、L-酪氨酸产量和最终的糖酸转化率,按照不同浓度配比设计单因素实验,稀土元素镧添加量分别为0,40,80,120,160 mg/L[12],从而确定最佳La3+添加量,通过测定发酵过程中L-酪氨酸产量、菌体量以及糖酸转化率,明确不同La3+添加量对菌体生长与产酸的影响,结果见图1。
由图1可知,随着La3+添加量的逐渐升高,菌体量和L-酪氨酸产量出现先升后降的趋势。结果表明,当培养基中不添加La3+时,菌体量为68.1,L-酪氨酸产量为51.8 g/L。当La3+添加量为80 mg/L时,菌体量和L-酪氨酸产量分别为75.1和55.7 g/L,相比于空白组,二者分别提高了9.7%和7.1%。La3+添加量在0~80 mg/L时与菌体量和L-酪氨酸产量呈正相关,此时La3+添加量的升高影响了大肠杆菌的代谢能力,增强了菌体本身对培养基中营养物质的吸收,使菌体生长速率加快,最终菌体量得到提高。此时La3+作为一种生理激活剂使代谢流更多地流向产物L-酪氨酸的合成,L-酪氨酸的产量也得到提高。当La3+添加量大于80 mg/L时,L-酪氨酸的产量逐渐下降,这是由于发酵液中的La3+添加量过多,对菌体产生毒害作用。La3+也会直接影响大肠杆菌细胞壁的肽聚糖结构[13],抑制产物合成,且这种抑制作用会随着La3+添加量的进一步提高而更加显著。因此,培养基中添加80 mg/L的La3+对L-酪氨酸发酵提升最大。
综合结果来看,一定浓度的稀土元素镧会促进菌体生长,而浓度过高反而会起到抑制作用,因此发酵时La3+的最适添加量为80 mg/L。
由表1可知,La3+添加量在80 mg/L时糖酸转化率最高,为23.4%,相比于空白组提高了8.5%,且不同La3+添加量所对应的耗糖量也是不同的,这是由于La3+添加量为80 mg/L时,La3+作为一种生理激活剂,起到激活生物体内生长因子的作用,增强菌体对培养基中无机氮源的吸收与利用,从而促进菌体生长[14],使菌体消耗的葡萄糖更多地用于代谢产物的合成。可以看出向培养基中添加La3+可以提高L-酪氨酸的生产效率,降低生产成本,从而实现大规模生产。所以,培养基中添加一定量的稀土元素镧对L-酪氨酸發酵有利。
2.2 不同Ce3+添加量对L-酪氨酸发酵的影响
分别向发酵培养基中添加0,2,4,6,8 mg/L的Ce3+,以菌体量、L-酪氨酸产量以及糖酸转化率为指标,探究不同Ce3+添加量对发酵的影响,结果见图2。
由图2可知,发酵结束时不添加Ce3+的菌体量为67.8,L-酪氨酸产量达到51.4 g/L;当Ce3+添加量为4 mg/L时为最佳添加量,菌体量和L-酪氨酸产量分别为69.3和54.6 g/L,相比于空白组分别提高了2.2%和5.9%。Ce3+添加量在0~4 mg/L时,随着Ce3+添加量的升高,菌体量和L-酪氨酸产量也随之增大。这是由于对数生长期的大肠杆菌细胞对Ce3+的敏感性较强,Ce3+可以增加大肠杆菌细胞膜的通透性[15],而且通透性增加的程度会随着Ce3+添加量的增加而加剧。当Ce3+添加量大于4 mg/L时,菌体量和L-酪氨酸产量也随之下降,这是因为Ce3+同时参与了阻碍细胞生理代谢相关的酶促反应,对菌体本身产生毒害作用,加速菌体的衰亡[15]。
在Ce3+添加量为4 mg/L时,L-酪氨酸产量高于传统发酵方法,细胞膜通透性的增加会提高产物外排的能力,解除产物对关键酶的反馈抑制,L-酪氨酸得以积累。因此,在培养基中添加适量的Ce3+会增强菌株的产酸能力,进而提高发酵的糖酸转化率。
由表2可知,没有添加Ce3+的培养基糖酸转化率仅为20.3%,而添加了Ce3+的实验组表现较好,菌株达到了最佳的生长状态,糖酸转化率达到了22.9%,相对于空白组提升了11.4%,且在0~4 mg/L时糖酸转化率随着Ce3+添加量的升高而升高。
2.3 不同Nd3+添加量对L-酪氨酸发酵的影响
通过单因素实验,在发酵中后期分别选择0,0.3,0.6,0.9,1.2 mg/L的Nd3+进行L-酪氨酸发酵实验,测定发酵结束后的菌体量、L-酪氨酸产量和糖酸转化率,通过对比确定最适的Nd3+添加量,结果见图3。
由图3可知,空白组即不添加Nd3+的菌体量为73.4,L-酪氨酸产量为52.1 g/L;Nd3+添加量为0.6 mg/L时,菌体量和L-酪氨酸产量均达到最大,分别为75.1和54.3 g/L,相比于空白组分别提升了2.3%和4.1%。添加Nd3+后,菌体量和L-酪氨酸产量随着Nd3+添加量的增加而增大,Nd3+能够延长菌体的稳定期,提高菌体的活力,降低发酵后期菌体裂解的风险,同时能够促进辅酶Q及细胞DNA和RNA的生物合成,并能调节细菌对维生素等生长因子的吸收与消耗,从而促进细菌的增殖[16]。而过多的Nd3+会与细菌DNA发生作用,使DNA断裂,使其不能完成基本的代谢活性,菌体活力下降,降低L-酪氨酸的产量[17]。因此,选择0.6 mg/L Nd3+为最适添加量。
由表3可知,Nd3+添加量为0.6 mg/L时糖酸转化率最大,为22.5%,相比于不添加Nd3+提高了6.2%。随着Nd3+添加量的增加,细胞膜的物质运输得以加强,细菌对营养物质的吸收能力增强,糖酸转化率也随之增加。
2.4 正交实验优化
通过上述单因素实验,本研究确定了La3+、Ce3+、Nd3+的最佳添加量分别为80,4,0.6 mg/L。采用菌体量和L-酪氨酸产量为考核指标,以L9(34)为正交实验表设计三因素三水平正交实验(见表4),A为La3+添加量,B为Ce3+添加量,C为Nd3+添加量,探究发酵中的菌体量和L-酪氨酸产量情况。菌体量正交实验结果见表5,方差分析见表6;L-酪氨酸产量正交实验结果见表7,方差分析见表8。
结合菌体量的正交实验结果和极差(R)分析可知,3种因素对于菌体量而言,影响顺序为A>B>C,即La3+>Ce3+>Nd3+,通过比较3个因素的均值大小,即最大均值对应最佳添加量,得到最佳添加组合为A2B1C1,即La3+最佳添加量为80 mg/L,Ce3+最佳添加量为2 mg/L,Nd3+最佳添加量为0.3 mg/L。
综合产量的正交实验结果和极差(R)分析可知,3种因素对于产量而言,影响顺序为C>A>B,即Nd3+>La3+>Ce3+;由均值结果可知,最佳添加量组合为A2B2C3,即La3+添加量为80 mg/L,Ce3+添加量为4 mg/L,Nd3+添加量为0.9 mg/L。
本研究通过对菌体量和L-酪氨酸产量的正交实验结果分析可知,La3+和Ce3+添加量对发酵菌体量和L-酪氨酸产量均有极显著影响,而Nd3+添加量仅对菌体量有显著影响,为了达到既保证菌体量又促进L-酪氨酸生产的目的,选择La3+添加量80 mg/L、Ce3+添加量2 mg/L、Nd3+添加量0.3 mg/L为稀土元素的最佳添加量。
2.5 最适稀土元素添加量与常规发酵的对比验证
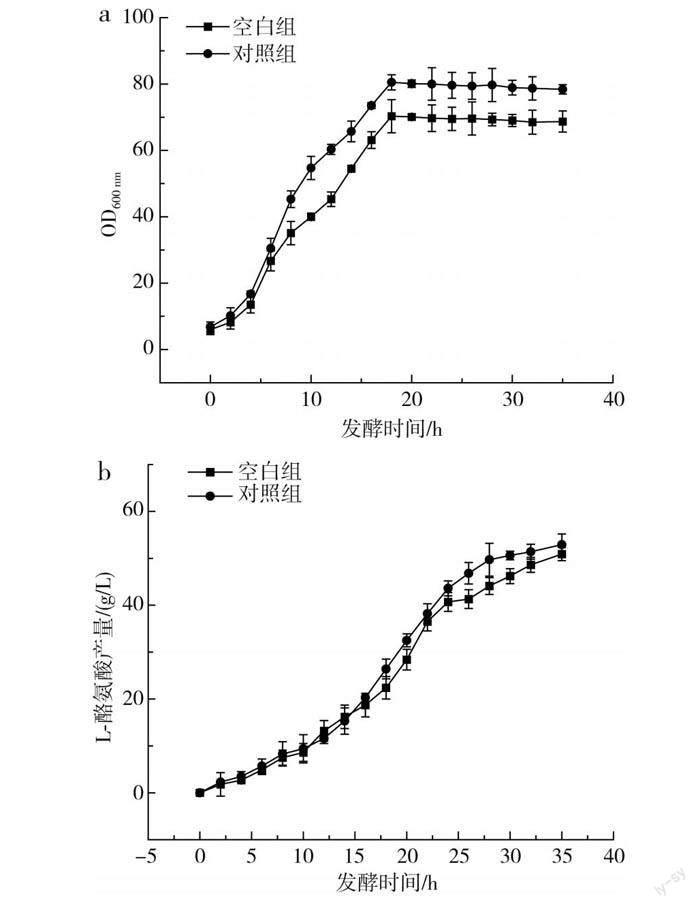
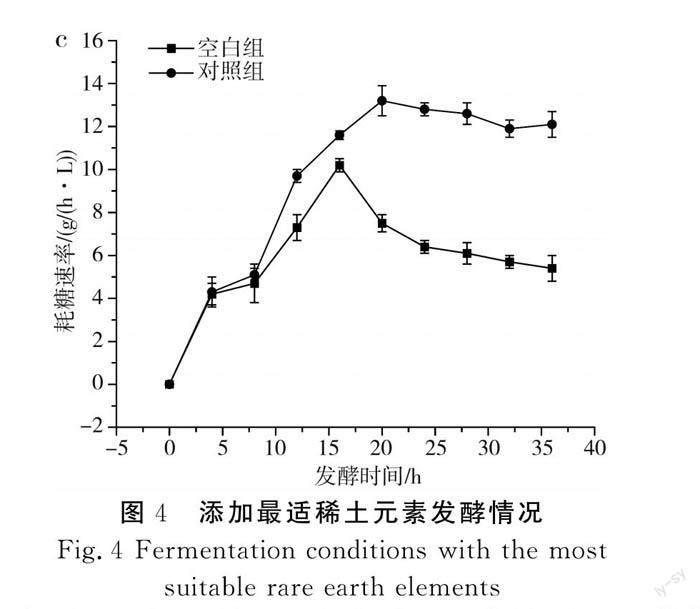
传统的L-酪氨酸发酵过程中,发酵中期L-酪氨酸的产酸速率达到最大,但持续时间较短,发酵后期随着时间的延长,L-酪氨酸的产酸速率出现快速下降的趋势,分析原因可能是发酵后期菌体逐渐衰亡,对培养基中营养物质的吸收能力减弱。本研究通过单因素实验确定了3种不同稀土元素的最优添加量,并通过正交实验得到了最佳添加量组合,为了验证实验的可行性,在其他培养基条件一致的情况下,以不添加稀土元素的培养基作为对照组,以La3+、Ce3+、Nd3+分别添加80,2,0.3 mg/L为实验组,进一步探究稀土元素及添加量的优化效果,结果见图4。
由图4可知,添加了最适稀土元素的对照组菌体量、产量和耗糖速率均大于空白组,其中对照组菌体量和产量分别达到75.6和52.9 g/L,相对于空白组提高了8.1%和3.8%;对照组在20 h时耗糖速率最大,为13.2 g/(h·L),而空白组最大耗糖速率出现在16 h时,为10.2 g/(h·L)。在对照组的发酵过程中,菌体生长旺盛,菌体活力高,耗糖速率大,产酸多,因此糖酸转化率高于空白组。由此可见,稀土元素的添加提高了菌体本身对葡萄糖的利用率,解决了L-酪氨酸发酵后期菌体活力不足、对营养物质吸收能力弱的问题,为L-酪氨酸大规模生产提供了有利的依据。
2.6 不同稀土元素添加方式对L-酪氨酸发酵的影响
根据上述2.4正交实验结果得出稀土元素添加量的最佳组合为La3+添加量80 mg/L、Ce3+添加量2 mg/L、Nd3+添加量0.3 mg/L。根据文献[17]报道,发酵过程一次性补加稀土元素会对菌体产生抑制,为了解决这一问题,本实验采用表9中3种发酵方式进行L-酪氨酸生产,并对其发酵过程进行监测,结果见图5。
由图5可知,采用传统发酵方式生产L-酪氨酸时,最大菌体量为71.6,L-酪氨酸产量为50.3 g/L。采用一次性补加发酵方式的最大菌体量为76.5,L-酪氨酸产量为53.2 g/L,相比于传统发酵分别提高了6.4%和5.5%。采用流加发酵方式的最大菌体量为80.3,L-酪氨酸产量为55.7 g/L,相比于传统发酵分别提高了10.8%和9.7%。可能是在向发酵底物中加入稀土元素后,稀土元素能够改变细胞膜的通透性,增強了细胞主动运输或被动扩散的能力,加快了菌体对营养物质的吸收,提高了菌体自身的活力,加快了菌体生长,从而提高了L-酪氨酸的产酸速率和产酸量,但一次性补加稀土元素会在发酵初期菌体量较少时对菌体产生一定的抑制作用,延长菌体的延滞期,从而降低菌体的生长速率[18]。
由上述结果可知,采用流加稀土元素发酵的方式对L-酪氨酸发酵起到了促进作用,分析原因为加强了大肠杆菌的磷酸葡萄糖转移酶系统,使菌体对葡萄糖的摄取能力提高;同时磷酸烯醇式丙酮酸合成酶是L-酪氨酸中心代谢途径的关键酶[19],而稀土元素作为一种生理激活剂增加了此酶的活性,使葡萄糖更多地流向产物,从而促进了L-酪氨酸产量的提高。
3 结论
在大肠杆菌发酵法产L-酪氨酸的研究中,其产酸量与糖酸转化率是大规模生产需要控制的重要指标,本研究通过单因素实验分别确定了最佳La3+添加量为80 mg/L,最佳Ce3+添加量为4 mg/L,最佳Nd3+添加量为0.6 mg/L;通过正交实验得出3种不同稀土元素的最佳组合为La3+80 mg/L、Ce3+2 mg/L、Nd3+0.3 mg/L;最终对稀土元素的添加方式进行优化,发现采用流加补料对提升L-酪氨酸发酵的菌体量、产酸量、糖酸转化率影响最显著,且采用发酵各项指标均达到最优。在此条件下,最大菌体量为80.3,与传统发酵方式相比提高了10.8%;产酸量达到55.7 g/L,相比传统发酵方式提高了9.7%;糖酸转化率提高至23.4%。大肠杆菌发酵过程中容易被环境以及营养条件所影响,本研究通过实验得知La3+能增强菌体对营养物质的摄取能力;Ce3+能增加细胞膜的通透性;Nd3+能延长菌体的稳定期,提高菌体的活力。通过调整发酵培养基成分,添加一定浓度的稀土元素,从而提高其产酸能力,对于大规模生产L-酪氨酸具有一定的参考价值。
参考文献:
[1]BONGAERTS J, KRANER M, MULLER U, et al. Metabolic engineering for microbial production of aromatic amino acids and derived compounds[J].Engineering,2001,3(4):289-300.
[2]LUTKE-EVERSLOH T, STEPHANOPOULOS T G. L-tyrosine production by deregulated strains of Escherichia coli[J].Applied Microbioly Biotechnology,2007,75(1):103-105.
[3]李国华,熊海波,陈宁,等.木糖对L-酪氨酸发酵的影响[J].中国调味品,2020,45(8):6-9,15.
[4]李国华.L-酪氨酸的发酵过程控制和提取工艺研究[D].天津:天津科技大学,2021.
[5]阮南,阮北,侯建革,等.稀土元素在谷氨酸发酵中的应用研究[J].中国稀土学报,2005(3):382-384.
[6]马文彬,尹昕,朱秀雄,等.氯化钐对雌性大白鼠内分泌腺结构和功能的影响[J].中国稀土学报,1990(2):162-165.
[7]王燕,杨平平,宋香,等.稀土元素对谷氨酸发酵产酸及其谷氨酸脱氢酶的影响[J].食品与发酵工业,2004(9):33-36.
[8]纪云晶,栗建林.我国稀土某些生物学效应的研究概况[J].卫生毒理学杂志,2000(1):23-28.
[9]肖国安,王先兵,焦庆才,等.L-酪氨酸酶法转化制备方法:中国,CN103224972A[P].2013-07-31.
[10]王钦.代谢工程改造大肠杆菌积累L-酪氨酸与发酵条件优化[D].无锡:江南大学,2019.
[11]姚元锋,赵广荣.L-酪氨酸代谢工程研究进展[J].食品与发酵工业,2013,39(5):132-137.
[12]张颖.稀土元素镧对Corynebacterium pekinense发酵赖氨酸的影响[J].安徽农业科学,2012,40(10):5741-5742,5810.
[13]柴瑞娟,李露,王玉良.La和Ce对两种细菌抗性的影响及其细胞壁的红外光谱分析[J].稀土,2014,35(5):50-54.
[14]阮南,安家彦.稀土元素对柠檬酸发酵的影响[J].河北化工,2010,33(5):2-4.
[15]陈爱美,施庆珊,冯劲,等.Ce3+誘导大肠杆菌细胞膜通透性增加[C]//第八届中国抗菌产业发展大会论文集,全国卫生产业企业管理协会抗菌产业分会,2012:149-153.
[16]袁素萍,高熙,米新宇,等.镝对大肠杆菌微量元素吸收行为影响研究[J].现代仪器与医疗,2019,25(3):10-14.
[17]汤中勋.稀土元素对栓菌产漆酶的影响及其酶的固定化[D].芜湖:安徽工程大学,2021.
[18]汪承润,陈华波,杨帆,等.稀土镧离子对大肠杆菌基因组DNA的影响[J].癌变·畸变·突变,2006(2):116-118.
[19]KIM S C, MIN B E, HWANG H G, et al. Pathway optimization by re-design of untranslated regions for L-tyrosine production in Escherichia coli[J].Scientific Reports,2015,5:13853.
收稿日期:2023-06-25
基金项目:宁夏回族自治区科技计划项目(2021BDE92007);山东省重点研发计划(2021ZDSYS10)
作者简介:王硕(1999—),男,硕士研究生,研究方向:代谢控制发酵。
*通信作者:徐庆阳(1980—),男,副研究员,博士,研究方向:代谢控制发酵。
