NO2 胁迫对三角梅幼苗生理特性的影响
2023-12-25蔡宇轩梁宇翔圣倩倩祝遵凌
宋 爽,蔡宇轩,梁宇翔,圣倩倩,祝遵凌
(南京林业大学 a. 风景园林学院;b. 南方现代林业协同创新中心;c. 金埔研究院;d. 数字化创新设计研究中心;e. 艺术设计学院,江苏 南京 210037)
氮氧化物(NOx)是近地面O3与二次颗粒物(PM10和PM2.5等)生成的最重要的共同前体物,在大气化学过程中可同时生成二次气溶胶与O3[1],其中NO2是大气中的主要氮氧化物[2],主要来源于机动车尾气、工业废气以及能源工厂的排放。随着我国城市现代化发展水平的不断提升,机动车尾气排放成为城市大气重要污染源之一[3]。我国环境空气质量标准规定,NO2年均浓度限值为40 μg/m3,24 h 平均浓度限值为80 μg/m3。《2021年中国生态环境状况公报》指出,2021 年339 个城市NO2年均浓度为23 μg/m3(达到国家一级标准),与2020 年相比下降4.2%。但仍存在以NO2为首要污染物超标现象,其中长三角地区大气污染物平均超标(空气质量指数>100)天数比例为13.3%,NO2超标天数占总超标天数的1.7%,对城市生态环境和人体健康造成影响。
园林植物是城市生态环境的重要组成部分,植物叶片是吸收大气污染物、进行光合作用的主要器官,研究表明,高浓度短时间(0 ~7 d)的污染气体处理一般导致急性伤害,在植物对胁迫的应答初期便显现出色斑、褪绿、失水、叶脉畸形、干枯老化等症状[4]。如果污染物浓度高于植物的忍受阈值,就会对植物产生伤害。弹性的伤害是可逆的,但污染物长时间的压力可能会导致不可逆的损害[5]。低浓度长期(超过30 d)的污染气体处理通常导致慢性伤害,随着胁迫时间或程度的增加,植物表现出衰老加速、发育不良、矮化和产量降低等。上述处理均会出现不同程度的光合速率下降、活性氧产生、代谢酶活性改变、渗透物质积累等生理响应[6]。已有学者[7-9]较为系统地研究了NO2胁迫对园林植物形态特征、质膜过氧化及抗氧化系统、细胞膜结构、光合作用过程、叶绿素合成、气孔动态、氮素积累及氮代谢酶活性的影响。目前研究表明,低浓度大气NO2(0.10 ~1.00 μL·L-1)能够调节植物的营养生长和生殖生长,不但可以通过控制细胞的增殖来促进植物的生长,还可以通过细胞的增大提高植物生物量[2,10]。
三角梅Bougainvilleaglabra为紫茉莉科Nyctaginaceae 叶子花属Bougainvillea藤状灌木,在海南、贵州、福建、云南、广东、广西、重庆等省市区,三角梅累计种植面积超过9.3×104hm2,从业人员超过7.3 万,年产值已达84 亿元,是中国华南地区生产栽培和景观应用规模最大的园艺植物之一[11],被广泛应用于城市道路绿化、园林绿化及庭院绿化。但关于三角梅对大气污染物的响应机理系统性研究尚未见报道,在实验室控制条件下探究三角梅对不同浓度NO2的响应差异的研究更少之又少。因此本研究通过开展人工熏气试验,研究不同浓度梯度NO2对三角梅生理生化过程的影响效益。在城市大气污染环境下,以期为发挥园林植物的生态效益提供理论依据。
1 材料与方法
1.1 试验材料
试验场地为南京林业大学国家园林实验中心。本实验选用长势基本相同,健壮、无病虫害的三角梅2 ~3 年生嫁接苗,移入实验中心进行基质栽培。栽培基质的配比为红壤土∶营养土=1∶1,其中营养土包括55%草炭土、30%珍珠岩、10%稻壳及5%黄土,用规格为上径口(17 cm)×下径口(15 cm)×高(17 cm)塑料花盆盆栽,盆底有排水孔并置于托盘中,每盆装500 g 干土,每盆1 株。常规管理培养2 个月后,将植物的花盆及盆土用保鲜膜密封包缠处理置于空白熏气装置中,进行适应性培养2 周,准备进行NO2胁迫试验。
1.2 试验设计
1.2.1 装置
采用本课题团队自主研发的远程实时监测NO2浓度的熏气装置,如图1 所示,包括熏气箱、气体发生模块、气体浓度检测模块及云平台数据处理中心。熏气箱体由无机玻璃制作,规格为长1.2 m×宽0.8 m×高1.2 m,气瓶的进气端连接带有减压阀的微量气体电磁阀及其控制器,以控制气体的进入与停止,可通过手机小程序实时查看NO2的浓度变化来监测NO2动态变化,提高人工控制NO2气体浓度的精确度。

图1 NO2 熏气装置及工作流程Fig. 1 NO2 fumigation device and work flow
1.2.2 植物处理
试验共设置4 个处理:CK(空白对照组,0 μL·L-1)、T1(1 μL·L-1)、T2(4 μL·L-1)、T3(8 μL·L-1),每处理组6 盆,共24 盆。于2022年4月30日—5月2日进行熏气试验,持续熏气3 d,每日熏气8 h(9:00—17:00)。熏气室环境为光照时间13 h,光照强度26 000 ~29 000 lx,环境温度25 ~28 ℃,空气相对湿度60%~70%,大气压力99.3 ~99.5 kPa。于每日熏气结束后进行相关指标测定。
1.3 指标测定
在NO2胁迫第1 ~3 天,分别在每个处理中随机选取3 盆,于当天熏气结束后采集中上部(从顶端数第5 至第7 片)阳生叶片,装入贴有标签的密封袋中,用于后续生理指标测定。
1.3.1 叶色测定
参照苏金[12]的方法,每日上午8:30 将植株摆放在同一位置,用分光测色仪在同一叶片分别采集3 次,计算平均值。取色统一在背阴但光线良好的环境下进行。
1.3.2 水分生理指标测定
参照李合生[13]的方法,测定相对含水量(RWC)和水分饱和亏缺(WSD)。
1.3.3 逆境生理指标测定
每个处理随机选取9 片成熟叶片,采用硫代巴比妥酸(TBA)显色法测定MDA 含量;脯氨酸(Pro)含量参照李合生[13]的磺基水杨酸提取法测定;可溶性蛋白(SP)含量采用考马斯亮蓝G-250 比色法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定;还原型抗坏血酸(AsA)含量采用二联吡啶法测定。以上指标均以叶片鲜质量计算。
1.3.4 光合生理指标测定
参照李合生[13]的95%乙醇浸提法测定叶绿素a、叶绿素b 及类胡萝卜素的含量。
1.4 数据分析
利用SPSS 25.0 和Origin 2021 软件,比较三角梅对不同处理时间及处理浓度的响应时采用双因素方差分析(Two-way ANOVA),比较各生理生长指标在不同NO2处理下的差异时采用单因素方差分析(One-way ANOVA),组间比较采用Tukey 法;各指标相关性采用Pearson 相关性分析;采用主成分分析(PCA)探究NO2胁迫下三角梅的生理响应特征。数据以均数±标准误表示。
2 结果与分析
2.1 三角梅幼苗对不同处理时间及处理浓度的响应
双因素方差分析可知(表1),处理时间及其和处理浓度的交互作用对三角梅幼苗的影响显著(P<0.05),其中处理时间达到极显著水平(P<0.01),但处理浓度对三角梅幼苗的影响不显著,可见三角梅能耐受短期高浓度NO2胁迫。

表1 处理时间及NO2 处理浓度的双因素方差分析Table 1 Two-factor variance analysis of treatment time and NO2 treatment concentration
2.2 NO2 胁迫对三角梅叶色的影响
胁迫第1 天,T2 的A 值与同期CK 相比有所增加。胁迫第2 天,各处理组的A 值与同期CK相比有所增加。胁迫第3 天,除T2 外,各处理下的A 值与同期CK 相比有所下降。其中,L 代表亮度,a 代表从洋红色至绿色的范围,b 表示从黄色至蓝色的范围[14]。方差分析结果表明(表2),各处理间的叶片L 值和B 值无显著差异,NO2胁迫对三角梅叶片Lab 值无显著影响。

表2 不同NO2 处理下三角梅叶片Lab 的变化†Table 2 Changes of Lab in B. glabra leaves under different NO2 treatments
2.3 NO2 胁迫对三角梅叶片含水量的影响
如表3 所示,T1 和T2 的相对含水量(RWC)变化趋势一致,与CK 相比均呈先增加后降低,其中在胁迫第2 天,T1 和T2 的RWC 与CK 相比分别增加了7.04%和9.15%。随着胁迫时间延长,与CK相比,T3 处理下的RWC 逐渐升高,而水分饱和亏缺(WSD)均呈现相反的变化趋势。方差分析结果表明,NO2胁迫对三角梅叶片含水量影响不显著。
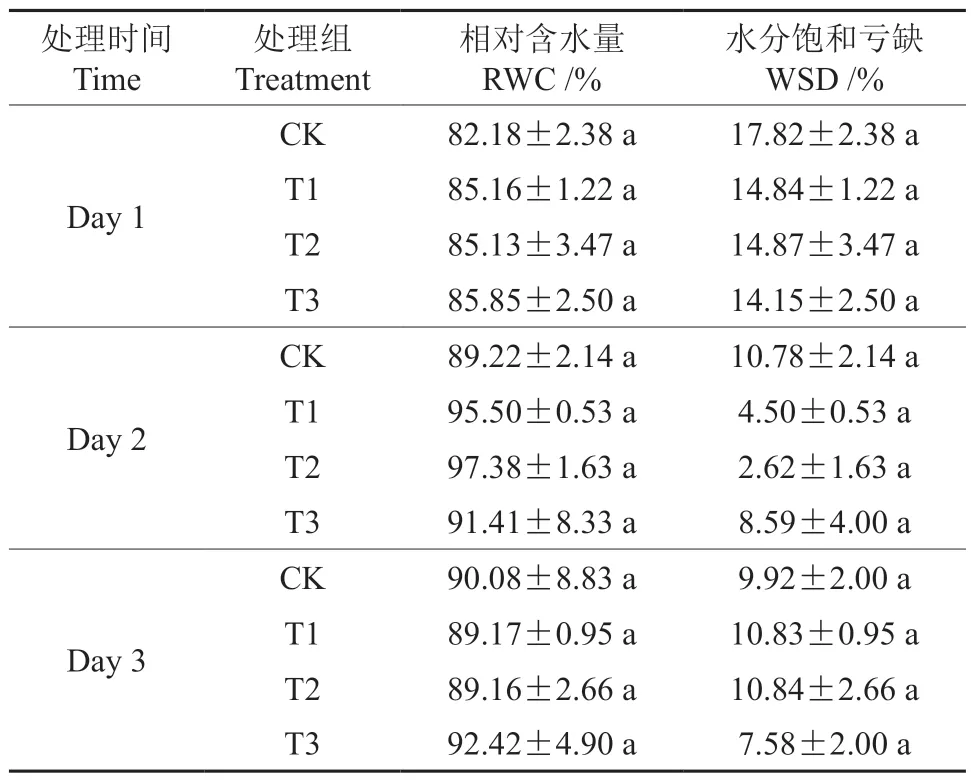
表3 不同NO2 处理下三角梅叶片含水量的变化Table 3 Changes of water content in B. glabra leaves under different NO2 treatments
2.4 NO2 胁迫对三角梅丙二醛含量的影响
如图2 所示,胁迫第1 天,T1、T2 和T3 处理下的MDA 含量均低于同期CK,分别下降了15.93%、6.70%、14.95%。胁迫第2 天,T1、T2和T3 处理下的MDA 含量均高于同期CK,分别上升了72.30%、99.84%、75.29%。胁迫第3 天,各处理组的MDA 含量相比同期CK 有所增加。各处理组在胁迫期间MDA 含量与CK 相比整体呈现下降的趋势。方差分析结果表明,T1、T2 和T3组间差异不显著。
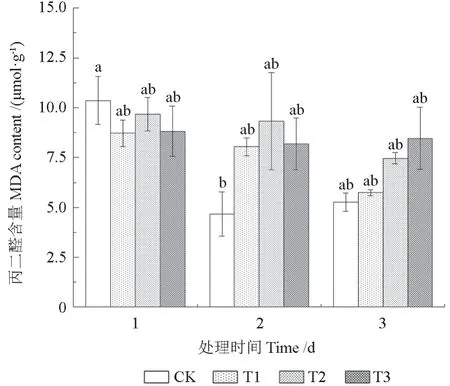
图2 不同NO2 处理下三角梅MDA 含量的变化Fig. 2 Changes of MDA content in B. glabra under different NO2 treatments
2.5 NO2 胁迫对三角梅脯氨酸含量的影响
如表4 所示,随着胁迫时间延长,T1 处理下的Pro 含量与CK 相比呈先降低后增加的趋势,T2 及T3 的Pro 含量变化趋势相同,均为先增加后降低,其中T2 相较CK 分别增加了20.15%、45.33%、30.95%,T3 相较CK 分 别增加了88.37%、77.25%、30.10%。方差分析结果表明,各处理组对三角梅Pro 含量的影响不显著。

表4 不同NO2 处理下三角梅脯氨酸含量的变化Table 4 Changes of proline content in B. glabra under different NO2 treatments
2.6 NO2 胁迫对三角梅可溶性蛋白含量的影响
如图3 所示,随着胁迫程度的增加,SP 含量总体呈现下降趋势,而在胁迫第1 天及第3 天,T1 处理下SP 含量相较同期的CK 分别增加了5.33%和6.06%。T2 及T3 处理下的SP 含量较同期的CK 均有所下降,其中T2 处理在胁迫第1 和第2 天时相较CK 分别降低了10.29%、22.91%,胁迫第3 天与CK 基本持平,T3 相较CK 分别下降了14.89%、19.49%、3.25%。方差分析结果表明,各处理组对三角梅SP 含量的影响不显著。

图3 不同NO2 处理下三角梅可溶性蛋白含量的变化Fig. 3 Changes of soluble protein content in B. glabra under different NO2 treatments
2.7 NO2 胁迫对三角梅超氧化物歧化酶活性的影响
如图4 所示,各处理组与CK 相比大致呈现下降趋势,但T1 处理下的SOD 活性在胁迫第1天相比CK 增加了5.37%。胁迫第2 天,各处理组的SOD 活性相较同期的CK 分别下降了14.40%、13.37%、9.10%。胁迫第3 天,T2 处理下的SOD活性相比同期CK 下降了10.09%,T1 和T3 处理下的SOD 活性与CK 基本持平。方差分析结果表明,各处理组对三角梅SOD 活性的影响不显著。
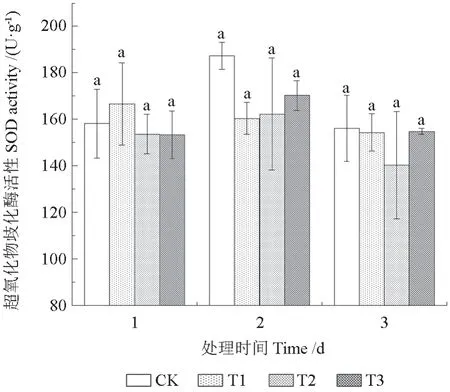
图4 不同NO2 处理下三角梅SOD 活性的变化Fig. 4 Changes of SOD activity in B. glabra under different NO2 treatments
2.8 NO2 胁迫对三角梅还原型抗坏血酸含量的影响
如图5 所示,随着胁迫时间的延长,T1 及T2的AsA 含量均呈现先增加后降低的趋势,T3 处理的AsA 含量逐渐增加。胁迫第1 天,各处理组的AsA 含量与CK 相比无明显变化。胁迫第2 天,各处理组与同期CK 相比分别下降了36.81%、28.12%、45.90%,其中T3 与CK、 T1、T2 处理间差异显著(P<0.05)。胁迫第3 天,T1 与T2 的AsA 含量相较CK 分别下降了12.37%、40.44%,T3 处理的AsA 含量相较CK 无明显变化。方差分析结果表明,胁迫期间各处理间差异不显著。

图5 不同NO2 处理下三角梅抗坏血酸含量的变化Fig. 5 Changes of ascorbic acid content in B. glabra under different NO2 treatments
2.9 NO2 胁迫对三角梅光合色素含量的影响
如图6 所示,在NO2胁迫期间,叶绿素a、叶绿素b 与类胡萝卜素含量的变化趋势基本相同。胁迫第1 天,各处理组的叶绿素a、叶绿素b 与类胡萝卜素含量与CK 相比有所升高,但差异不显著。胁迫第2 天,各处理组的叶绿素a、叶绿素b与类胡萝卜素含量与CK 相比均有所下降,其中T1 处理下的叶绿素a 及类胡萝卜素含量相比CK差异显著(P<0.05),T3 处理下的叶绿素a 含量相比CK 差异显著(P<0.05)。胁迫第3 天,T1 和T3 处理减少了三角梅的叶绿素a、b 含量,T2 处理下的叶绿素a、b 与CK 相比分别增加了13.79%、13.67%,并且T1 和T2 对三角梅幼苗类胡萝卜素的形成有一定的积极作用,与CK 相比分别增加了17.65%、29.48%。方差分析结果表明,胁迫期间各处理间差异不显著。
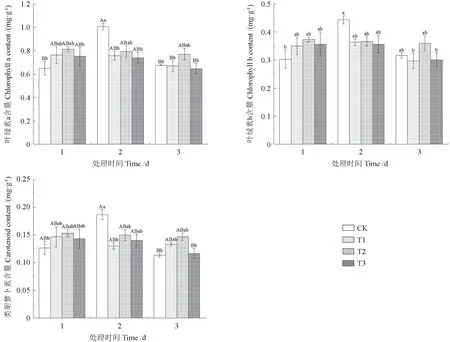
图6 不同NO2 处理下三角梅光合色素含量的变化Fig. 6 Changes of photosynthetic pigment content in B. glabra under different NO2 treatments
2.10 NO2 胁迫下三角梅各项生理指标间的相关性
对三角梅各项生理指标进行相关性分析可知(表5),各指标之间存在一定的相关性。RWC与WSD呈极显著负相关,前者与SP呈显著负相关,后者与SP 呈显著正相关。AsA 与MDA 呈极显著负相关,与叶绿素a 呈显著正相关。光合色素之间呈极显著正相关。其余指标相关性不显著。
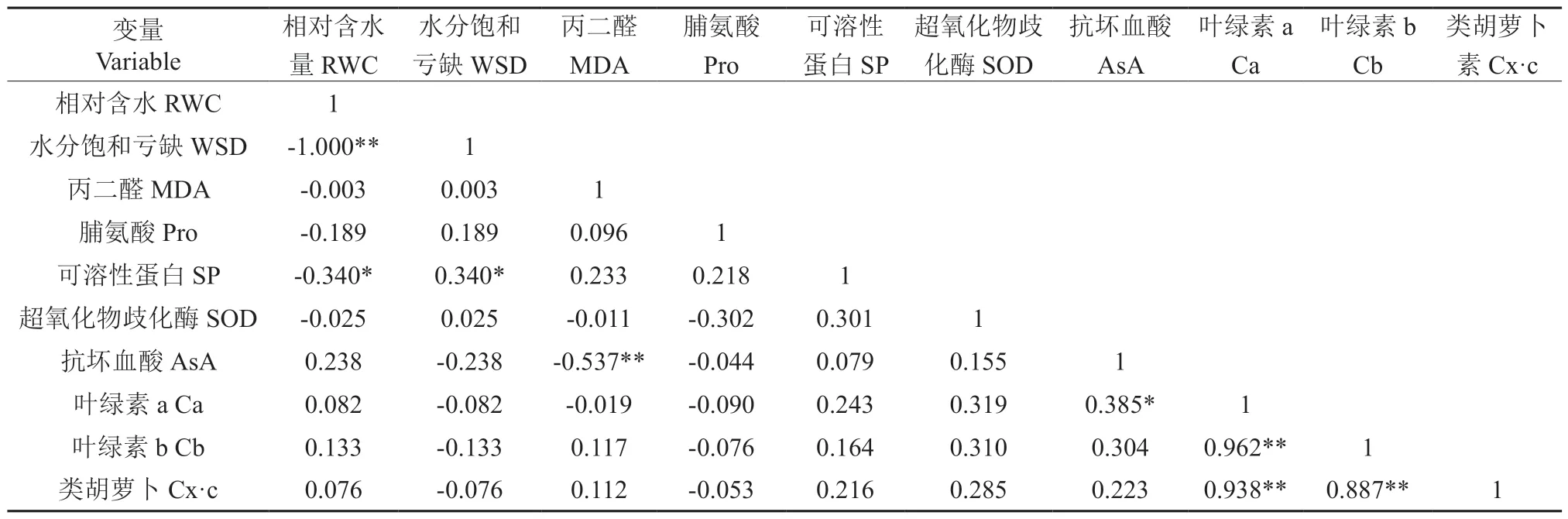
表5 各生理指标相关性分析†Table 5 Correlation analysis of each physiological index
2.11 主成分分析
由主成分分析图可知(图7),第一主成分的贡献率是32.8%,第二主成分的贡献率是22.7%,累计贡献率为55.5%。第一主成分与叶绿素a、叶绿素b、类胡萝卜素、SP、SOD、AsA 及RWC 正相关,且叶绿素a、叶绿素b、类胡萝卜素的变量系数较大,为正向主导变量,主要反映NO2胁迫下三角梅的光合能力。第二主成分与WSD、SP、Pro、SOD、MDA、叶绿素a、叶绿素b 及类胡萝卜素正相关,且WSD 及SP 的变量系数较大,为正向主导变量,主要反映NO2胁迫下三角梅的水分利用能力及渗透调节能力。
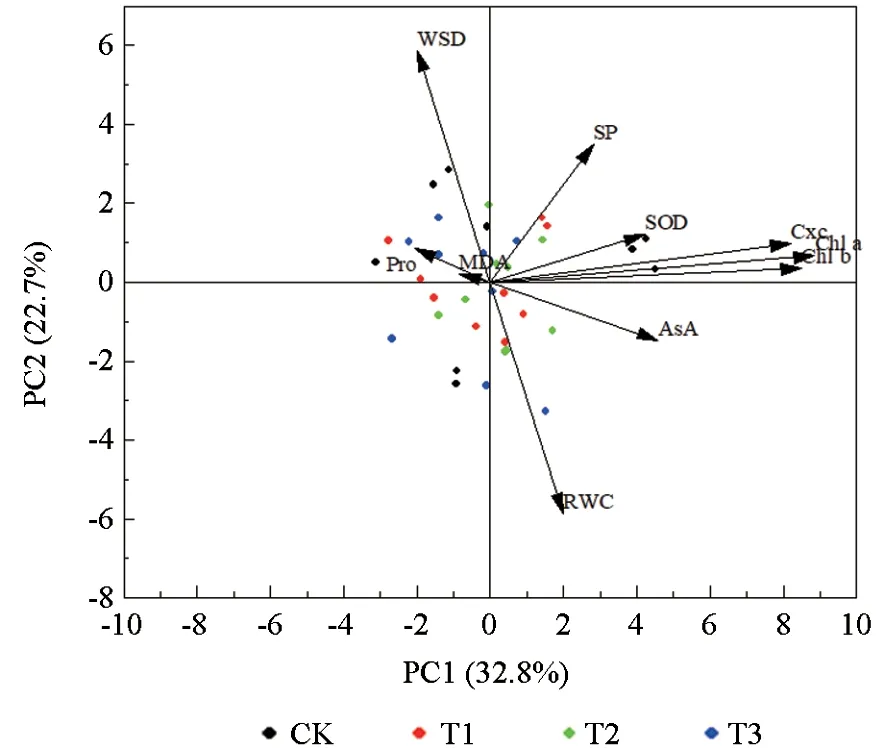
图7 不同NO2 处理下三角梅各指标的主成分分析图Fig. 7 Principal component analysis of B. glabra under different NO2 treatments
3 讨 论
3.1 NO2 对三角梅幼苗叶片颜色及光合色素的影响
植物长期暴露在大气污染的环境中,大气污染物首先对植物内在的生理组织结构(如细胞器、细胞膜、叶绿体等)产生不可见性伤害,当伤害达到一定程度后,才会在植株的外在形态结构上(如叶片、枝条、花、果等)表现出不同类型的可见性伤害症状[15]。植物(主要指叶片)受害症状与大气污染物的种类、质量浓度和接触时间有相关性,叶片伤害症状是反映植物对污染物敏感反应的直观指标[16]。NO2对植物的伤害症状一般呈水渍状,然后出现褪绿现象,也有部分树种出现各种色素斑(呈暗紫色、紫褐色棕褐色),或失绿与褐色相间成斑驳状[17]。目前已有众多学者结合高光谱[18]、可见光、热成像[19]等手段预测植物体内叶绿素含量,用于评估植物生长、健康状况、生产力、病虫害等。本研究发现,不同浓度NO2胁迫下,三角梅叶片的Lab 色度具有一定程度的变化,但对叶片颜色的影响不显著。表明三角梅对NO2(8 μL·L-1及以下)的耐受能力较强,短期胁迫不会显现出较大的形态差异。
叶绿素是植物进行光合作用最重要的一类色素,其含量可受多种逆境的胁迫而下降[20],其含量的变化往往与叶片的生理活性、植物对环境的适应性和抗逆性有关[21]。有研究表明,低浓度NO2短期胁迫(5 ~15 d)可增加叶绿素含量,从而导致光合当浓度超过伤害阈值叶绿素含量开始下降,不同植物的阈值不同,如豌豆NO2阈值为1 μL·L-1[22],而大豆为0.1 μL·L-1[23]。这可能是由于植物在遭受NO2胁迫时,通过增加自身的叶绿素含量提高光合作用的效率,从而为碳同化提供更充足的能量以耐受NO2胁迫,在超过自身能力承受范围后,较高浓度NO2胁迫会破坏叶片的保护层,光合色素合成受到抑制,使叶片光合色素含量降低[24]。本研究发现,三角梅叶绿素及类胡萝卜素含量随着胁迫程度的增加呈先上升后下降的趋势,其中4 μL·L-1NO2处理对三角梅光合色素含量的促进作用更明显,8 μL·L-1NO2在胁迫后期则对光合色素起到一定的抑制,表明三角梅在受到说明三角梅的耐受阈值在4 ~8 μL·L-1之间,与前人研究结果类似[7-8]。研究表明低浓度NO2可诱导PsbO 和PsbP 放氧增强蛋白发生硝化作用,蛋白质酪氨酸硝化改变了叶片细胞蛋白质的生理功能,从而促进植物生长,适当的光照可以催化硝化作用[25],因此NO2胁迫对三角梅光合能力与植物生长速率的影响及其二者之间的相互作用有待进一步探讨。此外有研究认为,在胁迫环境中,主要起辅助保护作用的叶绿素b 与对植物光合起主要作用的叶绿素a 相比更容易分解,以减少捕光色素蛋白复合体的含量,降低光系统对光能的捕获,使得叶绿素a/b 值升高,而部分研究则得出相反结论[7]。本研究中,三角梅的叶绿素a、b 含量变化基本趋于一致,可能是由于植物处于逆境时,其叶绿素含量的变化趋势与植物本身的抗逆性、光照条件、胁迫时间有关[26-27]。
3.2 NO2 对三角梅叶片含水量及渗透调节系统的影响
在大气污染胁迫条件下,细胞内溶物质(Pro、SP 等)发生主动积累,并引起细胞渗透势的下降促使植株吸收更多水分,维持一定的膨压,有助于维持细胞正常代谢提高植物的抗性。因此,渗透调节物质的含量与植物抗性密切相关[4]。其中Pro 作为细胞内部渗透调节剂和保护剂,在植物遭受外界空气污染胁迫时,能够稳定细胞膜系统并且降低膜脂过氧化,Pro 积累量越多,说明植物抗性越强[28]。本研究表明,随着胁迫程度的增加,胁迫初期三角梅Pro 含量总体呈先上升后下降的趋势;而SP 含量总体呈下降趋势,与前人研究成果类似[29]。叶片RWC 上升后下降,WSD 则相反,并且SP 含量与叶片RWC 呈显著负相关性(P<0.05),与WSD 则呈显著正相关(P<0.05)。这一结果可能是植物在可接受胁迫范围内做出的适应性反应,通过综合调节渗透调节物质来进行生长补偿效应[30],以维持植物体内渗透压平衡,体现了植物对环境变化的可塑性[31]。SP 含量逐渐降低与欧阳泽怡等[29]、王丽华等[32]的研究成果相似,原因可能是胁迫破坏了其本身的蛋白和逆境蛋白合成机制。叶片含水量由多种渗透调节物质调控,本研究主成分分析结果表明SP 为三角梅在NO2胁迫下渗透调节系统的主导因素。Takahashi等[25]利用15N 同位素发现植物体内的NO2-N 仅占总氮含量的5%,因此NO2更可能作为植物的信号分子而不是氮源调节植物的各项生理功能,目前已发现了多种信号分子,如NO、SO2、Ca2+等,NO2在增强渗透调节系统、抗氧化系统,驱动次生代谢,合成胁迫蛋白等方面的作用仍需进一步探究。
3.3 NO2 对三角梅ROS 自由基清除系统的影响
植物体在胁迫环境下会产生大量活性氧自由基(ROS),诱发一系列应激反应[33-34]。植物在长期进化过程中形成了相应的保护机制,主要分为酶促(超氧化物歧化酶SOD、过氧化物酶POD 和过氧化氢酶CAT)系统和非酶促(抗坏血酸AsA、谷胱甘肽还原酶GR)系统。SOD 作为植物抗氧化系统的第一道防线,催化超氧阴离子(O2.-)生成和 H2O2,在清除ROS 自由基、维持膜结构和功能完整性方面起着重要作用[35-36]。Teklemariam等[37]发现叶片AsA 含量较高的植物一般具有较强的NO2吸收能力,其中质外体AsA 含量可能是决定植物耐受能力的主要因素[38],当空气中NO2浓度较低时,AsA 还参与植物体内NO2转换为NO的代谢过程[2],可见AsA 水平在一定程度上可以反映植物吸收抵抗NO2的能力。丙二醛(MDA)是由活性氧积累诱发的脂质过氧化作用的最终产物,因此MDA 含量的变化可以反映细胞膜的氧化损伤程度[39],MDA 积累越多表明植物受伤害越严重[40]。本研究表明,AsA 与MDA 存在极显著负相关性(P<0.01),三角梅AsA 含量在高浓度NO2处理下呈现上升的趋势,MDA 含量与CK 相比整体呈现下降趋势,这与前人研究成果相似[7,41-42]。说明三角梅在NO2胁迫下可以维持植株体内较高水平的AsA 含量,保证了ASA-GSH 代谢途径的高效运行,从而抑制MDA 的积累,降低膜脂过氧化程度[43]。本研究中SOD 含量基本保持稳定,原因可能是三角梅已通过非酶促保护系统或其他的适应性应激机制或保护机制缓解了NO2对植株的氧化损伤,表明植物体内激活一个或以上ROS 清除系统就可以最大限度地减少植物体内的氧化胁迫程度[44]。然而Pellegrini 等[38]研究发现,AsA 虽是栎属植物抵御O3氧化损伤的第一道防线,AsA 自由基清除系统仍未缓解ROS 对细胞膜的不利影响。因此有关三角梅的不同自由基清除途径之间的关系有待进一步探究。
本研究由于试验材料及条件的限制,仅针对三角梅幼苗在NO2胁迫下的形态、光合及部分生理响应进行了研究,并且人工控制环境与实际道路环境差异较大。下一步将针对三角梅抵抗NO2胁迫的表达基因、代谢通路等进行研究,揭示其分子响应机制,并在实际道路绿地和实验室控制两种环境条件下,进行不同种园林植物对NO2污染物的响应差异研究,为城市道路绿地定向治理NO2污染提供理论依据。
4 结 论
高浓度短期NO2胁迫下三角梅基本可以维持正常生长,AsA 和光合色素含量在胁迫期间具有显著差异(P<0.05),其他生理性状差异不显著,其中RWC 与WSD 呈极显著负相关,并与SP 呈显著相关;AsA 与MDA 呈极显著负相关;光合色素之间呈极显著正相关。主成分分析表明三角梅可通过调控自身光合能力、水分利用能力及渗透调节能力等耐受短期高浓度NO2急性胁迫,其中叶绿素a、b 含量及类胡萝卜素含量可作为三角梅响应胁迫的主要指标,WSD 和SP 可作为胁迫响应的辅助指标。
