NAA+IBA 对圆齿野鸦椿插穗生根过程的影响
2023-12-25张博伦喻苏琴姜雪茹涂淑萍
张博伦,喻苏琴,姜雪茹,涂淑萍
(江西农业大学 林学院,江西 南昌 330045)
圆齿野鸦椿Euscaphiskonishii为省沽油科Staphyleaceae 野鸦椿属Euscaphis常绿小乔木,是我国特有药赏兼用优良乡土树种,其叶片、枝条等部位的提取物有消炎抑菌、抗肿瘤的作用[1]。该树种结果量大,果皮红艳、形态优美,且挂果期可长达6 个月以上,满树红果颇为壮观,是极具开发潜力的秋、冬、春三季观果树种。目前,该树种主要采用种子繁殖,因其种子具有深休眠特性[2],且发芽率低,实生苗性状良莠不齐,使其推广应用受到一定的影响。因此,大力推广无性繁殖,培育无性系优良品种势在必行。但该树种组培繁殖体系尚不健全,其污染率极高[3];嫁接繁殖技术繁杂,夏秋季嫁接成活率较低[4];而扦插繁殖具有操作简单、成苗速度快、繁殖系数高等特点[5]。有研究表明,从圆齿野鸦椿成年树上剪穗扦插成活率普遍较低[6],且其生根速度缓慢。因此,研究圆齿野鸦椿扦插过程中不定根的形成及其酶活性和内源激素含量的变化,初步掌握影响其插穗生根的机理,对提高圆齿野鸦椿的扦插繁殖效率具有重要意义。大量研究表明,在扦插生根进程中,插穗皮层内的过氧化物酶(POD)、多酚氧化酶(PPO)和吲哚乙酸氧化酶(IAAO)等3 种氧化酶活性,内源激素含量及其比例的动态变化共同调控着插穗不定根发生过程[7]。目前,已有学者对圆齿野鸦椿扦插生根的影响因素进行了研究,但对其扦插生根机理方面的研究甚少,尚未见其扦插生根进程中相关酶活性和内源激素含量变化的研究报道。本试验旨在研究NAA+IBA对圆齿野鸦椿插穗生根及其韧皮部3 种氧化酶(POD、PPO、IAAO)活性和4 种内源激素(IAA、ABA、GA3、ZR)的含量及其比例的动态变化的影响,分析上述氧化酶及内源激素与插穗生根之间的关系,以期为圆齿野鸦椿扦插繁殖提供理论依据。
1 材料与方法
1.1 试验地概况
试验地位于江西农业大学花卉盆景实训基地(115°50′28″E,28°45′41″N)。扦插池设在四周开敞的防雨棚内,棚高2.5 m,其上覆盖透光遮雨板,苗床为东西走向,长3 ~4 m,宽1 ~1.2 m,高40 cm,底部抬高1 m。扦插池底部铺厚10 cm 左右小石块便于排水,其上铺设基质进行扦插,苗床上搭有60 cm 高的拱棚并覆盖塑料薄膜和遮光度50%的遮阳网。
1.2 试验材料
选择5 年生、健壮、无严重病虫害的圆齿野鸦椿为采穗母树,于2022 年3 月8 日,剪取树冠中上部的一年生枝条,并将枝条制备为长10 ~12 cm的穗条,要求至少保留2 个芽和2 枚小叶。
生长调节剂选用课题组前期研究筛选出的对圆齿野鸦椿扦插生根效果最好的150 mg/LNAA+150 mg/LIBA 混合溶液。
1.3 试验方法
将剪好的插穗30 根一捆绑扎好,并分成两组分别进行处理。处理I:将插穗放入150 mg/L 的α-萘乙酸(NAA)与150 mg/L 吲哚乙酸(IBA)的溶液中浸泡2 h;处理II:将插穗放入清水中浸泡2 h 作为对照(CK)。每个处理90 根插穗,重复3 次。处理后的插穗插入粒径为3 ~6 mm 的蛭石中,扦插深度6 ~7 cm。
插穗处理结束后进行第一次取样,扦插后每隔15 d 取样1 次,共取样6 次。每次每个处理取插穗12 根,重复3 次。插穗取出后立即用蒸馏水冲洗干净,迅速观察记载插穗的形态变化及生根状况,并用滤纸擦干放入冰盒中带回实验室,用刀片剥取插穗基部长2 cm 内的皮层,剪碎混匀,用锡箔纸包好,放入液氮罐速冻后,置-80℃超低温冰箱保存备用。
1.3.1 插穗生根过程的形态观测
插穗插入基质后,每次取样后立即观察记录插穗的形态变化及生根状况。
1.3.2 插穗基部皮层内氧化酶活性及内源激素含量的测定
过氧化物酶(POD)活性采用愈创木酚法试剂盒进行测定;多酚氧化酶(PPO)活性采用邻苯二酚法试剂盒进行测定;吲哚乙酸氧化酶(IAAO)采用比色法试剂盒进行测定。以上试剂盒均由苏州科铭公司生产。
内源激素吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素(GA3)、玉米素核苷(ZR)含量由中国农业大学化控中心采用酶联免疫吸附法(ELISA)进行测定。
1.4 数据处理
利用Excel 2021 软件对试验数据进行整理,利用SPSS 19.0软件进行差异显著分析(Duncan法)和皮尔逊(Pearson)相关性分析,利用OriginPro 2021 软件进行图表制作。
2 结果与分析
2.1 NAA+IBA 处理对圆齿野鸦椿扦插生根进程的影响
对圆齿野鸦椿插穗生根过程的外部形态观察,发现圆齿野鸦椿插穗生根类型以愈伤组织生根型为主,亦存在少量皮部生根型和混合生根型。说明圆齿野鸦椿属于扦插生根较困难的树种。
由表1 与图1 可知,扦插后第15 天,处理I(150 mg/L NAA+150 mg/L IBA)插穗皮孔膨大,并形成凸起的颗粒状(图1A),且有13.8%的插穗在基部茎节附近出现白色絮状物(愈伤组织),而处理II(CK)插穗的愈伤组织形成率仍为0。扦插后第30 天时,插穗上形成的愈伤组织增多(图1B),处理I 愈伤组织形成率达69.4%,而处理II 的愈伤组织形成率仅为28.8%。扦插后第45 天,处理I 愈伤组织形成率达100%,且有2.7%的插穗出现不定根(图1C);而处理II 此时的愈伤组织形成率仅为44%。扦插后第60 天,处理I插穗生根率达72.2%,而处理II 愈伤组织形成率达100%,但生根率仍为0。扦插后第75 天时,处理I 插穗生根率已达100%,并出现二级根(图1D);而处理II 插穗生根率仅为51.4%。由此可见,圆齿野鸦椿插穗采用150 mg/LNAA+150 mg/LIBA混合液浸泡其基部2 h 后,可以促进插穗愈伤组织和不定根的形成,与对照相比愈伤组织形成时间可提早15 d 左右,而不定根的形成时间可提早30 d 左右。

图1 圆齿野鸦椿扦插生根过程中插穗的形态变化Fig. 1 Morphological characteristics changes in rooting process of E. konishii cuttings
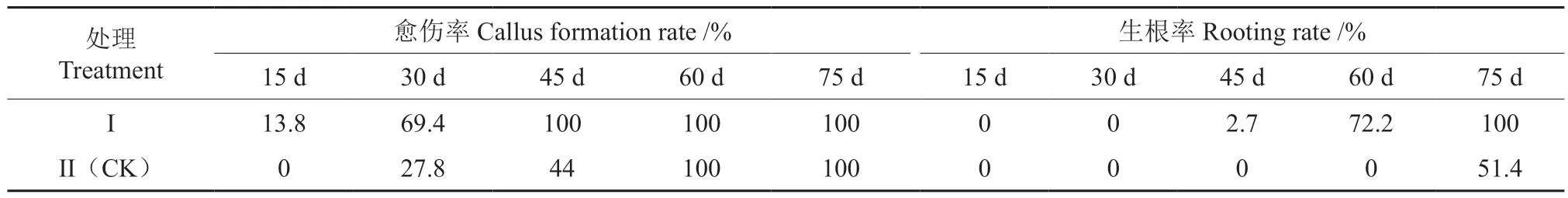
表1 不同处理圆齿野鸦椿插穗各取样时期愈伤组织形成率及生根率的比较Table 1 Comparison of callus formation rate and rooting rate of E. konishii cuttings by sampling period in different periods of different treatments
2.2 NAA+IBA 对圆齿野鸦椿扦插生根过程中插穗氧化酶活性变化的影响
由图2A—B 可知,扦插第0 天,处理I(150 mg/L NAA+150 mg/L IBA) 和处理II(CK) 相比,插穗POD 和PPO 活性显著升高。在扦插生根过程中,两个处理插穗POD、PPO 活性的变化趋势一致,均表现为“先升后降”,且扦插后0 ~30 d,插穗POD、PPO 活性处理I(150 mg/L NAA+150 mg/L IBA)均显著高于处理II(CK),处理I 于扦插后第15 天时达高峰值,而处理II 于45 d 时达高峰值。可见,提高插穗POD和PPO 活性可促进其愈伤组织及根原基的形成;而在不定根形成过程中,POD 和PPO 活性下降。

图2 不同处理圆齿野鸦椿扦插生根过程中插穗韧皮部3 种氧化酶活性的变化Fig. 2 Changes of three oxidase activity in phloem during cuttings rooting of E. konishii with different treatments
由图2C 可知,扦插第0 天,插穗IAAO 活性处理I 显著低于处理II,从扦插后15 ~60 d,处理I 和处理II 插穗IAAO 活性差异均不显著,此后,两个处理插穗IAAO 活性均显著下降,至扦插第75 天时,处理1 显著高于处理II。可见,插穗经150 mg/L NAA+150 mg/L IBA 处理后可显著降低其IAAO 活性,抑制IAA 的降解,维持插穗中较高的IAA 含量,从而促进愈伤组织和根原基的形成。
2.3 NAA+IBA 对圆齿野鸦椿扦插生根过程中插穗内源激素含量及其比值变化的影响
2.3.1 对生长素(IAA)含量变化的影响
由图3A 可知,在扦插第0 天,插穗IAA 含量处理I(150 mg/L NAA+150 mg/L IBA)为60.93 ng/g,显著高于处理II(CK)17.66 ng/g;而且在扦插生根过程中,IAA 含量处理I(150 mg/L NAA+150 mg/L IBA)均显著高于处理II(CK),其变化趋势表现为“先降后升”,但处理II(CK)IAA 含量的变化幅度小于处理I。说明圆齿野鸦椿插穗经生长调节剂处理后可显著提高其生长素(IAA)含量,从而促进愈伤组织和不定根的形成。
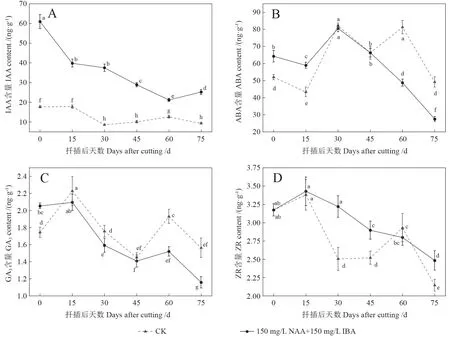
图3 不同处理圆齿野鸦椿扦插生根过程中内源激素含量变化Fig. 3 Change of endogenous hormone content in E. konishii cuttings during adventitious root formation with different treatments
2.3.2 对脱落酸(ABA)含量变化的影响
由图3B 可知,在扦插0 ~15 d,插穗脱落酸(ABA)含量处理I(150 mg/L NAA+150 mg/L IBA)均显著高于处理II(CK),可能是ABA 含量的升高能够增加插穗的抗性,降低切口感染带来的影响,有利于愈伤组织的形成。扦插后30 ~45 d,两个处理插穗ABA 含量相近,扦插第45 天后,处理II ABA 含量快速上升,至扦插后第60 天开始,ABA 含量处理II 显著高于处理I。说明ABA 含量的降低有助于圆齿野鸦椿插穗不定根的生长。
2.3.3 对赤霉素(GA3)含量变化的影响
由图3C 可知, 扦插后0 ~15 d, 处理I(150 mg/L NAA+150 mg/L IBA)插穗GA3含量变化不显著,而处理II(CK)插穗GA3含量显著增加。45 ~75 d,处理Ⅰ插穗GA3含量均显著低于处理Ⅱ,说明GA3含量的降低有利于不定根的伸长。在整个扦插生根进程中除扦插第0 天插穗GA3含量处理I(150 mg/L NAA+150 mg/L IBA)显著高于处理II(CK)之外,其他各个时期插穗GA3含量处理II 均高于处理I,这表明经过生长调节剂处理的插穗能提高体内GA3的含量,而在生根进程中降低插穗体内GA3含量,有利于促进插穗生根。
2.3.4 对玉米素核苷(ZR)含量变化的影响
由图3D 可知,扦插0 ~15 d,两个处理之间插穗ZR 含量相近,且变化均不显著。此后,处理II 插穗ZR 含量显著降低,从扦插第15 天后其含量除第60 天外,均显著低于处理I。
2.3.5 NAA+IBA 对圆齿野鸦椿扦插生根过程中插穗内源激素比值变化的影响
由图4可知,插穗中IAA/ABA、IAA/GA3和IAA/ZR 在整个扦插生根过程中处理I(150 mg/L NAA+150 mg/L IBA)均显著高于处理II(CK);且处理I(150 mg/L NAA+150 mg/L IBA)插穗IAA 与ABA、GA3、ZR 的比值均以扦插第0 天时为最高,除IAA/ABA 与扦插后第75 天相比差异不显著外,其他均达显著水平。可见,提高IAA 与ABA、GA3、ZR 的比值有利于促进插穗愈伤组织和不定根的形成和生长。
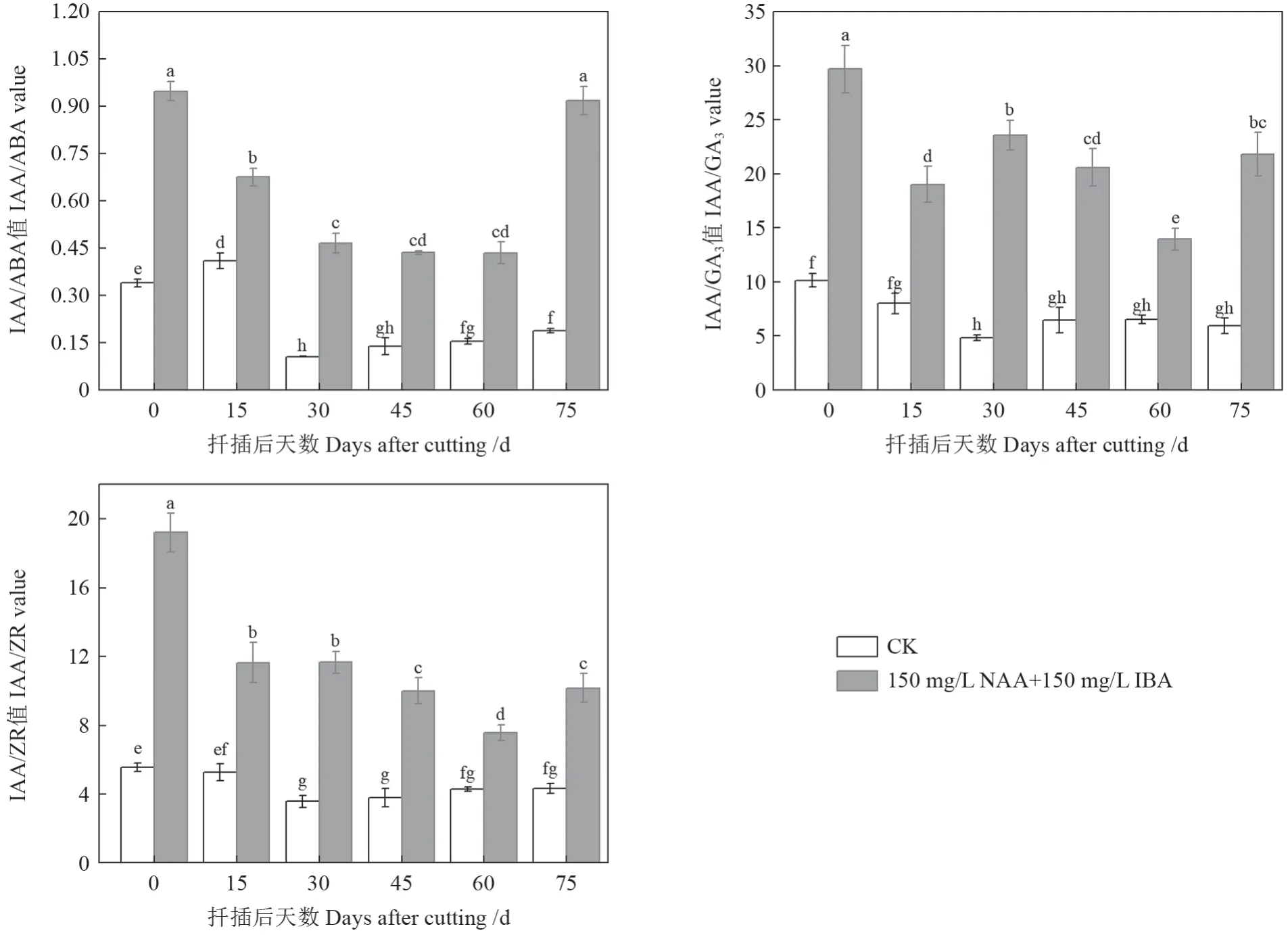
图4 圆齿野鸦椿扦插生根过程种内源激素含量比值变化Fig. 4 Change of endogenous hormone content ratio in E. konishii cuttings during adventitious root formation
2.4 圆齿野鸦椿插穗生根的生理生化指标主成分分析
对圆齿野鸦椿扦插生根过程中的7 个生理生化指标进行主成分分析,计算其特征值的方差贡献率和累计贡献率,并根据主成分的特征值大于1的原则提取主成分。共取得2 个主成分(表2),其对应方差贡献率分别为45.095%和32.050%,累计已达77.143%,基本包含了所测指标的全部信息。故本研究共取2 个主成分y1、y2,其余主成分可以忽略不计。2 个主成分的表达式分别为:

表2 各指标主成分的特征向量和累积贡献率Table 2 The feature vector and cumulative contribution coefficient of the main components of the index
y1=0.38x1+0.40x2+0.44x3+0.20x4+0.39x5+0.33x6+0.45x7。
y2=-0.37x1+0.23x2+0.20x3+0.59x4-0.44x5-0.37x6+0.31x7。
载荷系数反映各主成分的相关性,数值分布在-1 ~1,且其绝对值越接近1,表明该物质与该主成分的相关性越强。由表3 可知,第一主成分的指标主要为ZR(0.799)、IAAO(0.783)、PPO(0.712)、ABA(0.694)、POD(0.668),第二主成分的指标主要为IAA(0.88)。

表3 主成分得分和综合得分†Table 3 Comprehensive evaluation scores
把每个原始指标进行标准化后的数据代入上述2 个主成分方程中,可以得到圆齿野鸦椿对应的2 个主成分得分;再以2 个主成分方差贡献率占2 个主成分总方差累计贡献率的比率为权重计算综合得分,从而得到基于主成分分析法的圆齿野鸦椿扦插生根评价模型,即加权值计算公式为;
z=0.451y1+0.321y2。
从表3 可以看出,在处理I(150 mg/L NAA+150 mg/L IBA)与处理Ⅱ(CK)的第一主成分得分、第二主成分得分及综合主成分得分的对比中,处理I 的得分均高于处理Ⅱ,说明NAA+IBA 可提高圆齿野鸦椿扦插生根率。
3 讨 论
3.1 3 种氧化酶活性与圆齿野鸦椿插穗生根的关系
在植物的生长、发育过程中,酶发挥着重要的作用,其中酶的活性与不定根的发生有着密切的关系,目前对酶的研究主要集中在POD、PPO、IAAO 与扦插生根的关系[8]。过氧化物酶POD 参与生长素代谢、酚类物质合成以及细胞壁木质化[9],郝爱丽等[10]发现高活性的POD 有助于插穗不定根的诱导,同时也有研究表明[11],POD 作用的某些产物可能是不定根发生和发展所需要的辅助因子,能促进不定根的生成。在本试验中,圆齿野鸦椿插穗POD 在愈伤组织形成时升高至峰值后持续下降,仅出现一个高峰,这与难生根树种插穗的变化规律相一致[12]。有研究表明,活性升高的POD 能够加快插穗愈伤组织的形成以及维管束分生组织的形成[9],在不定根伸长生长期POD 活性下降则能够有利于积累插穗内部IAA,从而促进细胞分裂和根系伸长,POD 可能是圆齿野鸦椿插穗生根的关键酶,150 mg/L NAA+150 mg/L IBA 生长调节剂处理能够明显提高POD 活性。
多酚氧化酶(PPO)是一种含铜的酶,可催化酚类物质与IAA 缩合而形成一种生根辅助因子“IAA-酚酸复合物”,加速生长素的代谢,能大幅度提高扦插生根率[13]。Rout[14]发现在山茶的不定根诱导期,PPO 的活性上升明显。在本试验中,圆齿野鸦椿插穗的PPO 活性变化规律与POD 相类似,在愈伤组织形成时保持较高的水平,这有助于产生与生根相关的辅助因子,有利于根系发育突破表皮,当不定根生长伸长时,插穗体内酚类物质开始减少,PPO 活性开始下降,此时有利于不定根伸长。这与张锦春等[12]的研究结果一致。本试验表明,与对照组相比,经150 mg/L NAA+150 mg/L IBA 混合溶液浸泡2 h 处理的插穗,PPO活性显著升高,且其活性上升速度快,峰值出现早。从外部形态观察,经生长调节剂处理的插穗生根时间比对照组提前了30 d 左右,说明高活性的PPO 能够促进插穗生根。
吲哚乙酸氧化酶(IAAO)可以分解IAA,通过调节IAA 的含量来影响植物根系的发生。在本试验中,经150 mg/L NAA+150 mg/L IBA 生长调节剂处理的插穗在第0 天时IAAO 活性显著低于对照组,且扦插后处理组与对照组IAAO 活性均呈现下降趋势,低活性的IAAO 只能够氧化少量的IAA,有研究认为,当IAAO 活性降低时,其降解IAA 能力弱,能使大量的IAA 输送到插穗基部,从而有利于根原基的诱导[15],这与本研究结果一致。但也有一些研究表明,低活性的IAAO有助于插穗愈伤组织的形成,高活性的IAAO 有助于插穗不定根的形成和伸长生长[16],因此IAAO对不定根的影响可能因树种而异。
3.2 内源激素与圆齿野鸦椿插穗生根的关系
生长素IAA 在插穗生根过程中的作用已经被众多学者从多个角度论证,认为IAA 是促进不定根发生的主要激素[13],对不定根的形成有明显在促进作用[5]。IAA 促进生根的作用机理主要为其作用于非常敏感的形成层等幼嫩部位的分生组织细胞,引起细胞分化和分裂,形成根原始细胞,影响再生初期蛋白质合成的数量和质量[17],甚至有研究认为扦插生根的难易程度主要取决于IAA 的含量[18]。在本试验中,150 mg/L NAA+150 mg/L IBA生长调节剂处理能使插穗体内进行高浓度的IAA含量积累,随着插穗皮孔开裂、愈伤组织形成及根原基的形成,插穗IAA 含量逐渐降至最低值,随着不定根的生长又逐渐升高。说明愈伤组织与根原基的形成需要消耗大量的IAA,而高浓度的IAA 积累有助于其对根原基的诱导,这与刘国彬等[19]的研究结果一致。对照组由于缺少NAA+IBA 的调节,插穗内的IAA 含量始低于处理组。
脱落酸ABA 是天然的植物抑制性激素,通常被认为是植物生根抑制剂,许多研究都表明高含量的ABA 能够抑制插穗内根原基的诱导分化从而不利于插穗不定根的发生[20-21]。在本试验中,ABA 的含量在前期总体呈现上升趋势,ABA 含量的增加有助于增加插穗的抗逆性,降低切口机械损伤的影响[5];之后在根原基本诱导及不定根伸长时ABA 含量持续下降,且150 mg/L NAA+150 mg/L IBA 混合溶液处理组插穗的ABA 含量明显低于对照组,说明150 mg/L NAA+150 mg/L IBA混合溶液处理能够有效的抑制插穗ABA 的合成,张帆等[22]认为ABA 含量降低有助于插穗内淀粉水解为糖,也有利于根原基的形成。
赤霉素GA3的主要生理功能是加速细胞的分裂和伸长生长速度,同时也能影响插穗的生根,如李朝婵等[23]发现赤霉素GA3的升高有助于插穗愈伤组织的形成和不定根的诱导。同时有研究认为赤霉素可以促进植物不定根的发生,但大多数研究认为赤霉素是不定根形成的抑制物,赤霉素通过抑制形成根原基细胞的分裂或阻碍生长素诱导不定根发育这两条途径来抑制根系的形成[24]。在本试验中,圆齿野鸦椿插穗经150 mg/L NAA+150 mg/L IBA 混合溶液处理后,GA3含量在根原基诱导和不定根伸长时持续下降,表明高含量的GA3会抑制圆齿野鸦椿根原基的形成及根系的伸长,这与李永欣等[25]的研究结果一致。对照组插穗的GA3含量较处理组一直处于较高浓度,而处理组插穗的生根率优于对照组,这也印证了GA3含量高会抑制插穗生根的观点。
玉米素核苷ZR属于细胞分裂素CTK的一种,其生理功能主要是促进细胞分裂,诱导芽的形成以及芽的生长,细胞分裂素主要存在于进行细胞分裂的部位,如茎尖、根尖等[26]。有研究发现CTK 水平较高时,能促进细胞分化进而有利于不定根生成[27],也有研究表明CTK 浓度高会抑制生根[25],而浓度低时才有助于根原基的诱导以及不定根的生长[28],在本试验中,经过150 mg/L NAA+150 mg/L IBA 混合溶液处理过的插穗ZR 值在初期有所升高,可能是为了提高插穗抗逆性,之后持续降低,这表明低浓度ZR 有利于圆齿野鸦椿插穗根原基的形成以及不定根的伸长。这与袁利利等[29]得出的高浓度ZR 值能促进不定根伸长的结论相反,究其原因可能是因为树种不同。
内源激素对植物插穗生根过程中的调控是一个复杂而精细的过程,不是单一的激素的含量变化对根系产生作用,而是多种激素相互协同、制约的过程,多种激素的互相作用是调控生根的关键[30]。有研究认为,IAA/ABA、IAA/ZR 的比值高有益于插穗生根,但不同树种对于激素间比值的反应敏感度并不相同[31]。在本试验中,经过150 mg/L NAA+150 mg/L IBA 混合溶液处理过的插穗IAA/ABA值在整个生根阶段均高于对照组,说明高比值的IAA/ABA 有利于圆齿野鸦椿插穗生根;IAA/ABA值在愈伤组织形成时下降至0.5,在不定根生成时维持在0.5 左右,说明此时有助于愈伤组织形成及根原基诱导,之后IAA/ABA 比值上升有助于圆齿野鸦椿不定根伸长生长。有研究表明,IAA/ZR对生根同样有影响作用[32]。在本实验中,处理组IAA/ZR 值与IAA/ABA 值相类似,在整个生根阶段均显著高于对照组,在愈伤组织生成时下降,在不定根生长时比值上升。处理组IAA/GA3在愈伤组织形成后迅速下降,以促进不定根的诱导。在整个生根过程中,IAA/ZR 比值均大于5,IAA/GA3比值均大于10,说明插穗内源激素IAA 含量高于ZR 含量及GA3含量时有助于不定根的形成。但处理组与对照组IAA/ABA 值均小于1,这可能是圆齿野鸦椿插穗生根率低的主要原因。
本研究对扦插过程中插穗的外观形态变化进行了描述,统计了插穗生根类型,并对扦插生根进程中的相关酶活性及内源激素含量进行了测定分析,但并未对影响扦插生根进程中其他种生理生化指标如营养物质(可溶性蛋白、淀粉、可溶性糖)、酚类化合物含量进行测定,下一步有必要对其生根过程的解剖结构进行观察,以便准确划分插穗的生根阶段,并揭示不同生根阶段与各类生理生化指标变化之间的关系。
4 结 论
本研究可以得出以下结论:1)150 mg/L NAA+150 mg/L IBA 混合溶液浸泡插穗基部2 h,对圆齿野鸦椿插穗生根具有明显的促进效果。2)圆齿野鸦椿插穗生根类型主要为愈伤组织生根型,少量为皮部生根型和混合生根型。3)采用150 mg/L NAA+150 mg/L IBA 混合溶液处理插穗基部2 h,可以提高插穗基部皮层内POD 和PPO活性,降低IAAO 活性,以及提高IAA 含量及其与ABA、GA3、ZR 的比值,从而促进圆齿野鸦椿插穗愈伤组织和不定根的形成。
