胡黄连提取物化学指示性成分与感官指标变化规律研究
2023-12-25吴心悦丁可欣葛改变胡佳亮
吴心悦,丁可欣,葛改变,胡佳亮,吴 飞,林 晓
上海中医药大学 中药现代制剂技术教育部工程研究中心,上海 201203
胡黄连PicrorhizascrophulariifloraPennell 为玄参科胡黄连属植物,性味苦寒,味道极苦,是具有极强苦味的代表性中药之一[1]。现代研究显示,胡黄连的化学成分包括环烯醚苷、苯乙醇苷、酚苷、葫芦烷三萜类成分[2],其中环烯醚萜苷是最重要的活性成分[3-4]。提取、浓缩及干燥步骤是中药在制剂成型前重要的处理工艺环节,提取溶剂、时间、次数,浓缩及干燥时间与温度是这些工艺环节的关键参数,这些参数不仅影响化学成分的转移[5],而且直接影响药物品质和药效的传递[6]。药效相关的感官指标通常以颜色、味道、气味、质地等作为综合评价指标[7],对中药及中药制剂的感官属性进行描述评价[8],近年来在中药资源、中药炮制等方面有越来越多的应用[9-10],但是关于中药在提取、浓缩及干燥环节中对化学成分、颜色、味道综合评价的研究出现较少。胡黄连从药材饮片到提取液、浓缩液和干燥物均呈现明显的颜色,但其呈色物质不明,且呈色物质与指示性成分之间的相关性也未有研究。虽然近年来有研究尝试探索胡黄连苦味化学物质基础,但其呈味物质的化学成分仍然不明[11],苦味感官属性与指示性成分的关联性亟待探讨。
色差仪能够利用光学电子元件模拟人眼测量代替人眼观察,把颜色量化为具体数值,分析颜色组成及颜色的色差值,将颜色感官指标以L*、a*、b*值进行量化[12]。胡黄连作为极苦味道的代表性中药之一,苦味可以通过健康志愿者人工评价法进行量化表征[13],以苦度值作为评价胡黄连的味觉感官指标[14]。因此在本研究中,以HPLC 法同时测定胡黄连指示性成分香草酸及胡黄连苷IV、III、II、I 含量;结合色差仪颜色测定方法以及健康志愿者人工评价法分别对胡黄连颜色、苦味感官属性进行测定。对指示性成分含量与感官指标之间的相关性进行分析,并建立回归方程,同时对温度因素影响下指示性成分含量及感官指标的改变进行差异性分析[15],为胡黄连在制剂前处理过程中提取物指示性成分及感官指标的相关研究提供参考。
1 仪器与材料
1.1 仪器
Waters Alliance e2695 型高效液相色谱仪,含PDA 检测器,Empower 3 色谱工作站,美国沃特世科技公司;ADCI 型系列全自动色差仪,北京辰泰克仪器技术有限公司;α-Astree II 型电子舌,法国Alpha MOS 公司;XP205 型分析天平,0.01 mg,梅特勒-托利多科学仪器有限公司;FA2104N 型分析天平,0.1 mg,上海精密科学仪器有限公司;VM-240VAC 型涡旋震荡混合仪,国药集团化学试剂有限公司;N-1300 型旋转蒸发仪,东京理化器械株式会社;PTHW 型电热套,郑州科泰实验仪器设备有限公司;DZF-6090 型真空干燥箱,上海精宏实验设备有限公司;TGL-18C 型离心机,上海安亭科学仪器厂;玻璃仪器,《中国药典》标准规格,均购自国药集团化学试剂有限公司。
1.2 材料
胡黄连饮片(批号1803141),购自安徽普仁中药饮片有限公司,经上海中医药大学林晓教授鉴定,为玄参科胡黄连属植物胡黄连P.scrophulariifloraPennell 的干燥根茎。
对照品香草酸(批号110776-201503,质量分数99.8%)、胡黄连苷I(批号117727-201702,质量分数95.6%)、胡黄连苷II(批号11596-201805,质量分数93.2%),均购自中国食品药品检定研究院;对照品胡黄连苷III(批号P15M9S61340,质量分数98%)、胡黄连苷IV(批号P13J9S63654,质量分数98.5%),均购自上海源叶生物科技有限公司;盐酸小檗碱原料药(批号JB20181001,质量分数99.6%),购自云南明镜亨利制药有限公司;谷氨酸钠(批号BCBK6359V,质量分数>98.0%),购自Sigma-Aldrich 公司;柠檬酸,批号TF220601,受赠于九典宏阳制药有限公司;蔗糖(分析纯)、NaCl(分析纯)、甲醇(分析纯)、磷酸(分析纯)、乙腈(色谱纯),均购自国药集团化学试剂有限公司;水,杭州娃哈哈集团有限公司。
2 方法与结果
2.1 胡黄连提取液、浓缩过程中药液及干膏经复溶后药液的制备
2.1.1 胡黄连提取液 取适量胡黄连饮片,加入一定量纯水,浸泡30 min 后,提取适宜时间、适当次数,合并滤液并补足体积,用于测定。
2.1.2 胡黄连浓缩过程中药液 在浓缩过程中,在不同时间点取适量胡黄连药液,用于测定,剩余部分倒回,并补足体积。
2.1.3 胡黄连干膏经复溶后药液 在干燥过程中,在不同时间点取出胡黄连浸膏,加入适量纯水稀释浸膏,并转移至200 mL 量瓶中定容,用于测定。
2.2 胡黄连化学指示性成分含量测定方法建立
2.2.1 对照品溶液的制备 精密称取适量香草酸及胡黄连苷I、II、III、IV 对照品,以甲醇溶解制得含香草酸135.4 µg/mL、胡黄连苷I 114.2 µg/mL、胡黄连苷II 106.2 µg/mL、胡黄连苷III 61.0 µg/mL、胡黄连苷IV 66.4 µg/mL 的混合对照品溶液。
2.2.2 供试品溶液的制备 取适量胡黄连提取液、浓缩过程中药液及干膏经复溶后的药液于量瓶中,加入甲醇溶解定容至刻度,涡旋混匀,12 000 r/min高速离心(离心半径10 cm)10 min 后取上清液,即得供试品溶液。
2.2.3 色谱条件 色谱柱为Pntulips QS-C18plus 柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~15 min,18%乙腈;15~25 min,18%~28%乙腈;25~35 min,28%~38%乙腈;35~40 min,18%乙腈;质量分数为1.0 mL/min;检测波长为275 nm;柱温为30 ℃;进样量10 μL。色谱图见图1。
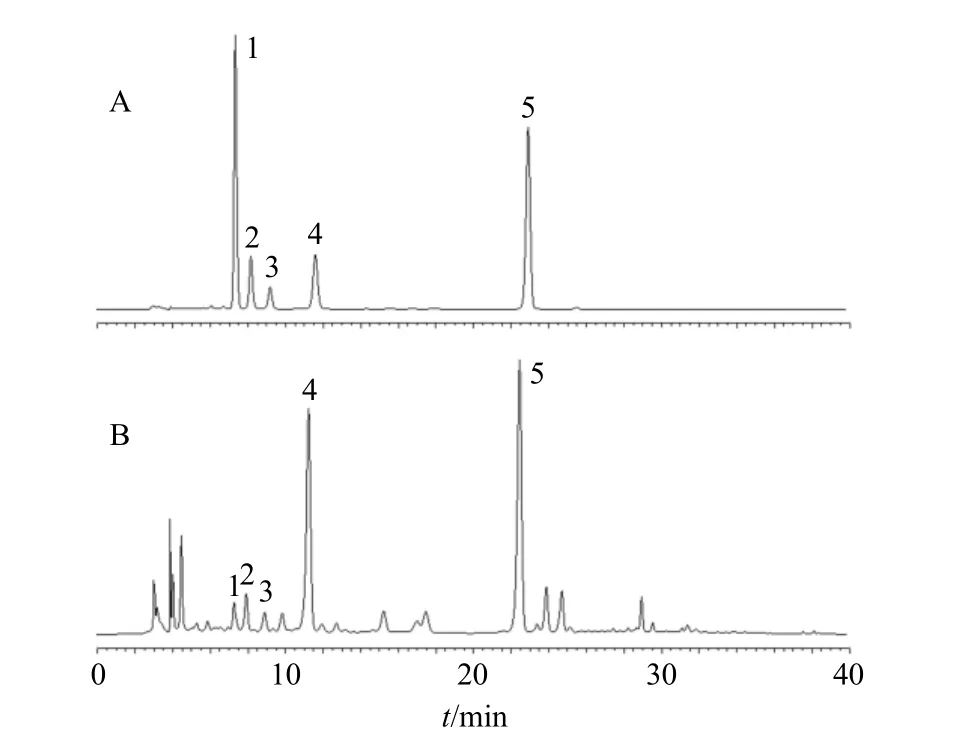
图1 混合对照品溶液 (A)、胡黄连供试品溶液 (B) 的HPLC 图Fig. 1 HPLC of mixed reference substances solution (A) and test solution of PR (B)
2.2.4 线性关系考察 分别精密吸取1、3、6、9、12、15 μL 混合对照品溶液,按“2.1.3”项下色谱条件检测并记录峰面积,以香草酸及胡黄连苷IV、III、II、I 进样量为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得线性回归方程分别为香草酸Y=9 339 055.52X-19 898.60,R2=0.999,线性范围0.677~10.155 μg;胡黄连苷IVY=2 630 649.48X+137 307.44,R2=0.997,线性范围0.571~8.565 μg;胡黄连苷IIIY=1 310 633.38X+58 113.20,R2=0.997,线性范围0.531~7.965 μg;胡黄连苷IIY=7 158 175.69X+56 142.73,R2=0.999,线性范围0.305~4.575 μg;胡黄连苷IY=20 273 237.78X-115 050.32,R2=0.999,线性范围0.332~4.980 μg;结果表明,各成分分别在各自线性范围内线性关系良好。
2.2.5 精密度考察 取混合对照品溶液,连续进样6 次,按“2.1.3”项下色谱条件检测并记录峰面积,计算香草酸及胡黄连苷IV、III、II、I 峰面积的RSD分别为0.56%、0.86%、1.96%、0.61%、1.73%,结果表明仪器精密度良好。
2.2.6 稳定性考察 按照“2.2.2”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h 取胡黄连供试品溶液,按“2.1.3”项下色谱条件检测并记录峰面积,计算香草酸及胡黄连苷IV、III、II、I 峰面积的RSD 分别为1.21%、2.74%、2.92%、1.96%、1.73%,结果表明供试品溶液在24 h 内稳定性良好。
2.2.7 重复性考察 平行制备6 份供试品溶液,按“2.1.3”项下色谱条件检测并记录峰面积,计算香草酸及胡黄连苷IV、III、II、I 质量分数的RSD 分别为2.50%、2.97%、2.59%、2.32%、1.68%,结果表明该方法重复性良好。
2.3 感官指标测定方法建立
2.3.1 颜色感官指标的测定 色差仪的CIE1976 LAB 系统作为最广用测色系统,适用于所有光源色及物体色的测定及计算,可以对中药液体颜色进行量化表征[16]。L*表示颜色亮暗,L*值越大,颜色亮度高,即颜色浅,反之亦然;a*表示红绿,+a*代表红色,−a*代表绿色;b*表示黄蓝色,+b*代表黄色,−b*代表蓝色[17]。中药颜色感官属性可以利用L*、a*、b*值进行数字化表征[18],并且在中药炮制过程中也能够以药材颜色的L*、a*、b*值作为判断炮制终点的依据[19]。在本研究中定量取各胡黄连提取液或复溶后液体样品于测试皿中,使用色差仪进行检测,随机扫描3 次取平均值,得到样品的L*、a*、b*值,表示颜色感官属性。
2.3.2 胡黄连提取液味道分析 以盐酸小檗碱(苦)、蔗糖(甜)、柠檬酸(酸)、氯化钠(咸)作为味道参考标准,4 类味道参照溶液质量浓度均设为0.01 g/L[20],使用电子舌对胡黄连提取液的味道来源进行定性分析,每个样品电子舌测定3 次并对结果进行主成分分析(principal component analysis,PCA),PCA 图中样品之间的距离越近说明味道最为相似,计算胡黄连溶液供试品溶液与4 类味道的距离,分析胡黄连主要味道来源。电子舌测定结果的PCA 如图2 所示,主成分1 及主成分2 的累积贡献率达99.6%,表明能够较好地代表原始数据。结果显示胡黄连提取液供试品溶液与盐酸小檗碱所代表的苦味参比溶液最靠近,胡黄连提取液供试品溶液与4 类味道的距离如表1 所示,胡黄连提取液供试品溶液与4 类味道的距离从小至大为苦<甜<咸<酸,距离越小,证明味道最为相似。因此,通过电子舌测定结果可知,胡黄连主要味道的来源为苦味,及以盐酸小檗碱作为标准苦味物质,用于健康志愿者人工评价法评价胡黄连苦味的可行性。
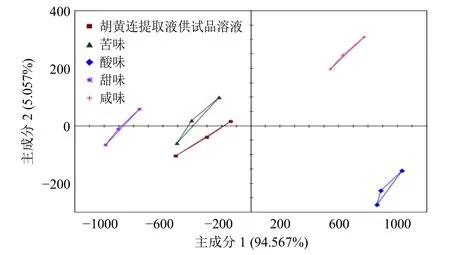
图2 胡黄连提取液供试品溶液与4 类味道的PCA 图Fig. 2 Diagram of PCA of extracts of PR and four kinds of tastes

表1 胡黄连提取液供试品溶液与4 类味道的距离Table 1 Distance between extracts of PR and four kinds of tastes
2.3.3 苦味感官指标的测定 苦味感官指标测定方法采用健康志愿者人工评价法,该法以标准苦味物质作为标准,结合等级评价方法及评分法制定苦味评价标准打分表,志愿者进行口尝打分[21]。味觉感官评价实验的评价人员需身体健康,味觉嗅觉灵敏,尤其对苦味感受灵敏,年龄控制在18~30 岁,近3 d 内未吸烟或饮酒,评价前2 h 未进食[22]。评价人员以盐酸小檗碱作为标准苦味物质,进行专门的口尝标准评价训练,使评价人员对口尝苦度的强度值达到统一共识[23],苦味评价标准打分如表2 所示。评价人员在评价前使用纯净水漱口,将适量样品包含于口中10 s,使样品充分接触舌面,感受味道,并进行打分。评价间隙使用纯净水充分漱口,配合3~5 min 休息,以保障评价结果的可靠[24]。由于胡黄连苦味极强,在高质量浓度下无法区分不同样品之间的苦味强度差异,因此在本研究中均将胡黄连待评价液体稀释至原液的5%作为评价样品。感官评价人员对样品进行苦味打分,每组数据使用Grubbs 检验法,以0.05 为剔除水平,进行循环检验剔除异常值后,取打分平均值,作为表示味觉感官指标的苦度强度值[25],评价人员均来自上海中医药大学中药现代制剂技术教育部工程研究中心实验室,经过充分的打分训练后,筛选出对味道感知灵敏,并长期参与人工味觉感官评的10 名健康志愿者。

表2 苦味标准打分表Table 2 Bitterness standard score scale
2.3.4 电子舌与人工评价结果之间的相关性分析取适量胡黄连饮片,加入15 倍量的水浸泡30 min后,提取60 min,提取1 次,滤过得到胡黄连提取液。由于胡黄连提取液具有极强的苦味,在高质量浓度下无法区分不同样品之间的苦味强度差异,因此将提取液稀释至原提取液的10%,作为人工评价母液。用水将母液稀释至原液的75%、50%、25%、15%、10%、5%作为不同质量浓度梯度的待评价样品,用于健康志愿者人工评价。
电子舌灵敏度极高,对微小的味觉信号也存在响应,但样品质量浓度过高时,会吸附在电极表面,加速电子舌传感器的损坏,因此,用于电子舌测定的样品应处于较低质量浓度。分别将人工评价母液稀释10、50、100、150 倍进行考察,稀释50 倍时,样品信号响应值的RSD 值最小,故以0.05 g/L 的盐酸小檗碱作为苦味参照,将用于人工评价的不同质量浓度梯度的待评价样品分别稀释50 倍,作为电子舌测试样品,电子舌测试结果的PCA 如图3 所示,主成分1 及主成分2 的累积贡献率达99.6%,能够较好地代表原始数据。以不同质量浓度梯度样品的人工评价苦度值为横坐标(X),电子舌测试所得的各样品分别与盐酸小檗碱之间的距离为纵坐标(Y),进行线性拟合。如图4 所示,拟合线性方程为Y=−102.53X+974.01,R2=0.934,二者相关性极显著(P<0.001),结果显示健康志愿者人工评价所得的苦度值与电子舌测试结果具有一致性,说明在本研究中苦味感官指标评价方法选择健康志愿者人工评价法的可靠性较佳。

图3 不同质量浓度梯度样品的PCA 结果Fig. 3 Results of PCA of samples with different concentration gradients

图4 不同质量浓度梯度样品苦度值与距离之间的线性拟合Fig. 4 Linear fitting between bitterness value and distance of samples with different concentration gradients
2.4 层次分析法(analytic hierarchy process,AHP)-CRITIC 法结合计算指示性成分综合权重
2.4.1 AHP 法确定各指示性成分权重 AHP 法是一种主观赋权法,通过将不同因素划分为不同层次,结合定量及定性分析方法进行决策分析[26]。根据胡黄连中各指示性成分的含量,确定各化学成分的优先顺序为胡黄连苷II>胡黄连苷I>胡黄连苷III>胡黄连苷IV>香草酸,对5 个化学成分进行两两成对比较重要性,构建判断矩阵,如表3 所示。使用SPSS PRO 软件根据层次分析法算得香草酸、胡黄连苷IV、胡黄连苷III、胡黄连苷II、胡黄连苷I 权重系数分别为0.051 5、0.098 4、0.142 9、0.414 2、0.293 0。

表3 指示性成分的优先判断矩阵Table 3 Priority judgment matrix of indicative components
2.4.2 CRITIC 法确定各指示性成分权重 CRITIC法是一种客观赋权法,通过对比强度及冲突性指标,使用标准差进行表示,可以得到客观评价结果[27]。根据实验数据进行归一化处理后,使用SPSS PRO软件根据CRITIC 法计算各指示性成分权重,各评价指标的对比强度(Sj)、冲突性(Rj)、信息量(Cj)、客观权重(Wj),结果如表4 所示,结果显示香草酸及胡黄连苷IV、III、II、I 权重系数分别0.246 2、0.263 8、0.169 4、0.125 3、0.195 2。

表4 CRITIC 法相关计算数据Table 4 Calculation data of CRITIC method
2.4.3 AHP-CRITIC 法结合计算权重 结合主观及客观分析,为得到更为真实的权重分析结果,依据公式ω综合ij=ωAHPijωCRITICij/∑ωAHPijωCRITICij计算综合权重[28]。香草酸及胡黄连苷IV、III、II、I 的综合权重系数分别为0.073 7、0.151 0、0.140 8、0.301 8、0.332 6。
2.4.4 综合评分比较 分别使用上述AHP、CRITIC、AHP-CRITIC 法所得的权重系数对提取过程中测得各指示性成分含量的均值进行综合评分,结果如表5 所示,综合评分公式=(香草酸含量/香草酸含量最大值)×权重×100+(胡黄连苷IV 含量/胡黄连苷IV含量最大值)×权重×100+(胡黄连苷III 含量/胡黄连苷III 含量最大值)×权重×100+(胡黄连苷II 含量/胡黄连苷II 含量最大值)×权重×100+(胡黄连苷I 含量/胡黄连苷I 含量最大值)×权重×100。直观分析显示,3 种方法所得的综合评分差距较小,使用SPSS 27.0 软件,对3 种方法进行相关性分析,结果显示AHP 法与AHP-CRITIC 法的相关系数为0.999,CRITIC 法与AHP-CRITIC 法的相关系数为0.999,AHP 法与CRITIC 法的相关系数为0.999,3者均具有极显著的相关性(P<0.001),3 种方法得到的综合评分具有一致性。AHP 法与CRITIC 法权重系数之间的相关性为0.827,2 者相关性不存在显著性差异(P=0.084),证明2 种方法呈现的信息不具有叠加性。结合主观及客观分析,为得到更为真实的权重分析结果,并使得所得信息更加全面,因此在本研究中使用AHP-CRITIC 法结合计算各指示性成分综合权重。

表5 3 种赋权法的综合评分Table 5 Comprehensive score of three weighting methods
2.5 制剂前处理过程不同环节对胡黄连指示性成分含量与感官指标的影响考察
2.5.1 提取环节考察 取适量胡黄连饮片,均浸泡30 min,以加水倍数作为考察指标,提取次数固定为1 次,提取时间固定为60 min,分别加10、15、20 倍水进行提取;以提取时间作为考察指标,提取次数固定为1 次,加水倍数固定为15 倍,分别提取30、60、90 min;以提取次数作为考察指标,提取时间固定为60 min,加水倍数固定为15 倍,分别提取1、2、3 次。每次提取均进行回流提取并补足质量,调整至相同体积。按“2.1.2”项下制备供试品溶液,按“2.1.3”项下色谱条件测定不同提取条件下的提取液指示性成分的含量,按“2.3”项下方法对感官指标进行测定。
2.5.2 浓缩环节考察 取实验室制得的胡黄连提取液各1000 mL,分别于60、70、80 ℃下进行减压浓缩,0~8 h 整点取样,平行取样2 份,取样前先将减压蒸馏出的液体倒回供试品溶液并混合均匀,以水补足总体积后再进行取样。按“2.1.2”项下制备供试品溶液,按“2.1.3”项下色谱条件进行测定,测得浓缩过程中各时间点指示性成分的含量,按“2.3”项下方法对各时间点的感官指标进行测定。
2.5.3 干燥环节考察 取实验室制得的胡黄连浓缩液(密度1.1 g/mL)共300 mL,分别于60、70、80 ℃下进行减压干燥10 h,每组放入5 份浓缩液样品每份20 mL,每隔2 h 取1 份浓缩液样品,加水将每份样品转移至200 mL 量瓶中恢复至浓缩前体积,平行取样2 份。按“2.1.2”项下制备供试品溶液,按“2.1.3”项下色谱条件进行测定,测得干燥过程中各时间点指示性成分的含量,按“2.3”项下方法对各时间点的感官指标进行测定。
2.6 提取环节对胡黄连指示性成分含量与感官指标的影响结果及分析
2.6.1 不同提取条件下指示性成分含量与感官指标的考察结果及相关性分析 提取环节指示性成分含量与感官指标测定结果如表6 所示,结果显示指示性成分的含量及各感官指标受不同提取条件的影响。使用SPSS 27.0 软件对胡黄连提取液感官指标L*、a*、b*、苦度值与其指示性成分香草酸及胡黄连苷IV、III、II、I 含量以及成分综合评分的数据进行Pearson 相关性分析,相关性结果如表7 及图5 所示,感官指标L*、a*、b*值与各指示性成分含量及其综合评分呈现显著的相关性(P<0.05),L*值与b*值与各指示性成分呈现显著的负相关,a*值则与各成分呈现显著的正相关。味觉感官指标苦度值与香草酸及胡黄连苷III、II 含量以及成分的综合评分呈现显著的正相关。提取环节考察结果表明L*、b*值越小,a*值越大,即溶液颜色越深、红色调越明显,胡黄连指示性成分含量越高。
表6 不同提取条件下胡黄连各指示性成分含量及综合评分结果以及提取液感官指标测定结果 (±s, n = 3)Table 6 Content of each indicative component and comprehensive score of PR and results of sensory indexes of extracts under different extraction conditions (±s, n = 3)

表6 不同提取条件下胡黄连各指示性成分含量及综合评分结果以及提取液感官指标测定结果 (±s, n = 3)Table 6 Content of each indicative component and comprehensive score of PR and results of sensory indexes of extracts under different extraction conditions (±s, n = 3)
提取条件 质量分数/(mg∙g−1) 综合评分 L* a* b* 苦度值香草酸 胡黄连苷IV 胡黄连苷III 胡黄连苷II 胡黄连苷I 10 倍加水量 1.92±0.04 2.47±0.07 2.93±0.07 27.44±0.39 10.06±0.07 60.40±0.95 5.97±0.02 99.38±0.14 2.16±0.02 2.42±0.07 15 倍加水量 2.30±0.02 2.84±0.02 3.60±0.02 32.04±0.10 12.11±0.02 71.74±0.28 5.98±0.06 99.31±0.07 2.12±0.01 3.17±0.03 20 倍加水量 2.14±0.03 3.13±0.06 3.64±0.10 34.24±0.51 11.53±0.12 72.88±1.14 5.87±0.03 98.51±0.02 2.08±0.04 4.08±0.08提取30 min 1.91±0.00 2.36±0.04 3.24±0.05 26.64±0.14 9.69±0.00 59.61±0.34 6.95±0.04 96.50±0.17 3.32±0.06 3.00±0.06提取60 min 2.44±0.00 3.14±0.00 4.14±0.01 35.33±0.02 11.54±0.00 75.82±0.03 5.78±0.07 99.44±0.13 1.77±0.09 3.58±0.11提取90 min 2.70±0.04 2.75±0.05 3.77±0.06 34.91±0.35 11.80±0.12 74.25±0.86 5.85±0.07 98.43±0.13 2.12±0.06 3.83±0.06提取1 次 2.26±0.03 3.23±0.05 3.58±0.05 32.30±0.31 12.35±0.09 73.62±0.80 5.62±0.11 99.83±0.11 1.73±0.05 3.50±0.00提取2 次 2.96±0.03 4.12±0.05 4.58±0.06 41.62±0.32 15.78±0.09 94.46±0.83 5.46±0.02 100.63±0.05 1.13±0.02 3.75±0.10提取3 次 3.18±0.03 4.34±0.05 4.81±0.06 44.16±0.33 16.65±0.08 99.83±0.81 5.32±0.03 101.20±0.32 1.07±0.02 4.00±0.00

表7 胡黄连提取液感官指标与指示性成分含量的相关性分析Table 7 Correlation analysis between sensory indexes and content of indicative components of PR extracts
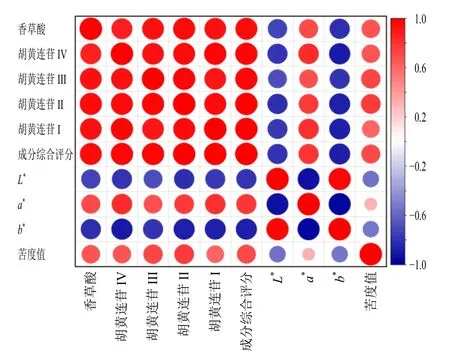
图5 感官指标与指示性成分含量的相关性热图Fig. 5 Heat map of correlation between sensory indexes and content of indicative components
2.6.2 指示性成分含量与感官指标的回归分析 以指示性成分含量及综合评分为自变量,L*、a*、b*、苦度值为因变量,进行回归分析,结果显示不存在显著性,回归模型无效。故以感官指标L*、a*、b*、苦度值为自变量,胡黄连指示性成分含量及综合评分为因变量进行回归分析,结果如表8 所示。香草酸在回归分析中P大于0.05 无显著性,其余指示性成分含量与感官指标的回归方程及感官指标在回归中对应的显著性如表9 所示,L*值与苦度值在胡黄连苷IV 及成分综合评分中回归存在显著性,L*值在胡黄连苷III 中存在显著性,而L*、a*、b*及苦度值在胡黄连苷II 与胡黄连苷I 中回归均不显著。

表8 指示性成分含量与感官指标的回归分析Table 8 Regression analysis of indicative component content and sensory indexes
2.7 浓缩环节温度因素对感官指标与指示性成分含量的影响结果及分析
2.7.1 指示性成分含量及感官指标在浓缩过程中的变化情况 减压浓缩过程中,指示性成分含量及感官指标的变化情况如表10 所示,在0~8 h 的浓缩过程中,随减压浓缩时间的增加,各指示性成分的含量存在减小趋势;比较不同温度下含量降低的情况,可知在60 ℃温度条件下减压浓缩,指示性成分的含量降低趋势低于另外2 个较高的温度,即在60 ℃温度下减压浓缩,指示性成分在浓缩过程中更稳定,含量降低更少。颜色感官指标L*、a*值在减压浓缩过程,在同一浓缩温度条件下不存在明显变化,但在60 ℃下,L*值低于另外2 个温度,a*值略高于另外2 个温度,L*值的变化表示,在60 ℃条件下溶液亮度更低,即颜色越深,a*值的变化表示,在60 ℃下红色值更高。b*值在60 ℃条件下低于另外2 个温度。苦度值在浓缩过程中则不存在规律性变化。综上在浓缩环节对感官指标的测定结果显示,在更高的浓缩温度下,液体的红色调会减少,颜色略有变浅,但不同的浓缩温度,对苦度值基本不具有影响。

表10 减压浓缩不同温度下在浓缩过程中各指示性成分的含量及各感官指标变化 (n = 2)Table 10 Contents changes of each indicator component and changes of each sensory index in concentration process at different temperatures (n = 2)
2.7.2 浓缩环节温度因素对指示性成分含量及感官指标影响的差异性分析 使用SPSS 27.0 软件对在0~8 h 浓缩过程中整点取样时胡黄连指示性成分香草酸及胡黄连苷IV、III、II、I 的含量及感官指标L*、a*、b*、苦度值继续进行数据处理,采用双因素方差分析对各组数据进行比较,再使用最小差异显著法(LSD 法)对温度因素进行事后比较,研究温度对各指标的影响。指示性成分含量及感官指标的方差分析结果如表11 所示,LSD 多重比较结果如表12 所示。

表11 减压浓缩过程中指示性成分含量与感官指标的方差分析结果Table 11 Results of variance analysis of indicative component content and sensory indicators in concentration process
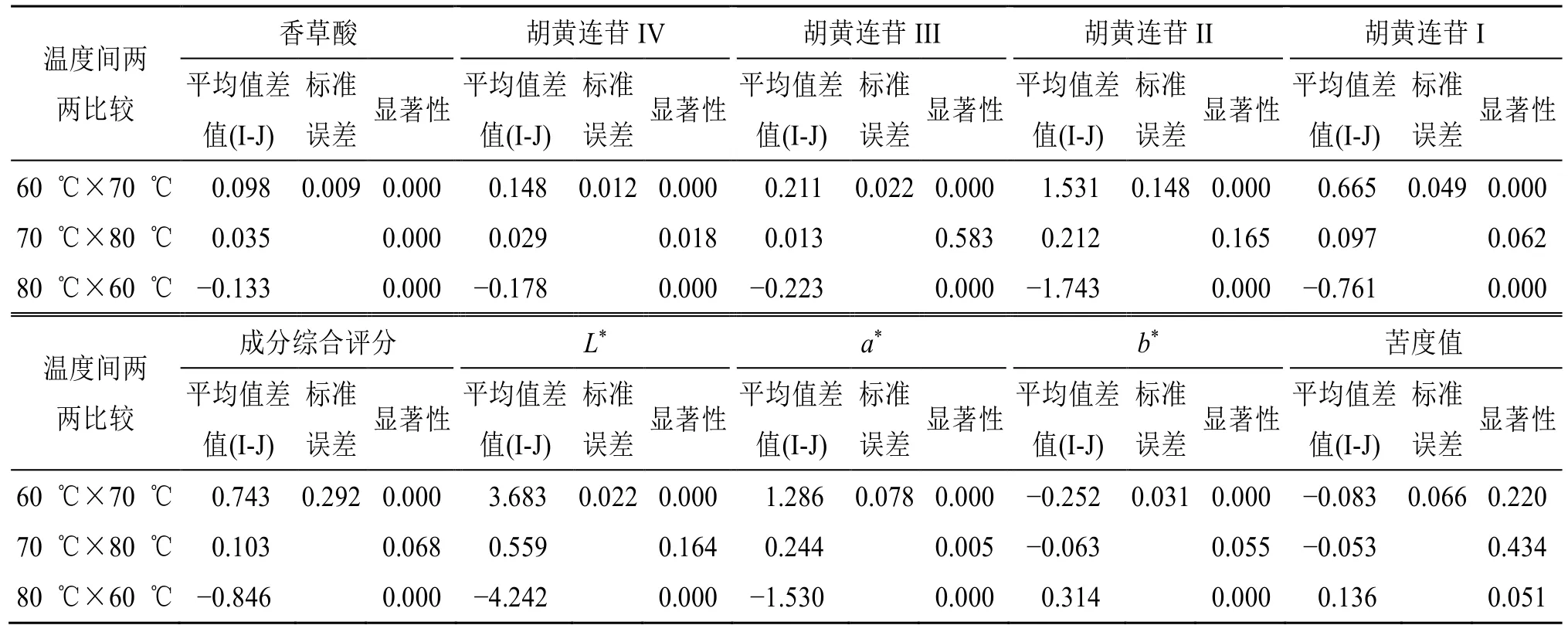
表12 减压浓缩环节指示性成分含量与感官指标的LSD 多重事后比较结果Table 12 Results of multiple post hoc LSD comparisons between the content of indicative components and sensory indixes in the concentration phase
由表11 的方差分析结果可知,在浓缩过程中,浓缩温度、浓缩时间对指示性成分的含量、综合评分及L*、a*、b*值的影响具有显著的统计学的差异(P<0.05)。对温度因素进行LSD 事后比较结果显示,不同浓缩温度对香草酸、胡黄连苷IV 含量及a*值的影响存在显著统计学差异(P<0.05);比较70 ℃与80 ℃浓缩温度,胡黄连苷III、II、I 含量、成分综合评分及L*、b*值不存在显著性差异,但这些指标在60 ℃温度条件分别与70、80 ℃相比则存在显著性差异(P<0.05);苦度值在各温度因素影响下均不存在显著性差异。综上温度因素在浓缩过程中对各指示性成分含量及L*、a*、b*值多具有显著性影响,但在70 ℃及80 ℃ 2 个温度条件下对胡黄连苷III、II、I、成分综合评分及L*、b*值则不存在较显著的影响。
2.8 干燥环节温度因素对感官指标与指示性成分含量的影响结果及分析
2.8.1 指示性成分含量及感官指标在干燥过程中的变化情况 减压干燥过程中,指示性成分含量及感官指标的变化情况如表13 所示,在0~10 h 的干燥过程中,在前4 h 内各指示性成分的含量变化较小,但在4~10 h 内存在较明显的变化,各指示性成分含量有所减少。香草酸在第10 小时的干燥终点时,各干燥温度下的含量没有明显区别,但胡黄连苷IV、III、II、I 的含量随着干燥温度的增加含量越低。颜色感官指标L*、a*、b*值在不同温度的干燥过程中,变化差异不明显,味觉感官指标苦度值在干燥过程中也不存在规律性变化。

表13 减压干燥不同温度下在干燥过程中各指示性成分的含量及各感官指标变化 (n = 2)Table 13 Changes of each indicative component content and each sensory index in the drying process at different temperatures under vacuum drying (n = 2)
2.8.2 干燥环节温度因素对指示性成分含量及感官指标的差异性分析 使用SPSS 27.0 软件对在0~10 h 干燥过程中每隔2 h 整点取样时胡黄连指示性成分香草酸及胡黄连苷IV、III、II、I 的含量及感官指标L*、a*、b*、苦度值继续进行数据处理,采用双因素方差分析对各组数据进行比较,再使用LSD法对温度因素进行事后比较,研究温度对各指标的影响。指示性成分及感官指标的方差分析结果如表14 所示,LSD 多重比较结果如表15 所示。

表14 减压干燥过程中指示性成分含量与感官指标的方差分析结果Table 14 Results of variance analysis of indicative component content and sensory indexes during vacuum drying

表15 减压干燥过程中指示性成分含量与感官指标的LSD 多重事后比较结果Table 15 Results of multiple post hoc LSD comparisons between content of indicative components and sensory indixes during vacuum drying
由表14 的方差分析结果可知,在干燥过程中干燥温度对香草酸、胡黄连苷III 含量及L*、a*值具有显著性影响(P<0.05),而温度因素对胡黄连苷IV、II、I 含量、成分综合评分及b*值的影响则不存在显著性差异。同时干燥时间及干燥时间与温度的交互作用对各指示性成分的含量及综合评分的影响存在统计学差异(P<0.05),苦度值在不同温度条件下则不存在显著性差异。对温度因素进行LSD 事后比较结果显示,香草酸含量、L*、a*值在80 ℃条件下分别与60、70 ℃温度下相比较,具有显著性差异(P<0.05),但比较60 ℃与70 ℃之间则无显著性差异;胡黄连苷III 含量与b*值在60 ℃与80 ℃温度条件相比较,均具有显著性差异(P<0.05)。综上在干燥过程中,温度因素对多数指标没有明显影响,但高温干燥条件对香草酸含量、胡黄连苷III 含量、L*、a*、b*值存在明显影响。
3 讨论
胡黄连的质量控制指标成分主要为环烯醚萜苷类化合物,由于这类化合物含有烯醚结构,存在热不稳定现象,因此在提取、浓缩、干燥、制剂等环节需要严格控制相关工艺,以确保这些药效相关的化学指标性成分的量值传递关系[29]。目前中药感官属性的相关研究多应用于中药资源及炮制研究,在中药制剂成型前处理环节,通常以颜色及味道表示提取物的感官内涵。中药制剂生产工艺研究中,提取、浓缩及干燥环节是关键的制剂成型前的处理过程,指示性成分在各环节的转移情况是重要的动态控制过程,也是评判制剂工艺生产可行性的关键评价指标,并且在各环节,中药提取物的颜色及味道作为关键的感官属性,会受不同处理方式或工艺参数的影响。
本研究针对各指标,在不同的处理工艺及参数设定下,对中药胡黄连提取、浓缩及干燥环节药液的感官指标进行量化表征,分析不同环节感官指标与指示性成分含量的关联性情况及温度因素的影响。结果表明,在提取环节胡黄连指示性成分含量与感官指标L*、a*、b*值呈现出显著的相关性,a*值与各指示性成分含量呈现显著的正相关,而L*与b*值则呈现显著的负相关,表明胡黄连提取液颜色的红色调与各指示性成分含量关系密切,苦度值则与香草酸及胡黄连苷III、II 含量呈现显著的正相关。在浓缩及干燥环节中各指示性成分的含量均存在少量减少现象,颜色感官指标L*、a*、b*值受温度影响也存在变化,不同温度因素对各指示性成分含量及颜色感官指标具有一定影响,在高温条件下会使胡黄连提取物液的红色调略有减小,并且对浓缩环节的影响相较于干燥环节更明显。苦味感官指标在浓缩及干燥环节中,则不存在明显差异及规律性变化,可能与指示性成分含量变化不明显有关。在制剂前处理过程中,胡黄连提取物的化学指示性成分及颜色、味道感官指标在不同环节进行着传递,研究结果揭示了在这些环节中化学指示性成分与这类感官指标存在关联性,胡黄连提取液颜色的a*值越大,颜色偏红,指示性成分含量越高,同时高温会对化学指示性成分及颜色感官指标产生一定影响,使a*值降低,同时指示性成分含量减少。不同的处理工艺及参数设定会使这些成分及指标存在变化,或使最终成型后的制剂在质量及颜色外观、味道感受上存在差异,从而影响后续的质量控制及评价,以及与制剂相关的感官内涵研究。因此,合理控制各制剂前处理环节工艺操作,同时在处理过程中对感官指标进行合理监测,对维持中药制剂品质,减少不同批次间的差异具有重要意义。
在中药炮制、中药制剂以及稳定性研究过程中,对其量值传递与品质影响的关键因素,包括物理因素(温度、水分、光照、压力、速度、体积等),化学因素(溶剂、极性、pH 值等)、时间因素等。本研究以胡黄连作为研究对象,通过提取、浓缩和干燥等制剂前处理环节,系统考察了溶剂体积、时间及温度等因素对胡黄连化学指示性成分、颜色和苦度值的影响规律,并初步阐述了这3 类指标之间的变化关系,将化学成分与感官属性进行关联,一方面来说,这些因素能表示有关胡黄连在中药制剂制备过程中的影响因素种类,另一方面也为从感官角度进一步探索中药制剂前处理环节与指示性成分相关的研究内涵做出了示范,同时也丰富了中药制剂相关质量评价体系。
利益冲突所有作者均声明不存在利益冲突
