基于网络药理学和体外实验探索黄连-大黄-肉桂复方治疗肝癌的作用机制*
2023-12-25何佳慧陈佳悦陈心怡刘小美
何佳慧 陈佳悦 陈心怡 刘小美△
1.上海中医药大学中药学院 (上海, 201203) 2.上海中医药大学中医学院
原发性肝癌是全球高发病率和致死率的恶性肿瘤之一[1],可分为肝细胞癌(HCC)、肝内胆管癌以及其他罕见类型,其中HCC占病例的75%~85%,是最主要的肝癌类型[2]。在过去几十年中,HCC临床治疗方面虽取得了一些进展,但因肝癌发病机制的复杂性以及对化疗药物的耐药性等,使得其诊断和治疗以及预后仍然不能令人满意。中医药在治疗HCC方面具有多途径、多靶点、多效应优势,是HCC综合治疗体系的重要组成部分,深入挖掘临床治疗肝癌的有效中药,全面探索其发挥作用的分子机制,寻找新的治疗靶点,对提高HCC的临床疗效显得尤为重要。黄连-大黄-肉桂复方(RRC)由黄连、大黄和肉桂(9∶3∶1)组成,具有清热解毒、活血化瘀之功,我们前期的研究已发现其对HCC小鼠的肿瘤生长和肝癌细胞增殖均具有明显抑制作用,其中调节肝癌细胞自噬是其作用机制之一[3-6]。鉴于HCC发病的复杂性、以及中药作用的多途径特点,本研究采用网络药理学分析和体外实验验证探索RRC治疗HCC的复杂作用机制,报道如下。
1 材料与方法
1.1 网络药理学研究
1.1.1 RRC活性成分与相应靶标的获取 以“黄连”“大黄”“肉桂”为检索词在中药系统药理学数据库与分析平台TCMSP(http://tcmsp-e.com/tcmsp.php)中检索黄连-大黄-肉桂复方所有活性成分。然后筛选出其中口服生物利用度(OB)≥30%和药物相似性(DL)≥0.18的活性成分,并进一步获取其对应的作用靶点(其中因肉桂各成分的DL均未高于0.18,因此其DL设置为≥0.12)。通过Uniprot数据库(https://www.uniprot.org/)对上述获得的作用靶点进行标准化处理及靶点蛋白-基因名的转换,以备后续数据处理之用。
1.1.2 HCC相关基因的检索与筛选 在人类基因数据库Genecards(https://www.genecards.org/)中,以“hepatocellular carcinoma”为关键词检索并下载HCC疾病相关基因,用于后续分析。
1.1.3 RRC作用靶点与肝癌相关基因的交集 以Venny 2.1网上在线工具(https://bioinfogp.cnb.csic.es/tools/venny/)对以上检索得到的RRC活性成分潜在靶点与HCC相关基因进行交集,并制作韦恩图。
1.1.4 复方中药-成分-肝癌靶点网络图的构建与分析 将RRC中三味中药、各自有效成分以及这些成分靶点与HCC疾病交集的基因,导入Cytoscape 3.7.2软件,构建复方中药-成分-HCC靶点网络图。
1.1.5 GO及KEGG通路的富集分析 将复方各成分靶点与HCC疾病交集的基因导入DAVID 6.8在线工具(https://david.ncifcrf.gov/home.jsp),限定物种条件为“Homo sapiens”,进行基因本体(GO)分类富集分析以及京都基因与基因组百科全书(KEGG)通路富集分析。在P<0.01的情况下,以富集基因数从多到少进行排序,选择排序靠前的GO分类和KEGG通路,利用微生信在线工具(http://www.bioinformatics.com.cn/)制作可视化图形。
1.2 体外实验验证
1.2.1 实验材料 (1)细胞株:人肝癌HepG2和Huh7细胞购自中国科学院上海细胞研究所。(2)实验药物:黄连、大黄和肉桂饮片购自上海养和堂张江店,粉碎机粉碎,按复方比例混合后置一个圆底烧瓶中,加入8倍量70%乙醇,浸泡30 min,80℃加热回流1 h后纱布过滤,往滤渣中再加入8倍量70%乙醇,80℃加热回流1 h后纱布过滤,合并滤液。旋转蒸发回收乙醇并浓缩药物至1 g生药/ml。临用时用培养液稀释至10 mg/ml后抽滤灭菌,再根据实验需要用培养液配制成不同浓度作用于细胞。(3)主要试剂:RPMI 1640培养液、胰酶、青霉素-链霉素均购于美国Gibco公司;胎牛血清购于美国Corning公司;CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购于上海碧云天生物技术有限公司;TRIzol试剂购自美国Ambion公司;PrimeScript RT Master Mix试剂盒和SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)购自日本Takara公司。(4)主要仪器:1300系列A2生物安全柜、Steri-Cycle i160 CO2培养箱、NanoDrop 2000超微量分光光度计、QuantStudio 3实时荧光定量PCR仪,均购自美国Thermo Fisher Scientific公司;ELx800酶标仪,购自美国Bio Tek公司;CytoFLEX流式细胞仪,购自美国Beckman公司。
1.2.2 方法 (1)细胞培养:人肝癌HepG2、Huh7细胞复苏后接种于含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液中,置于37℃恒温且通入5% CO2的培养箱中培养。(2)CCK-8法测定细胞增殖:选择对数生长期的HepG2和Huh7细胞,胰酶消化后以5×103/孔接种于96孔板中,置于培养箱中过夜。第2天往两种细胞各孔中加入不同浓度的RRC药液,使其终浓度分别为0.5、1.0、1.5、2.0和2.5 mg/ml,每个浓度做5个复孔,同步设立不用药的对照组。分别在药物作用24 h和48 h后加入CCK-8溶液,孵育1.5 h后测定570 nm的吸光度(OD值),计算各组细胞的存活率,公式:存活率(%)=(OD值实验-OD值空白)/(OD值对照-OD值空白)×100%;计算药物作用48 h时对肝癌细胞的半数抑制浓度(IC50)。(3)Annexin V-FITC测定细胞凋亡情况:选择对数生长期细胞,胰酶消化后按5×105/孔接种于6孔板中,置于培养箱中过夜。第2天按处理因素不同,设置对照组和复方组,每组3个复孔,对照组每孔加入2 ml新鲜培养液,复方组每孔加入新鲜培养液配制的1.5 mg/ml RRC药液2 ml。48 h后,按Annexin V-FITC细胞凋亡检测试剂盒说明书,收集细胞,以CytoFLEX流式细胞仪检测细胞凋亡情况,以FlowJo V10分析凋亡检测数据。(4)RT-qPCR检测细胞凋亡相关基因的mRNA表达:细胞铺板、分组和用药同(3)。用药48 h后吸弃培养液,PBS漂洗后加入0.5 ml/孔TRIzol裂解细胞,提取细胞总RNA并测定浓度,将其中的mRNA逆转录为cDNA(37℃ 15 min,85℃ 5 s);实时荧光定量PCR扩增cDNA,反应条件为95℃ 3 min,95℃ 30 s,60℃ 30 s,40个循环。以GAPDH作为内参,采用2-ΔΔCT法计算mRNA相对表达量,并计算BCL2/BAX比值。Primer3(v.0.4.0)在线软件设计引物,序列见表1。

表1 引物序列
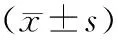
2 结果
2.1 RRC的活性成分和治疗HCC的潜在靶点筛选 黄连、大黄和肉桂共检索到化合物244个,其中符合筛选条件的化合物34个,见表2。筛选出的RRC活性成分中有25个化合物检索到作用靶点,去重后得到234个靶点,排除其中5个未在Uniprot数据库找到对应记录的靶点后,与Genecards中检索到的7 100个HCC相关基因取交集,得到190个RRC治疗HCC的潜在靶点。RRC-成分-HCC靶点网络见图1。其中,每个成分均对应多个靶点,每个靶点又受多个成分调控,其中HL1(quercetin,槲皮素)作用的靶点最多。

图1 RRC-成分-肝癌靶点网络图
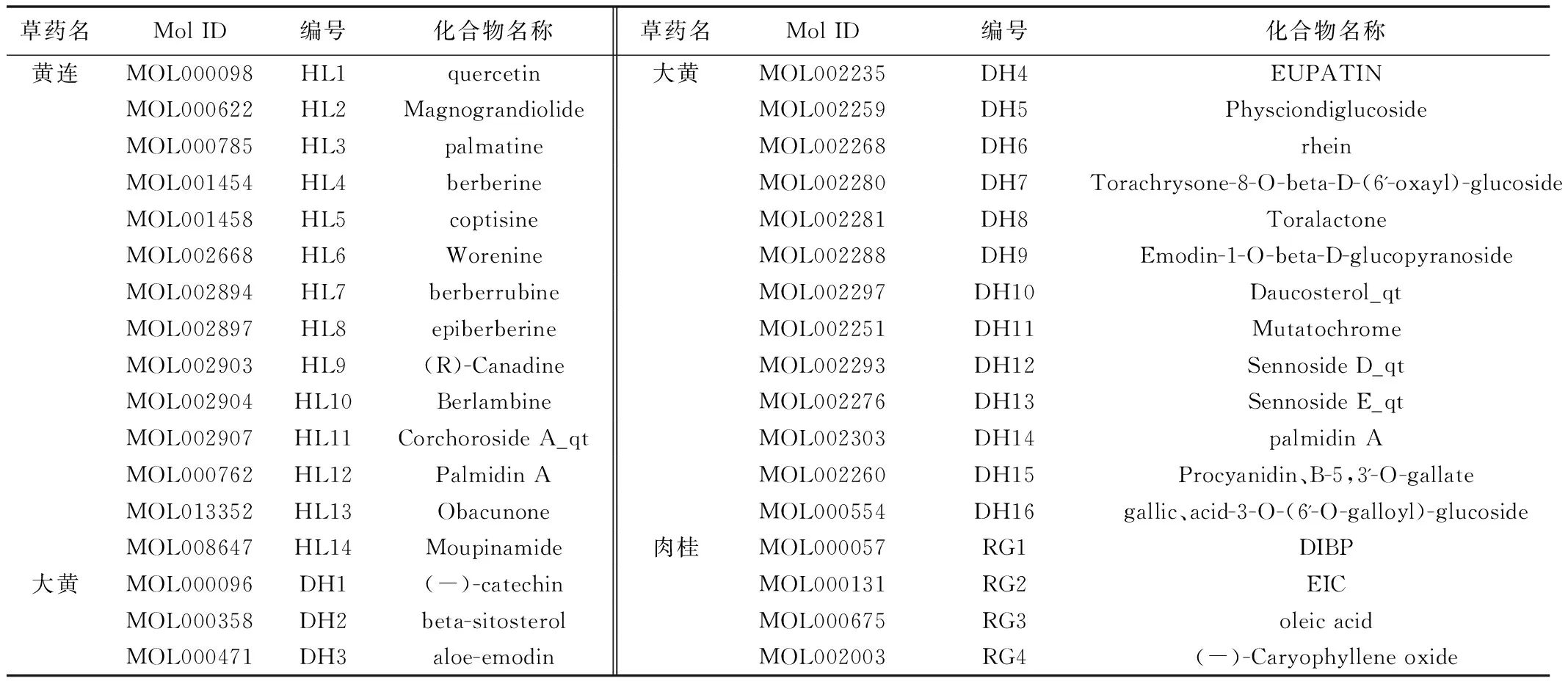
表2 RRC中符合筛选条件的化合物
2.2 潜在靶点的GO与KEGG通路富集 根据P<0.01的筛选条件,GO富集分析得到GO条目共281条,其中细胞组成(CC)21条、生物过程(BP)209条、分子功能(MF)51条。按富集基因数量降序排列后,分别选取BP、CC和MF富集基因数前20、6和12的条目绘制柱状图,BP中P值最小的是凋亡信号通路,以及程序性细胞死亡正调控和凋亡信号通路调控等与细胞凋亡密切相关的条目,见图2。KEGG通路富集分析显示富集基因数最多的通路为癌症通路,包含与细胞凋亡、周期等密切相关的基因,见图3。
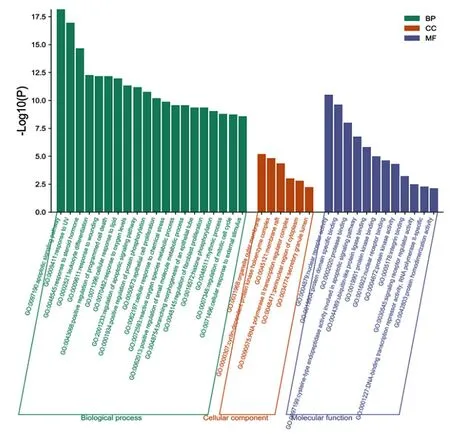
图2 潜在靶点的GO富集分析结果
GO和KEGG通路富集结果均显示,细胞凋亡通路可能是RRC治疗HCC的主要靶标,进一步反向寻找靶向凋亡的复方成分及对应的靶点,发现中药成分主要是黄连中的槲皮素(quercetin),大黄中的β-谷甾醇(beta-sitosterol)和芦荟大黄素(aloe-emodin),其靶向的凋亡分子主要是CASP9、CASP8、CASP3、BCL2、BAX等。
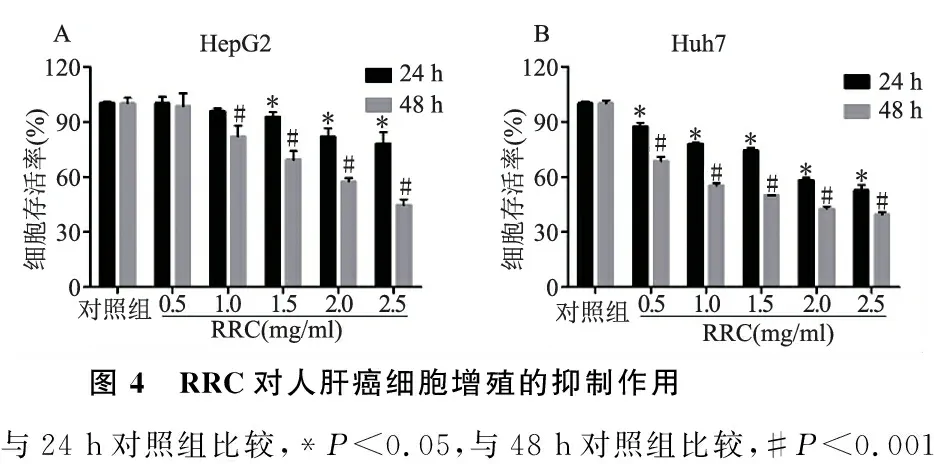
2.3 RRC对人肝癌细胞增殖的抑制作用 与对照组比较,不同浓度的RRC作用24 h和48 h对HepG2(图4A)和Huh7细胞(图4B)的增殖具有不同程度的抑制作用,且呈现时效和量效关系;相同作用时间下,同浓度的RRC对Huh7细胞的增殖抑制优于HepG2细胞,0.5 mg/ml的RRC作用24 h即可显著抑制Huh7细胞的增殖,而1.0 mg/ml作用48 h才可显著抑制HepG2细胞增殖。RRC抑制HepG2和Huh7细胞增殖的IC50分别为2.226 mg/ml和1.395 mg/ml。
2.4 RRC对人肝癌细胞凋亡的影响 与对照组比较,HepG2和Huh7细胞经RRC作用48 h后,其凋亡细胞明显增加(均P<0.001),且药物对HepG2细胞(凋亡约26%)的作用强于Huh7细胞(凋亡约20%)。见图5。
2.5 RRC对人肝癌细胞凋亡相关基因mRNA表达的影响 RRC作用48 h后,HepG2(图6A)和Huh7(图6B)细胞的CASP9、CASP8、CASP3 mRNA表达均不同程度上调,其中CASP9变化幅度较小,CASP8、CASP3 mRNA表达上调比较明显,但均无统计学差异;另外,用药后,BCL2/BAX在HepG2细胞中呈下降趋势,而在Huh7细胞中却显著上升(P<0.01)。

图6 RRC对人肝癌细胞凋亡相关基因mRNA表达的影响与对照组比较,**P<0.01
3 讨论
古典中医文献中并无“肝癌”之病名,据其肝区疼痛、进行性肝肿大、腹胀等临床症状,可将其归为中医痞气、臌胀、胁痛、肝积、积聚、癥瘕等范畴。中医认为,HCC的病机为本虚标实,患者正气不足,局部痰、湿、瘀、毒互结积滞而成肿块。几千年来,基于辨证论治理论,中医药在HCC的防治中发挥着重要的作用,据报道,我国约80%的HCC患者在不同阶段不同程度地使用了中医药治疗[7],HCC不同阶段辨证各有不同,早期多以邪实为主,根据邪实性质不同又有疏肝解郁、清热解毒、活血化瘀等治法[8]。RRC本为课题组前期治疗热盛而阴未伤2型糖尿病的经验方(曾用名“糖尿宁”)[9],方中黄连为君,大黄为臣,共用可起到清热解毒和活血化瘀的作用,方中极少量的肉桂起反佐作用:《四科简效方》记载肉桂可与黄连组成交泰丸,可交通心肾,起到安神的作用;另外肉桂性温,可以佐制大黄、黄连等药的苦寒败胃之性。有文献报道黄连有效成分小檗碱、大黄有效成分大黄素,以及肉桂有效成分桂皮醛等均具有抑制肝癌细胞增殖、诱导凋亡的作用[10-12],但其均为中药单一有效成分的研究,未能有效体现中医整体调节、辨证论治的思想。鉴于此,课题组尝试探索在中医理论指导下组方而成的RRC对肝癌细胞增殖的影响,体外和体内实验均发现其具有较好的抗肝癌效果,机制研究已发现其作用与调节自噬有关[3-6]。本文进一步利用网络药理学和生物分析工具等探索了RRC抗HCC潜在的广泛作用机制,发现其三味中药各自有多种有效成分,共同靶向HCC的190个靶点,相互作用网络图显示每个成分均对应多个靶点,每个靶点又受多个成分调控,即可能靶向复杂的分子生物网络发挥抗GCC的作用,其中细胞凋亡途径可能是其靶向的重要通路之一。
进一步溯源成分-靶点对应关系,发现RRC靶向凋亡途径的成分主要是来自黄连的槲皮素和来自大黄的β-谷甾醇、芦荟大黄素,而肉桂中的4个成分均无作用于凋亡的靶点,这与肉桂在RRC中用量极少,未用其抗肝癌作用,仅用其反佐作用是相一致的。已有研究证明,槲皮素、β-谷甾醇、芦荟大黄素均有抑制肝癌细胞增殖和诱导肝癌细胞凋亡的作用[13-15],但三者两两配伍或三者配伍在一起对HCC的防治作用是否具有协同作用,尚无文献报道,有待进一步研究。
众所周知,死亡受体介导的外源性凋亡途径和线粒体介导的内源性凋亡途径是细胞凋亡的两个进化保守的信号转导途径,其中CASP8是前者的执行者,CASP9是后者的执行者,而CASP3是两者最终的凋亡执行分子之一;抑凋亡成员BCL2和促凋亡成员BAX则可通过改变线粒体膜上原有孔道或通道调控内源性凋亡途径,两者构成比例常用以评价此类凋亡的程度。本研究体外实验显示,RRC能显著促进HepG2和Huh7细胞的凋亡,且对前者的作用强于后者。RRC对两种细胞中凋亡分子CASP9、CASP8、CASP3的作用具有一致性,但对两者BCL2/BAX比值的影响存在差异,该比值在HepG2中下降,而在Huh7细胞中上升,提示RRC可不同程度的诱导HepG2细胞内源性和外源性凋亡的发生,且以外源性凋亡为主;而在Huh7细胞,主要是诱导外源性凋亡的发生,同时可能还对细胞的内源性凋亡具有抑制作用。这也可以解释为什么相同浓度RRC作用下Huh7存活细胞低于HepG2细胞,而凋亡细胞比例却是Huh7低于HepG2,提示RRC导致Huh7细胞存活较低的原因,不仅与导致部分细胞凋亡有关,同时可能还有其他原因导致其死亡细胞较HepG2细胞多,具体将有待进一步探索。
综上,RRC成分复杂,治疗HCC具有多靶点和多通路的作用特点,其中凋亡通路可能是其作用的主要途径之一,发挥抗凋亡作用的成分可能是其中的槲皮素、β-谷甾醇和芦荟大黄素,外源性的凋亡途径可能是其作用的主要靶点。值得注意的是,网络药理学分析同时富集到的凋亡途径之外的一些分子,可能也是RRC抗HCC的作用靶点,后续值得进一步探索。
