牛血清白蛋白/壳聚糖双层包覆染料木素脂质体的制备、表征和口服药动学研究
2023-12-25刘万路
刘万路
威海海洋职业学院,山东 威海 264300
染料木素又称染料木黄酮,属于异黄酮类化合物,可从葛根、三叶草、槐角、山豆根等植物中提取得到[1],该成分具有抗肿瘤、降血糖、抗菌、抗动脉粥样硬化等活性[2-4]。研究表明[5],口服染料木素基本无毒副作用,安全性高,具备开发及临床使用价值[1]。染料木素溶解度仅为(3.07±0.01)mg/L[6],油水分配系数(lgP)为1.45[7],属于生物药剂学分类系统中II 类药物[6]。染料木素胃肠道内易被代谢[8],稳定性差,绝对生物利用度仅为6.8%[9],严重影响药效及临床应用。目前染料木素制剂研究报道有包合物[10]、固体分散体[11]、自微乳[12]等,但包合物或固体分散体在改善药物生物利用度或药效等方面低于纳米制剂[13],而染料木素纳米自微乳处方中存在大量表面活性剂,安全性存疑,故需要开发一种安全性好、生物利用度高的染料木素纳米制剂。
普通脂质体是一种具有磷脂双层分子层结构、类生物膜的纳米囊泡,可在一定程度上提高生物利用度[14-17]。但普通脂质体易受胃肠道pH 值、各种酶及胆盐破坏[18],从而发生乳化、水解等,导致药物泄露,因此对脂质体表面修饰是提高体内稳定性及储存稳定性的有效方法[18-19]。壳聚糖具有良好生物可降解性和生物相容性,其正电荷可与带负电荷的脂质体表面相互作用,进而实现有效包覆[20]。但壳聚糖的酸膨胀性和碱不溶性容易导致壳聚糖包覆脂质体结构不稳定[21],为解决壳聚糖修饰脂质体的缺陷,本研究利用白蛋白负电荷性质与壳聚糖正电性进行静电组装[22],进一步修饰脂质体,进而实现双层修饰,赋予脂质体更好的生物相容性、结构稳定性及缓释效果。
Box-Behnken 设计-响应面法(Box Behnken design-response surface method,BBD-RSM)作为一种工艺优化工具,具有精确、高效等特点。本研究采用BBD-RSM 优化染料木素脂质体(genistein liposomes,Gen-Lip)处方,并进一步制备成壳聚糖包覆染料木素脂质体(chitosan-coated genistein liposomes,CS-Gen-Lip)和牛血清白蛋白/壳聚糖双层包覆染料木素脂质体(bovine serum albumin/chitosan-coated genistein liposomes,BSA/CS-Gen-Lip),示意图见图1。对BSA/CS-Gen-Lip 冻干粉中药物晶型、体外释药行为、储存稳定性等进行考察,并以染料木素原料药为参考,比较BSA/CS-Gen-Lip相对口服生物利用度,为下一步研究工作奠定基础。
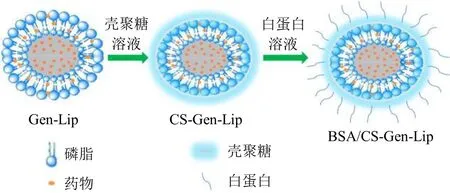
图1 BSA/CS-Gen-Lip 制备工艺示意图Fig. 1 Schematic diagram of BSA/CS-Gen-Lip preparation
1 仪器与材料
1.1 仪器
1200 型高效液相色谱仪(HPLC),美国Agilent公司;RE-52AA 型旋转蒸发仪,绍兴上虞艾科仪器设备有限公司;MS205DU 型电子分析天平,美国Mettler Toledo 公司;RC12A 型溶出试验仪,上海沪粤明科学仪器有限公司;Mastersizer 3000E 型动态光散射粒度仪,英国马尔文公司;CU-600 型电热恒温水浴锅,上海福玛实验设备有限公司;SH-2 型磁力搅拌器,常州市亿能实验仪器厂;JEM-2010F 型透射电镜(TEM),日本日立株式会社;D8 Advance型X 射线粉末衍射仪,瑞士布鲁克公司;NEC160-2A 型氮气吹扫仪,山东星辰科技有限公司;DWFL450 型超低温冰箱,上海沛升仪器设备有限公司;FD-1D-80 型冷冻干燥机,上海贺帆仪器有限公司。
1.2 材料与动物
染料木素对照品,批号K18642,质量分数98.9%,西安开来生物工程有限公司;磺胺甲噁唑,批号100025-200904,质量分数99.6%,中国食品药品检定研究院;磷脂,批号20200811,上海辅必成医药科技有限公司;胆固醇,批号20200719,克拉玛尔公司;壳聚糖,批号20210714,相对分子质量100 000,上海阿拉丁生化科技股份有限公司;染料木素原料药(批号200528,质量分数97.1%)、牛血清白蛋白(批号20221106),湖北帝柏化工有限公司;乳糖,批号20191105,国药集团化学试剂有限公司。
清洁级SD 大鼠,雌雄各半,河南省动物实验中心[SCXK(豫)2020-0001],体质量为180~220 g。所有动物实验遵循威海海洋职业学院有关实验动物管理和使用的规定,均符合3R 原则。
2 方法与结果
2.1 Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 制备过程
薄膜分散法制备Gen-Lip[16-17]。精密取染料木素20 mg 和处方量脂质载体(磷脂和胆固醇)置于圆底烧瓶中,加入50 mL 的无水乙醇-三氯甲烷(6∶4)溶剂,于50 ℃下磁力搅拌(800 r/min)至溶解澄清,置于45 ℃旋蒸仪中(30 r/min)缓慢除去有机溶剂,即在圆底烧瓶壁上形成均匀薄膜。加入一定pH 值水相溶液50 mL,于一定温度下磁力搅拌(800 r/min),使之充分水化,超声15 min(功率为200 W),使用0.45 μm 水膜滤过,即得Gen-Lip 混悬液。加入一定质量浓度壳聚糖溶液制备CS-Gen-Lip 混悬液[20],加入一定质量浓度的牛血清白蛋白制备BSA/CS-Gen-Lip 混悬液[22]。空白脂质体同法制备(不含染料木素)。
2.2 染料木素含量的测定
2.2.1 色谱条件 色谱柱为Waters C18柱(250 mm×4.6 mm,5 µm);柱温为30 ℃;流动相为甲醇-水(30∶70);检测波长为260 nm;体积流量为1.0 mL/min;进样量为10 µL;理论塔板数以染料木素计不低于6000。
2.2.2 线性关系考察 精密称取染料木素对照品20 mg,置于100 mL 量瓶中,加入80 mL 甲醇超声溶解,静置10 min,用甲醇稀释至刻度得200 µg/mL染料木素对照品储备液。用流动相稀释配制10.00、5.00、2.00、1.00、0.50、0.02 µg/mL 一系列染料木素对照品溶液,按“2.2.1”项下色谱条件进样测定染料木素各个质量浓度(X)的峰面积(Y),以峰面积对质量浓度进行线性回归,得线性回归方程Y=13.682 7X+0.824 3,r=0.999 9,结果表明染料木素在0.02~10.00 µg/mL 线性关系良好。
2.2.3 Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 供试品溶液的制备 精密量取Gen-Lip 混悬液1 mL,加至50 mL 容量瓶中,加入40 mL 甲醇超声5 min后定容,过0.45µm 微孔滤膜(前3 滴弃去)。取5 mL 续滤液置于10 mL 量瓶中,加入流动相稀释定容,即得Gen-Lip 供试品溶液。CS-Gen-Lip 和BSA/CS-Gen-Lip 供试品溶液同法制备。
2.2.4 专属性考察 按“2.2.3”项下方法制备阴性供试品溶液。另取染料木素对照品溶液、Gen-Lip、CS-Gen-Lip、BSA/CS-Gen-Lip 供试品溶液,按“2.2.1”项下色谱条件进样分析,色谱图见图1。发现该色谱条件专属性较高。
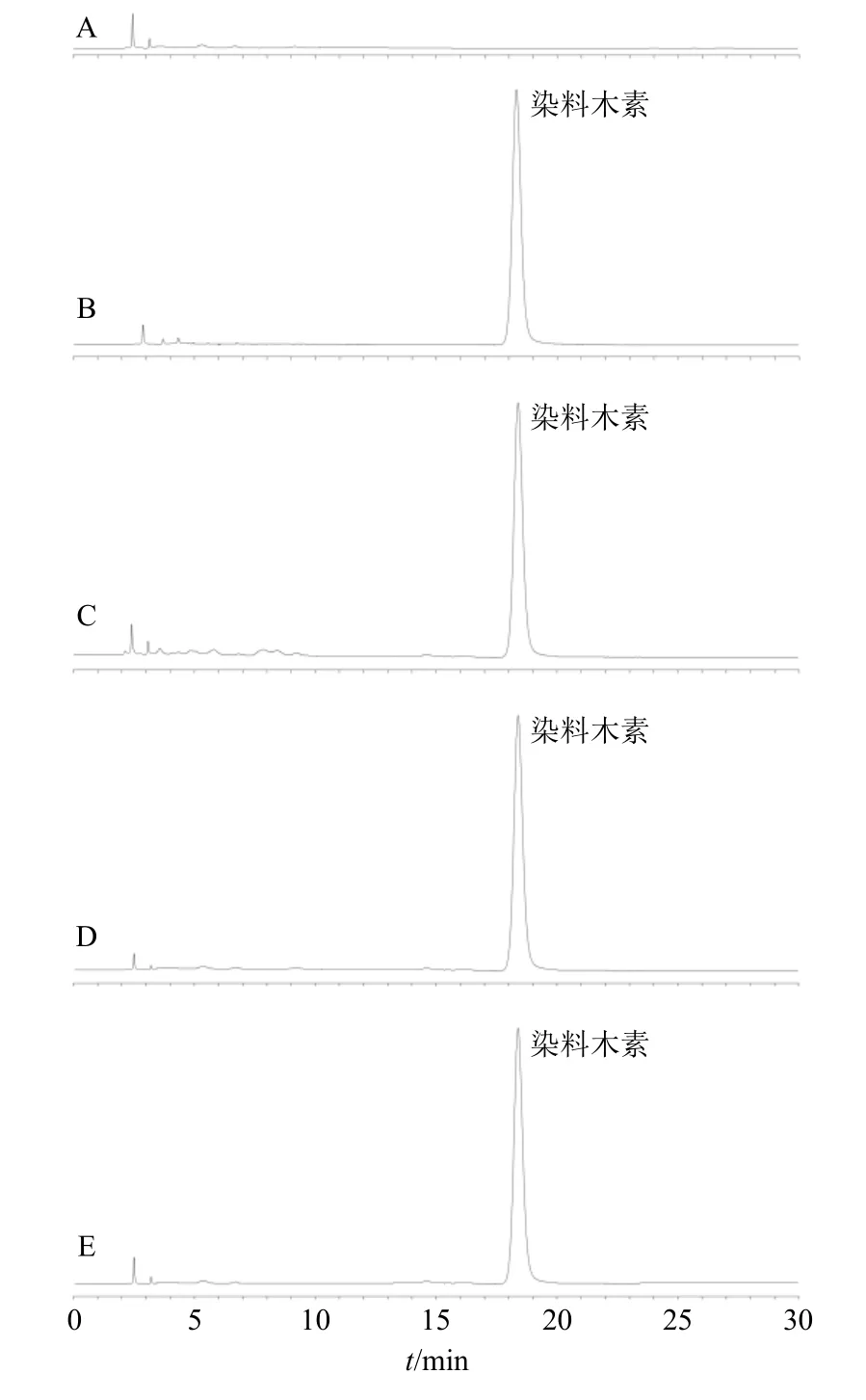
图1 空白辅料 (A)、染料木素对照品 (B)、Gen-Lip (C)、CS-Gen-Lip (D)、BSA/CS-Gen-Lip (E) 供试品溶液的HPLC 图Fig. 1 HPLC of blank excipients (A), genistein reference substance (B), Gen-Lip (C), CS-Gen-Lip (D), BSA/CS-Gen-Lip (E) sample solution
2.2.5 精密度考察 取低、中、高质量浓度(0.02、2.00、10.00 µg/mL)染料木素对照品溶液各6 份,按“2.2.1”项下色谱条件进样分析,测得染料木素峰面积的RSD 分别为0.36%、0.28%、0.20%,表明该仪器精密度良好。
2.2.6 稳定性考察 取Gen-Lip、CS-Gen-Lip、BSA/CS-Gen-Lip 供试品溶液,分别于制备后0、2、4、6、12、24 h 进样测定,计算得染料木素峰面积的RSD 分别为0.92%、1.17%、1.24%,结果表明3 种供试品溶液稳定性均良好。
2.2.7 重复性考察 按照“2.2.3”项下方法分别制备6 份Gen-Lip、CS-Gen-Lip、BSA/CS-Gen-Lip 供试品溶液,按“2.2.1”项下色谱条件进样分析,测得Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 中染料木素质量分数的RSD 分别为1.72%、1.34%、0.96%,表明该方法重复性良好。
2.2.8 加样回收率考察 精密取9 份体积为0.5 mL的Gen-Lip 混悬液,分别加入染料木素储备液(质量浓度为200 µg/mL)0.5、1.0、1.5 mL 制备供试品溶液,分别平行3 份。CS-Gen-Lip 和BSA/CS-Gen-Lip 同法操作,按“2.2.1”项下色谱条件进样分析,测得Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 中染料木素的平均加样回收率分别为 99.40%、100.89%、99.79%,RSD 分别为1.47%、0.94%、1.11%,结果表明该实验准确度较高。
2.3 包封率、载药量、粒径及ζ 电位的测定
精密取Gen-Lip 混悬液2 mL,离心机温度为4 ℃,于12 500 r/min 离心(离心半径6.8 cm)30 min。取上清液测定游离染料木素量(记作W1)。按照“2.2.3”项下方法处理样品,进HPLC 测定染料木素总量(W0)。CS-Gen-Lip 和BSA/CS-Gen-Lip 的W1和W0同法测定,按下式计算包封率和载药量。
W代表染料木素、脂质材料和修饰材料总量
取Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 混悬液各0.1 mL,蒸馏水稀释50 倍,取适量置于比色皿中,于粒径分析仪上分别测定粒径、多分散指数(polydispersity index,PDI)及ζ 电位。
2.4 单因素考察Gen-Lip 处方工艺
2.4.1 脂药比的考察 固定染料木素投药量为20 mg,磷脂与胆固醇比例为10∶1,水相pH 值为6.5,水化温度为40 ℃,水化时间为1.5 h 条件下考察脂药比的影响,结果见表1。随着脂质用量增加,Gen-Lip 包封率呈增加后趋稳情况,说明磷脂用量对药物的包载程度是有限的[16],过多脂质用量也会影响Gen-Lip 载药量。Gen-Lip 粒径在200~250 nm,PDI值均小于0.3,可见脂药比对Gen-Lip 包封率和载药量影响较大,需继续优化。
表1 脂药比的考察 (±s, n = 3)Table 1 Investigation of lipid-drug ratio (±s, n = 3)
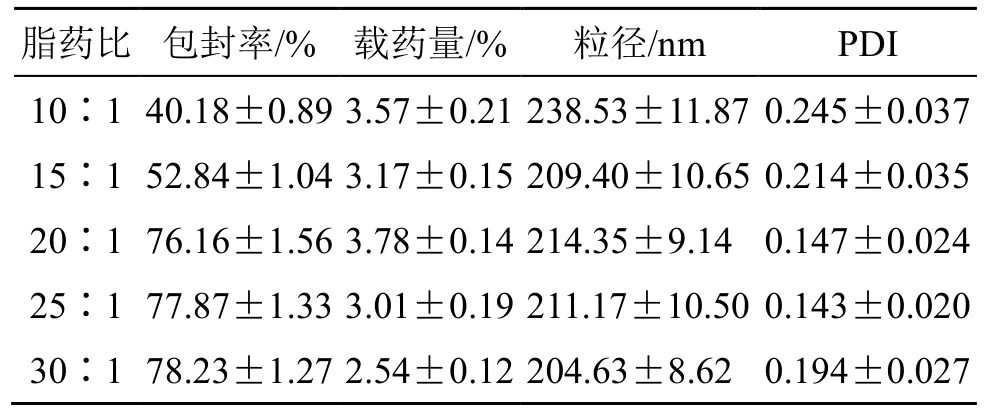
表1 脂药比的考察 (±s, n = 3)Table 1 Investigation of lipid-drug ratio (±s, n = 3)
脂药比 包封率/% 载药量/% 粒径/nm PDI 10∶1 40.18±0.89 3.57±0.21 238.53±11.87 0.245±0.037 15∶1 52.84±1.04 3.17±0.15 209.40±10.65 0.214±0.035 20∶1 76.16±1.56 3.78±0.14 214.35±9.14 0.147±0.024 25∶1 77.87±1.33 3.01±0.19 211.17±10.50 0.143±0.020 30∶1 78.23±1.27 2.54±0.12 204.63±8.62 0.194±0.027
2.4.2 磷脂与胆固醇比例的考察 固定染料木素投药量为20 mg,脂药比20∶1,水相pH 值为6.5,水化温度为40 ℃,水化时间为1.5 h 条件下考察磷脂与胆固醇比例的影响,结果见表2。随着磷脂比例增加,Gen-Lip 包封率和载药量均先增加后下降,可能是由于胆固醇比例过大时导致脂质体超负荷,影响囊泡结构的形成[17];胆固醇比例较小时脂质体稳定性差,药物易泄露。Gen-Lip 粒径在200~250 nm,PDI 值均小于0.3,可见磷脂与胆固醇比例对Gen-Lip 包封率和载药量有较大影响,需继续优化。
表2 磷脂与胆固醇比例的考察 (±s, n = 3)Table 2 Investigation of phospholipid-cholesterol ratio(±s, n = 3)
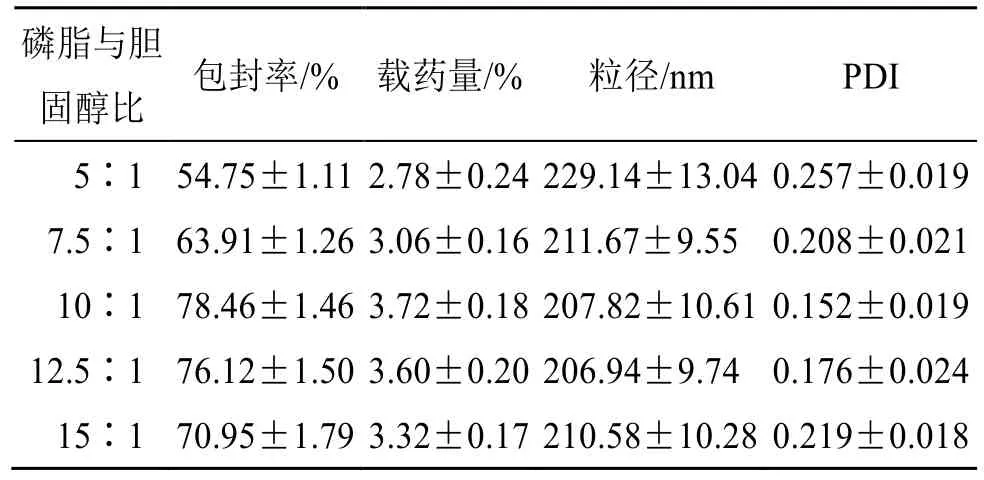
表2 磷脂与胆固醇比例的考察 (±s, n = 3)Table 2 Investigation of phospholipid-cholesterol ratio(±s, n = 3)
磷脂与胆固醇比 包封率/% 载药量/% 粒径/nm PDI 5∶1 54.75±1.11 2.78±0.24 229.14±13.04 0.257±0.019 7.5∶1 63.91±1.26 3.06±0.16 211.67±9.55 0.208±0.021 10∶1 78.46±1.46 3.72±0.18 207.82±10.61 0.152±0.019 12.5∶1 76.12±1.50 3.60±0.20 206.94±9.74 0.176±0.024 15∶1 70.95±1.79 3.32±0.17 210.58±10.28 0.219±0.018
2.4.3 水相pH 值的考察 固定染料木素投药量为20 mg,脂药比20∶1,磷脂与胆固醇比例10∶1,水化温度为40 ℃,水化时间为1.5 h 条件下考察水相pH 值影响,结果见表3。随着水相pH 值的增加Gen-Lip 包封率和载药量总体呈增加趋势,可能是由于脂质体主要材料在低pH 值中稳定性较差,进而影响载药,但水相pH 值过高时会使Gen-Lip 粒径和PDI 值增大[23]。综合考虑,确定pH 值为6.5。
表3 水相pH 值的考察 (±s, n = 3)Table 3 Investigation of aqueous pH value (±s, n = 3)
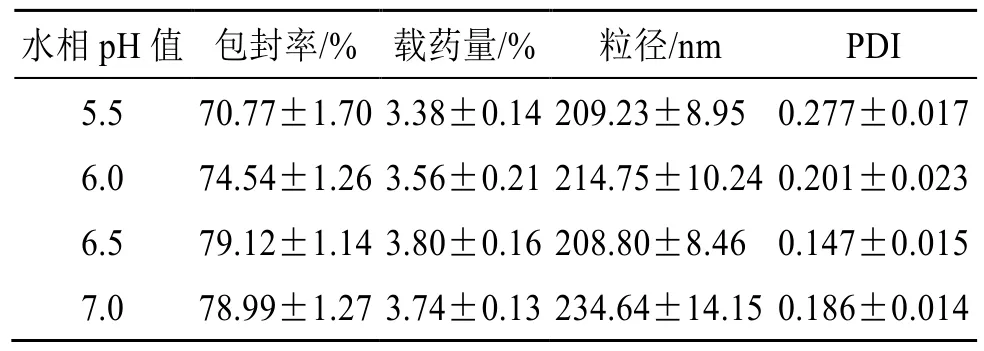
表3 水相pH 值的考察 (±s, n = 3)Table 3 Investigation of aqueous pH value (±s, n = 3)
水相pH 值 包封率/% 载药量/% 粒径/nm PDI 5.5 70.77±1.70 3.38±0.14 209.23±8.95 0.277±0.017 6.0 74.54±1.26 3.56±0.21 214.75±10.24 0.201±0.023 6.5 79.12±1.14 3.80±0.16 208.80±8.46 0.147±0.015 7.0 78.99±1.27 3.74±0.13 234.64±14.15 0.186±0.014
2.4.4 水化温度的影响 固定染料木素投药量为20 mg,脂药比20∶1,磷脂与胆固醇比例10∶1,水相pH 值为6.5,水化时间为1.5 h 条件下考察水化温度的影响,结果见表4。随着水化温度的升高Gen-Lip 包封率和载药量呈先增加后下降趋势,可能是由于水化温度较低时无法引发磷脂相变[17],脂质膜吸水溶胀较差,不利于Gen-Lip 载药。水化温度过高时可能会影响磷脂稳定性,同时脂质体膜通透性及流动性均易增大[20],进而影响载药,且粒径和PDI 值变大。综合考虑,确定水化温度为40 ℃。
表4 水化温度的考察 (±s, n = 3)Table 4 Investigation of hydration temperature (±s, n = 3)

表4 水化温度的考察 (±s, n = 3)Table 4 Investigation of hydration temperature (±s, n = 3)
水化温度/℃ 包封率/% 载药量/% 粒径/nm PDI 30 65.41±1.20 3.07±0.24 192.44±9.11 0.229±0.018 35 69.78±1.36 3.36±0.17 204.81±10.25 0.194±0.015 40 78.85±1.51 3.77±0.20 209.07±11.01 0.157±0.024 45 75.24±1.17 3.59±0.25 223.83±10.45 0.186±0.021 55 68.96±1.08 3.43±0.15 239.41±13.84 0.219±0.023
2.4.5 水化时间的影响 固定染料木素投药量为20 mg,脂药比20∶1,磷脂与胆固醇比例10∶1,水相pH 值为6.5,水化温度为40 ℃条件下分别考察水化时间的影响,结果见表5。随着水化时间的增加Gen-Lip 包封率和载药量先增加后下降,可能是由于水化时间较短时磷脂吸水溶胀不充分,影响Gen-Lip 载药。水化时间过长可能会影响磷脂稳定性,进而影响载药[17],同时粒径和PDI 值有变大趋势。可见水化时间对Gen-Lip 包封率和载药量有较大影响,故需继续优化。
表5 水化时间的考察 (±s, n = 3)Table 5 Investigation of hydration time (±s, n = 3)

表5 水化时间的考察 (±s, n = 3)Table 5 Investigation of hydration time (±s, n = 3)
水化时间/h 包封率/% 载药量/% 粒径/nm PDI 0.5 55.14±1.04 2.59±0.14 198.17±9.17 0.249±0.026 1.0 59.87±0.99 2.86±0.20 210.55±10.52 0.191±0.015 1.5 80.04±1.18 3.80±0.17 203.68±11.07 0.160±0.013 2.0 77.89±1.40 3.63±0.22 214.94±11.99 0.192±0.017 2.5 74.16±1.69 3.51±0.15 238.03±12.51 0.241±0.023
2.5 BBD-RSM 优化Gen-Lip 处方
2.5.1 试验方案 根据“2.4”项下考察结果,发现脂药比、磷脂与胆固醇比及水化时间对Gen-Lip 包封率和载药量影响较大,故将脂药比、磷脂与胆固醇比及水化时间分别作为自变量X1、X2和X3,包封率和载药量分别作为响应值Y1和Y2,设计BBDRSM 优化Gen-Lip 处方工艺。各个自变量水平见表6,分别制备不同处方工艺下的Gen-Lip(分别平行制备3 批),测定包封率及载药量,取平均值(RSD值大于2%时重新进行实验),结果见表6。
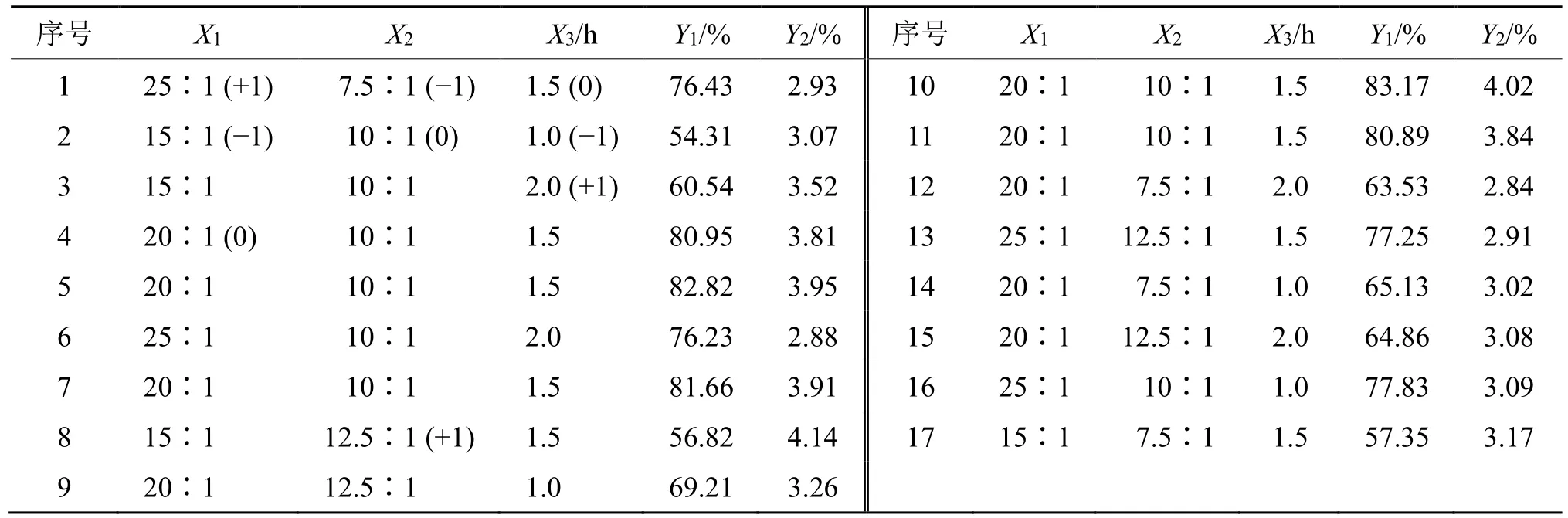
表6 BBD-RSM 试验设计与结果 (n = 3)Table 6 Experiment designs and results of Box-Behnken (n = 3)
2.5.2 模型的建立以及分析 利用Design Expert V 8.0.6 软件进行多元回归拟合,得Gen-Lip 包封率Y1的二次多元回归方程为Y1=81.900+9.840X1+0.710X2-0.160X3+0.340X1X2-1.960X1X3-0.690X2X3-6.70X12-8.240X22-7.980X32,方程R2=0.986 8,Radj2=0.969 9;Gen-Lip 载药量Y2的二次多元回归方程为Y2=3.91-0.140X1+0.054X2-0.015X3+2.50×10−3X1X2-0.170X1X3+0.001X2X3-0.390X12-0.480X22-0.380X32方程R2=0.960 9,Radj2=0.950 7。方程拟合相关系数均高于0.9,模型P值均具极显著性差异(P<0.01),失拟F值均无显著性差异(P>0.05),故建立的包封率Y1和载药量Y2数学模型可用来预测响应值与参数之间的关系。方程分析结果见表7,方程Y1中X1、X12、X22、X32均具显著性差异;方程Y2中X1、X2X3、X12、X22、X32均具显著性差异。
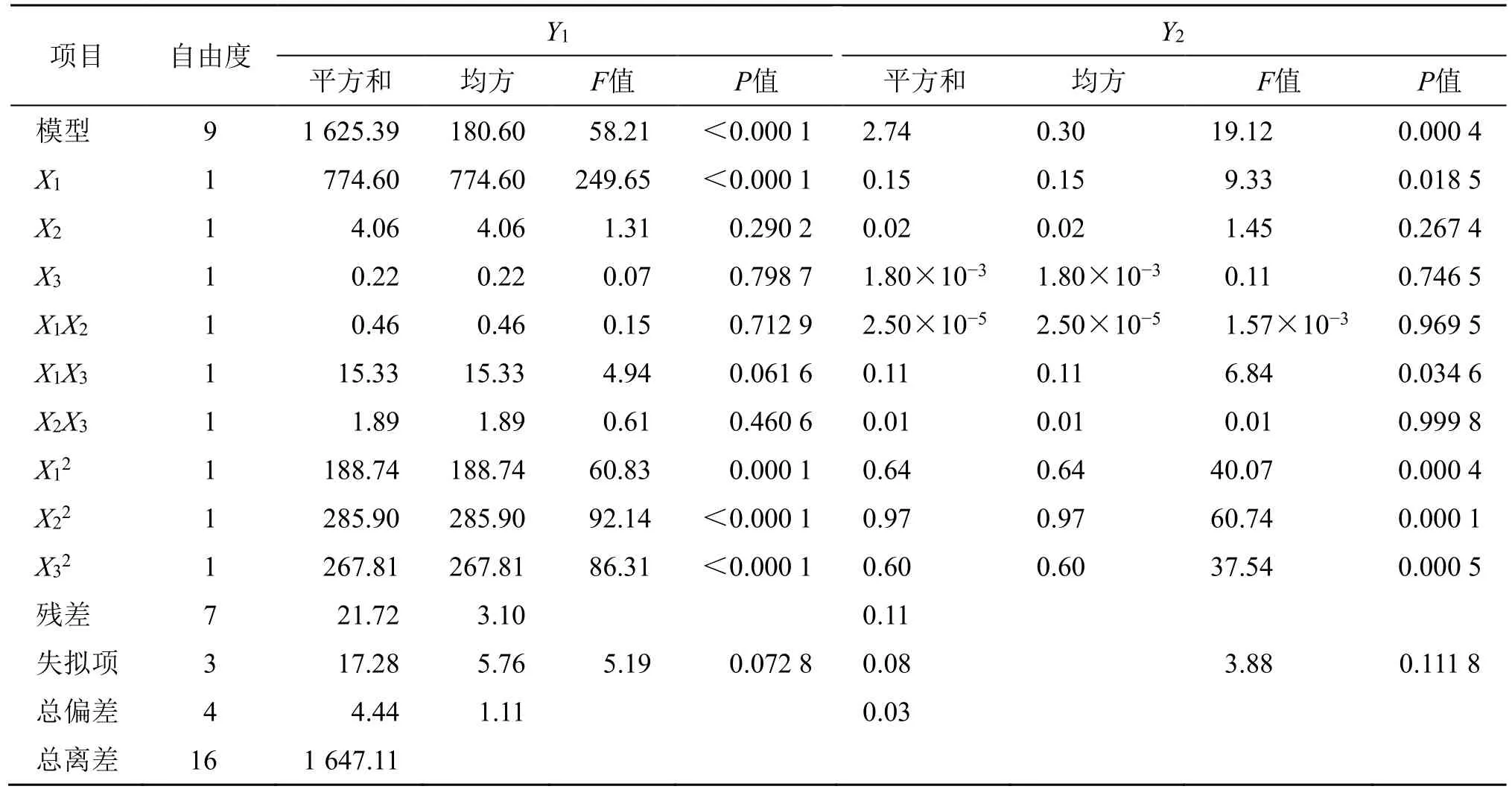
表7 方差分析Table 7 Analysis of variance
2.5.3 效应面优化与最佳处方工艺确定 根据建立的数学模型绘制响应值与自变量的响应面图,结果见图2。当固定某一因素不变时(取中间值),随着脂药比(X1)、磷脂与胆固醇比(X2)及水化时间(X3)增加,染料木素脂质体包封率Y1和载药量Y2均呈先增大后减小趋势。选择Gen-Lip 包封率(区间为50%~100%)和载药量(区间为2%~5%)最大值作为优化目标,得到Gen-Lip 最佳处方为脂药比20.7∶1,磷脂与胆固醇比10.13∶1,水化时间1.48 h,该数学模型预测包封率和载药量分别为83.2%和3.9%。
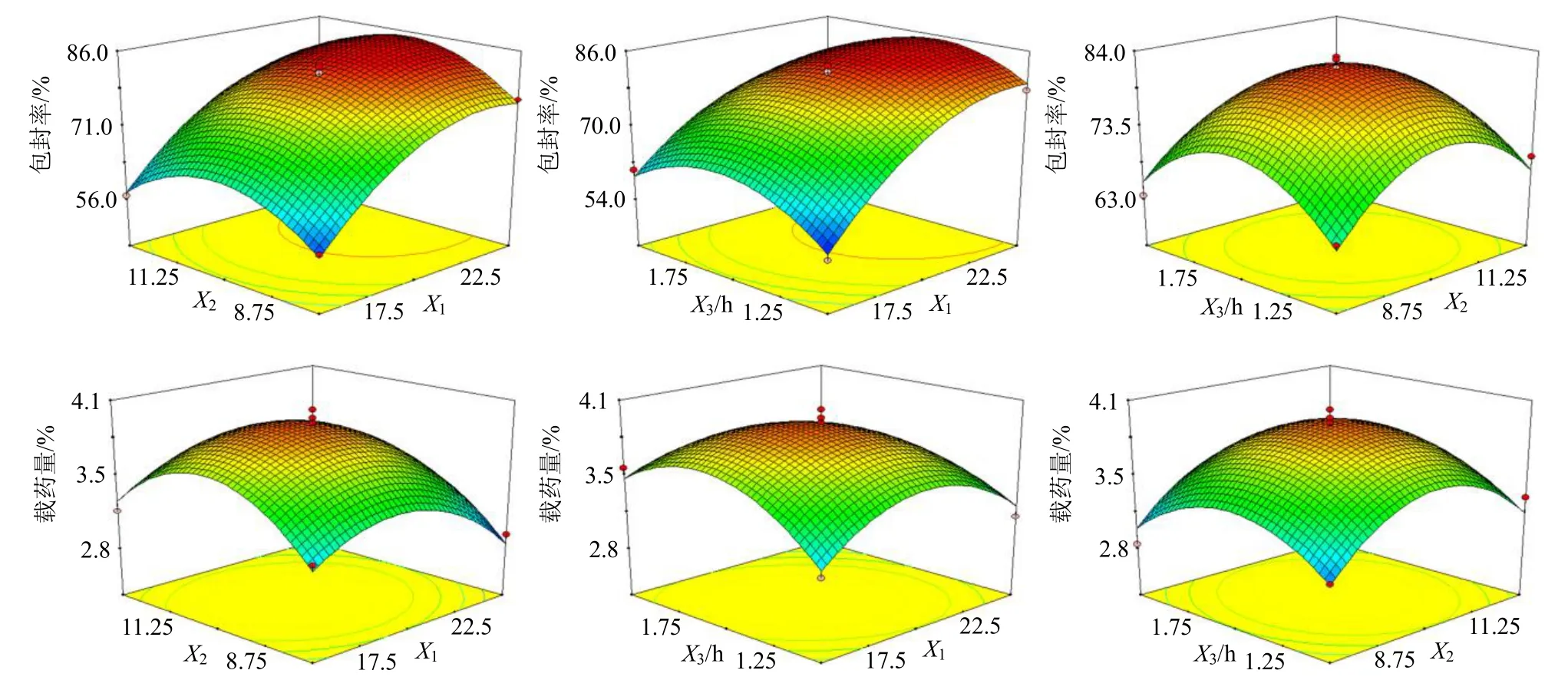
图2 自变量与响应值的三维图Fig. 2 Three-dimensional plots of independent variables and response values
2.6 Gen-Lip 最佳工艺确认及偏差计算
为便于操作,将磷脂与胆固醇比调整为10.1∶1,水化时间调整为1.5 h,而脂药比20.7∶1 保持不变。按调整后的处方工艺平行制备3 批Gen-Lip 样品,按“2.3”项下测定包封率和载药量,并计算实测值与预测值的相对偏差[相对偏差=(实测值-预测值)/预测值]。结果见表8,实测值与预测值相对偏差绝对值均小于±5%,证明建立的包封率和载药量数学模型对Gen-Lip 处方工艺优化具有较高的指导意义。
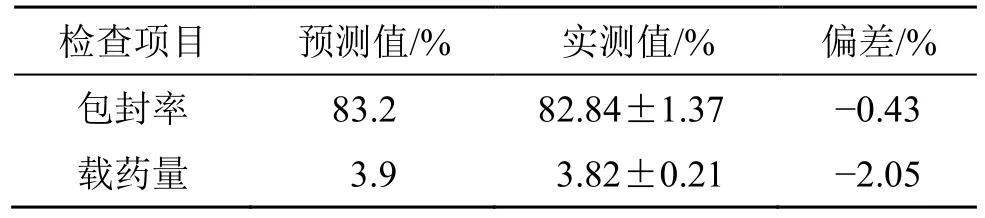
表8 相对偏差结果Table 8 Results of relative deviation
2.7 CS-Gen-Lip 的制备[24]
采用1%乙酸溶液配制不同质量浓度的壳聚糖溶液,备用。精密取Gen-Lip 混悬液50 mL,缓慢加入等体积的壳聚糖溶液,于600 r/min 磁力搅拌2 h,12 500 r/min 离心(离心半径6.8 cm)20 min,弃去上清液,加入pH 值为6.5 磷酸盐缓冲液(PBS)至50 mL,取适量测定CS-Gen-Lip 的ζ 电位,结果见图3。壳聚糖溶液质量浓度大于0.2%后CS-Gen-Lip 的ζ 电位基本恒定,故确定壳聚糖溶液质量浓度为0.2%。
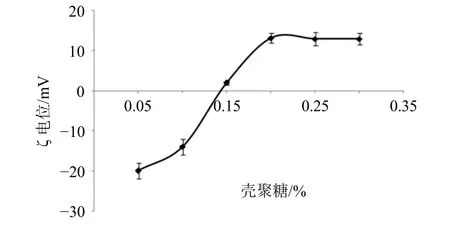
图3 壳聚糖质量浓度对ζ 电位的影响 (±s, n = 3)Fig. 3 Effects of chitosan concentration on ζ potential(±s, n = 3)
2.8 BSA/CS-Gen-Lip 的制备
精密称取一定量的牛血清白蛋白至CS-Gen-Lip 混悬液中,于600 r/min 磁力搅拌2 h,取适量测定BSA/CS-Gen-Lip 的ζ 电位,结果见图4。随着牛血清白蛋白质量浓度的逐渐增加,ζ 电位由正转负,当其质量浓度大于0.5%时ζ 电位基本保持不变,为减少辅料用量,故确定牛血清白蛋白质量浓度为0.5%。
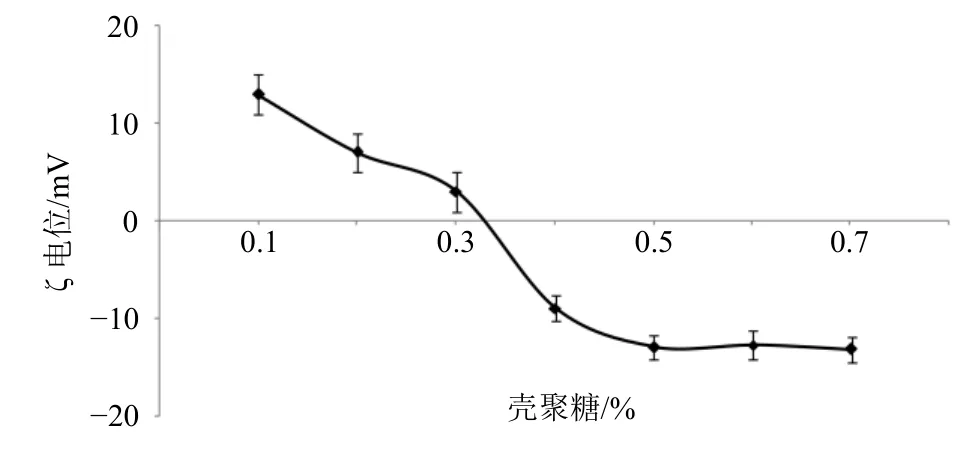
图4 牛血清白蛋白质量浓度对ζ 电位的影响 (±s, n = 3)Fig. 4 Effects of bovine serum albumin concentration on ζ potential (±s, n = 3)
2.9 Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 表征
2.9.1 质量指标的测定 取Gen-Lip、CS-Gen-Lip和BSA/CS-Gen-Lip 混悬液,分别按照“2.3”项下方法测定包封率、载药量、粒径、PDI、ζ 电位,结果见表9。CS-Gen-Lip 和BSA/CS-Gen-Lip 的包封率显著增加(P<0.01),可能是由于壳聚糖和牛血清白蛋白的包覆作用,减少了表层或浅表层药物泄露,同时由于辅料用量的增加导致CS-Gen-Lip 和BSA/CS-Gen-Lip 载药量下降(P<0.05、0.01)。CS-Gen-Lip 和BSA/CS-Gen-Lip 粒径极显著性增大(P<0.01),结果见图5-A,这与壳聚糖和牛血清白蛋白包覆在Gen-Lip 表面有关,同时PDI 值也出现显著性增大(P<0.05)。CS-Gen-Lip ζ 电位转变为正电性(P<0.01),结果见图5-B,这是由于壳聚糖本身带正电荷,包覆于Gen-Lip 表面后改变了ζ 电位的电性。BSA/CS-Gen-Lip 又转变为负电性(P<0.01),这与牛血清白蛋白本身带负电荷有关[18]。
表9 质量指标的测定结果 (±s, n = 3)Table 9 Determination results of quality indicators (±s, n = 3)
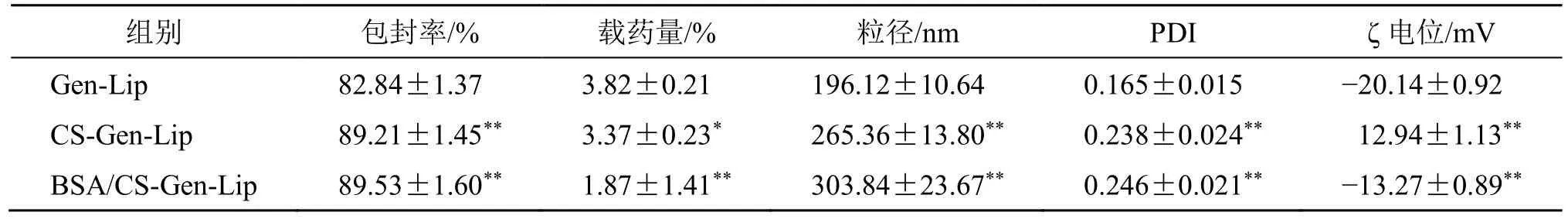
表9 质量指标的测定结果 (±s, n = 3)Table 9 Determination results of quality indicators (±s, n = 3)
与Gen-Lip 比较:*P<0.05**P<0.01*P < 0.05**P < 0.01 vs Gen-Lip
组别 包封率/% 载药量/% 粒径/nm PDI ζ 电位/mV Gen-Lip 82.84±1.37 3.82±0.21 196.12±10.64 0.165±0.015 −20.14±0.92 CS-Gen-Lip 89.21±1.45** 3.37±0.23* 265.36±13.80** 0.238±0.024** 12.94±1.13**BSA/CS-Gen-Lip 89.53±1.60** 1.87±1.41** 303.84±23.67** 0.246±0.021** −13.27±0.89**
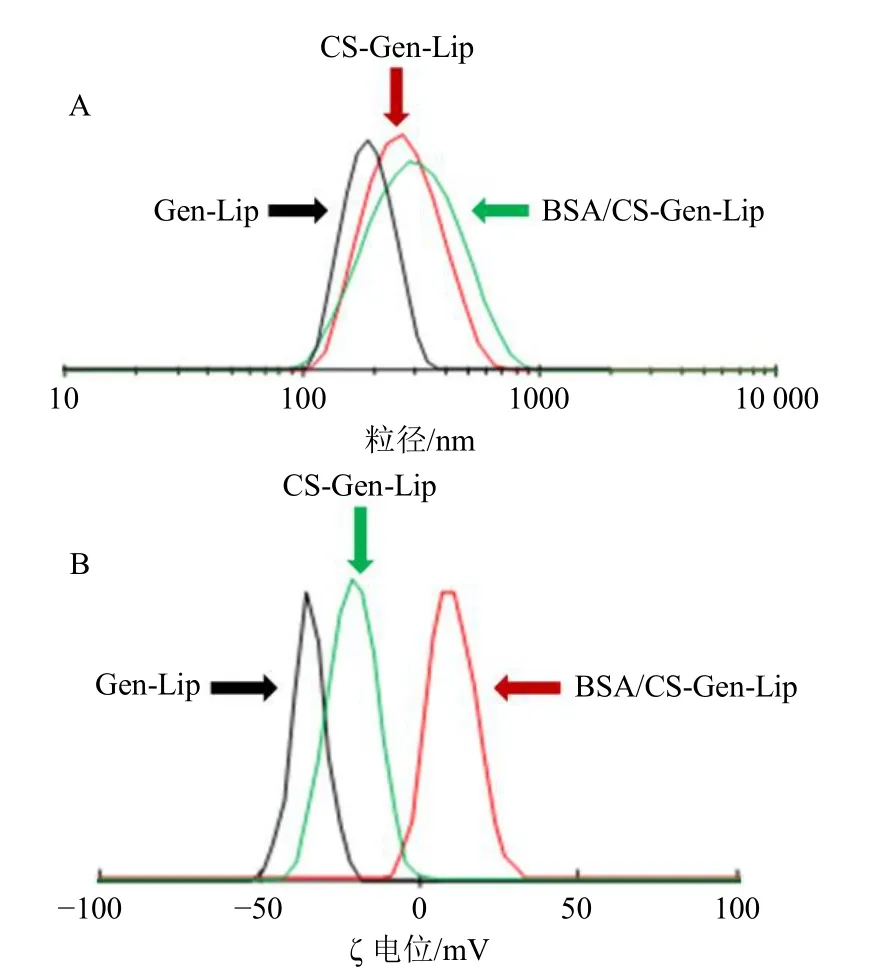
图5 Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 的粒径分布 (A) 和ζ 电位 (B)Fig. 5 Particle size distributions (A) and ζ potentials (B) of Gen-Lip, CS-Gen-Lip and BSA/CS-Gen-Lip
2.9.2 TEM观察3种脂质体微观形态 取Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 混悬液采用蒸馏水稀释50 倍,分别滴至碳膜涂覆的铜网,静置10 min,滴加浓度为1.5%磷钨酸钠溶液进行染色。置于TEM下观察微观形貌,结果见图6,Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 均无黏连现象。

图6 Gen-Lip (A)、CS-Gen-Lip (B) 和BSA/CS-Gen-Lip (C) 的TEM 图Fig. 6 TEM image of Gen-Lip (A), CS-Gen-Lip (B) and BSA/CS-Gen-Lip (C)
2.10 冻干粉的制备
精密量取Gen-Lip、CS-Gen-Lip和BSA/CS-Gen-Lip 混悬液50 mL,分别加入2 g 乳糖,震荡溶解,混匀后分装至西林瓶中。置于−45 ℃超低温冰箱中冷冻2 d,立即置于冷阱温度为−25 ℃的冻干机中,抽真空至0.1 mPa,冷冻2 d 即得冻干粉末,外观见图7,制得的冻干粉外形均饱满,色泽均一。

图7 Gen-Lip (A)、CS-Gen-Lip (B) 和BSA/CS-Gen-Lip 冻干粉 (C) 外观Fig. 7 Appearance of Gen-Lip (A), CS-Gen-Lip (B) and BSA/CS-Gen-Lip lyophilized powder (C)
Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉复溶后平均包封率分别为(80.04±1.62)%、(87.13±1.84)%和(87.02±0.96);粒径分别为(223.89±12.15)、(289.13±27.36)、(294.35±24.16)nm;ζ 电位分别为(−17.68±1.01)、(10.77±0.95)、(−9.90±0.86)mV。测得Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉中染料木素质量分数分别为(0.82±0.03)%、(0.78±0.02)%和(0.68±0.02)%。
2.11 晶型研究
取染料木素原料药、空白辅料、物理混合物(染料木素与空白辅料比例同BSA/CS-Gen-Lip 冻干粉)、Gen-Lip 冻干粉、CS-Gen-Lip 冻干粉、BSA/CSGen-Lip 冻干粉和BSA/CS-Gen-Lip 直接冻干粉(不加乳糖)适量进行XRPD 扫描,测试条件:扫描角度(2θ)为3°~45°,Cu-Kα 靶,扫描速度为3°/min,见图8。染料木素原料药在7.4°、11.1°、11.5°、14.0°、14.8°、15.4°、16.2°、17.7°、22.5°、24.7°等处晶型峰较强,在物理混合物XRPD 图谱中仍可观察到染料木素晶型衍射峰,说明仍以晶型状态存在。在Gen-Lip 冻干粉、CS-Gen-Lip 冻干粉、BSA/CS-Gen-Lip冻干粉和BSA/CS-Gen-Lip 直接冻干粉XRPD 图谱中,染料木素原料药晶型衍射峰均消失,说明染料木素均以无定形状态存在。冻干粉中乳糖在18°~22°的晶型峰强度明显下降,可能是乳糖与脂质体表面形成氢键所致[17]。
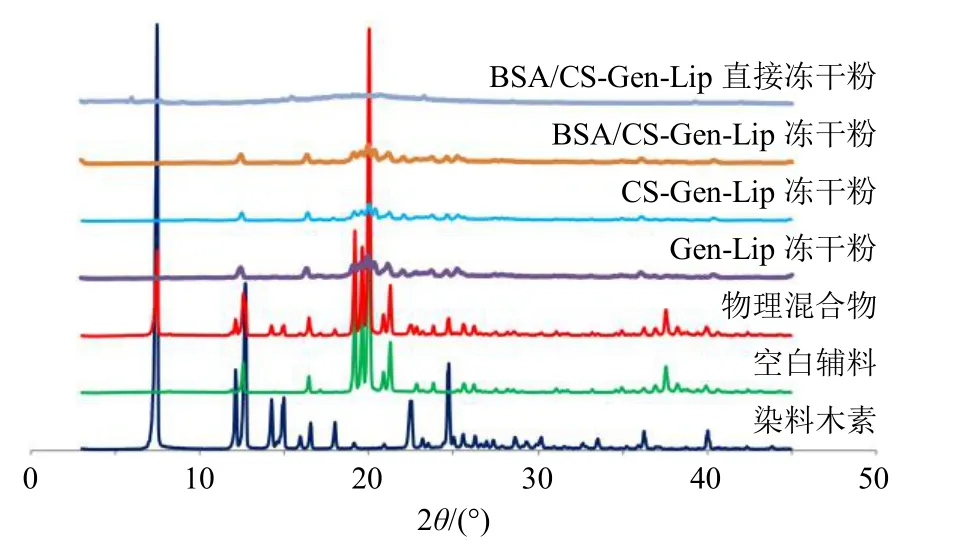
图8 XRPD 结果Fig. 8 XRPD results
2.12 体外释药及释药机制研究
取染料木素原料药、Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉适量(染料木素含量均为10 mg),加入模拟胃液(pH 1.2,含胃蛋白酶)制备混悬液,转移至活化后的透析袋中(截留相对分子质量为10 000),扎紧。采用900 mL 模拟胃液(pH 1.2,含胃蛋白酶,含1%聚山梨酯80)作为释药介质,介质温度为37 ℃,搅拌桨转速为75 r/min,于0、0.5、1.0、1.5、2.0 h 取样3 mL,取样后及时补进3 mL 空白介质。2 h 后立即将释药介质更换为900 mL 模拟肠液(pH 6.8,含胰蛋白酶,含1%聚山梨酯80),于3、4、6、8、12、18、24 h 取样。样品经12 500 r/min 离心(离心半径6.8 cm)30 min进样测定,结果见图9。染料木素原料药由于溶解度较差、颗粒较大等原因导致溶出度很低[11]。Gen-Lip冻干粉在模拟胃肠液中24 h 累积释放度为64.17%,后期出现累积释放度下降情况,可能与Gen-Lip 稳定性较差、染料木素易被降解等因素有关[8,18]。CSGen-Lip 冻干粉和BSA/CS-Gen-Lip 冻干粉在模拟胃肠液中24 h累积释放度分别为72.04%和68.33%,而BSA/CS-Gen-Lip 冻干粉效果更为明显,可能与壳聚糖和牛血清白蛋白双层修饰有关[22]。释药模型拟合见表10,Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉体外释药均符合Weibull 模型。
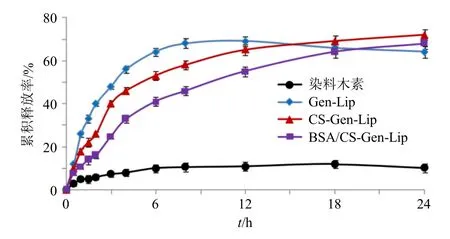
图9 体外释放曲线的比较 (±s, n = 3)Fig. 9 Comparison of drug release profiles in vitro (±s,n = 3)

表10 Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip的Weibull模型方程Table 10 Weibull model equations of Gen-Lip, CS-Gen-Lip and BSA/CS-Gen-Lip
2.13 储存稳定性考察
2.13.1 渗漏率的测定 采用渗漏率来评价稳定性。取Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉密封置于在4 ℃冰箱中,于0、5、10、15、30、45、60、90 d 取样,加入蒸馏水复溶后测定渗漏率[渗漏率=(新制备测得的包封率-储存过程中测得的包封率)/新制备测得的包封率]。结果见表11,Gen-Lip 冻干粉90 d 渗漏率达(9.46±0.38)%,而CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉渗漏率不足1%,表明两者储存稳定性相对较高。
表11 渗漏率测定结果 (±s, n = 3)Table 11 Determination results of leakage rate (±s, n = 3)
t/d Gen-Lip冻干粉CS-Gen-Lip冻干粉BSA/CS-Gen-Lip 冻干粉0 0 0 0 5 0.62±0.14 0.59±0.14 0.61±0.12 10 1.32±0.21 0.64±0.12 0.62±0.08 15 3.16±0.24 0.72±0.10 0.69±0.09 30 4.95±0.29 0.85±0.19 0.74±0.11 45 5.58±0.32 0.89±0.14 0.78±0.13 60 7.37±0.34 0.92±0.15 0.80±0.09 90 9.46±0.38 0.93±0.18 0.81±0.13
2.13.2 氧化指标的测定 取4 ℃条件下放置90 d后的Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉,分别用无水乙醇溶解,使磷脂质量浓度约为0.5 mg/mL,分别测定在波长215 nm 和233 nm 的吸光度(A),并计算氧化指数(氧化指数=A233/A215)。结果见表12,在该存放条件下Gen-Lip 冻干粉氧化指数大于0.2,CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉氧化指数极显著性低于Gen-Lip 冻干粉(P<0.01),表明两者稳定性优于Gen-Lip 冻干粉。
表12 磷脂氧化指数测定结果 (±s, n = 3)Table 12 Determination results of phospholipids oxidation index (±s, n = 3)

表12 磷脂氧化指数测定结果 (±s, n = 3)Table 12 Determination results of phospholipids oxidation index (±s, n = 3)
与Gen-Lip 比较:**P<0.01**P < 0.01 vs Gen-Lip
样品 磷脂氧化指数Gen-Lip 冻干粉 0.221±0.017 CS-Gen-Lip 冻干粉 0.084±0.008**BSA/CS-Gen-Lip 冻干粉 0.082±0.006**
2.14 药动学研究
2.14.1 给药及取血方案 取染料木素原料药、Gen-Lip、CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉,采用0.5%的CMC-Na 水溶液配制ig 液,临用现配。取18 只SD 大鼠禁食12 h,禁食期间可自由饮水,随机分为3 组,每组6 只。记录各只SD 大鼠体质量,按40 mg/kg 剂量ig。于0.25、0.5、1、1.5、2、3、4、6、8、12 h 采用乙醚麻醉大鼠,于眼眶后静脉丛采血约0.25 mL 至肝素浸润离心管中,震荡摇匀后3000 r/min 离心(离心半径6.8 cm)3 min,取上层淡黄色血浆至空白离心管中,冷冻保存。
2.14.2 血浆样品的处理[25]取出血浆室温解冻,精密量取血浆样品100 μL 和50 μL 磺胺甲噁唑(1000 ng/mL)至5 mL 离心管中,加1 mL 乙腈涡旋3 min,8500 r/min 离心10 min。取上清液至空白离心管中,40 ℃氮气流下缓慢吹除有机溶剂,加入100 μL 乙腈,涡旋3 min,8500 r/min 离心(离心半径6.8 cm)10 min,取上清液进样分析。
2.14.3 血浆对照品标准曲线 甲醇配制质量浓度为1000 ng/mL 的磺胺甲噁唑溶液,作为内标。取质量浓度为2 μg/mL 的染料木素对照品溶液,甲醇稀释至1000、500、250、100、50 ng/mL,分别取100 μL 至离心管中,40 ℃温度下缓慢吹除有机溶剂,加入100 μL 空白血浆,涡旋3 min 即得质量浓度为2000、1000、500、250、100、50 ng/mL 一系列染料木素血浆对照品溶液。按“2.14.2”项下方法处理后进样分析。染料木素质量浓度为横坐标(X),染料木素和磺胺甲噁唑峰面积比为纵坐标(Y)作线性回归,得血浆对照品标准曲线方程:Y=0.015 2X+16.994 3,相关系数r=0.995 8,表明染料木素血浆对照品在50~2000 ng/mL 线性关系良好。
2.14.4 专属性试验 取空白血浆、血浆对照品(染料木素质量浓度为50 ng/mL)和血浆样品(Gen-Lip冻干粉ig 给药12 h),按“2.14.2”项下方法处理,按“2.2.1”项下色谱条件进样分析,色谱图见图10,血浆内源性杂质未对染料木素和磺胺甲噁唑产生干扰,专属性较高。
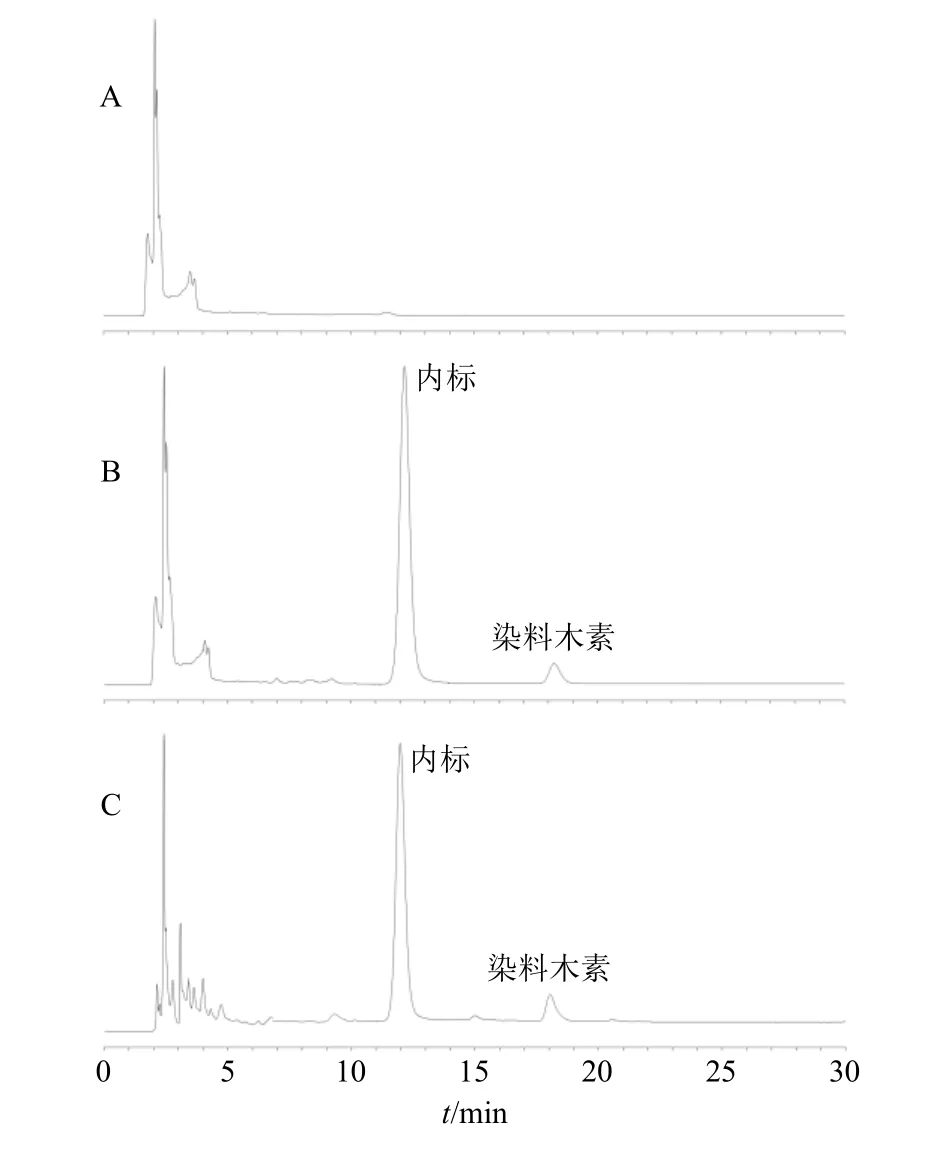
图10 空白血浆 (A)、血浆对照品 (B)、血浆样品溶液 (C)的HPLC 图Fig. 10 HPLC of blank plasma (A), plasma reference (B)and plasma sample solution (C)
2.14.5 精密度考察 分别取质量浓度为50、500、2000 ng/mL 血浆对照品溶液各6 份,分别按“2.2.1”项下色谱条件进样分析,计算得染料木素和磺胺甲噁唑峰面积比值的RSD 分别为2.12%、3.25%、2.81%,结果表明仪器精密度良好。
2.14.6 重复性考察 取质量浓度为500 ng/mL 血浆样品(含内标),按“2.14.2”项下方法平行处理6 份,分别按“2.2.1”项下色谱条件进样测定,计算得染料木素和磺胺甲噁唑峰面积比值的RSD 为8.94%,结果表明该方法重复性良好。
2.14.7 稳定性考察 取Gen-Lip 冻干粉ig 给药12 h 的血浆样品溶液,分别于0、1、3、6、9、12 h 进样测定染料木素和磺胺甲噁唑峰面积,计算得两者峰面积比值的RSD 为7.69%,结果表明血浆样品溶液在18 h 内稳定性良好。
2.14.8 加样回收率考察 配制质量浓度分别为50、500、2000 ng/mL 的染料木素对照品溶液,按“2.14.2”项下方法操作,测定染料木素和磺胺甲噁唑的峰面积,并计算染料木素加样回收率,结果表明染料木素的平均加样回收率为95.20%,RSD 为6.85%,表明该方法准确度较高。
2.14.9 药动学结果 血药浓度-时间曲线见图11。使用DAS 3.0 软件非房室模型计算主要药动学参数,结果见表15。与染料木素相比,Gen-Lip 的Cmax、AUC0~t及AUC0~∞有显著性改变(P<0.05),Cmax和相对口服吸收生物利用度分别提高至1.42 倍和1.45 倍。CS-Gen-Lip 的药动学参数有显著性或极显著性改变(P<0.05、0.01),tmax延后至(2.09±0.60)h,t1/2延长至(5.61±1.01)h,Cmax和相对口服吸收生物利用度分别提高至2.57 倍和3.28 倍。BSA/CSGen-Lip 的药动学参数也有显著性或极显著性改变(P<0.05、0.01),tmax延后至(2.17±0.71)h,t1/2延长至(6.89±1.12)h,Cmax和相对口服吸收生物利用度分别提高至2.33 倍和4.00 倍。与CS-Gen-Lip相比,BSA/CS-Gen-Lip 的t1/2、AUC0~t、AUC0~∞存在显著性差异(P<0.05),说明BSA/CS-Gen-Lip 促吸收作用更大。
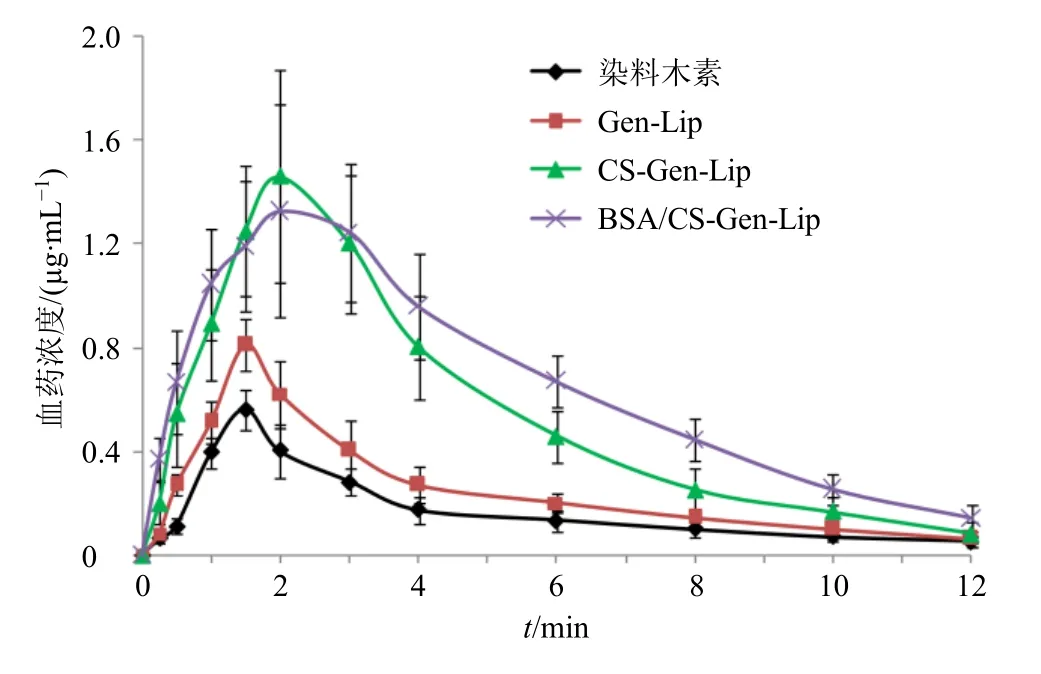
图11 血药浓度-时间曲线 (±s, n = 6)Fig. 11 Drug concentration-time curves (±s, n = 6)
表15 药动学结果 (±s, n = 6)Table 15 Pharmacokinetic results (±s, n = 6)
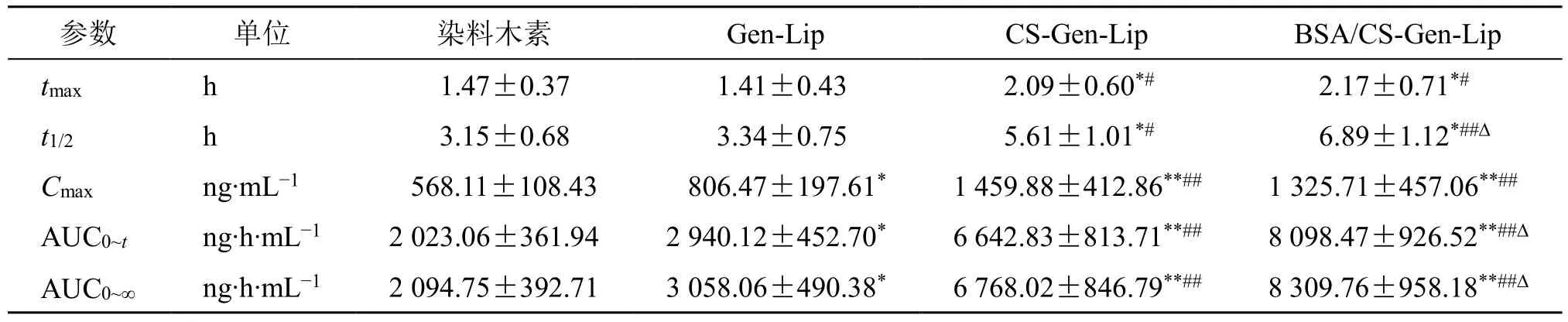
表15 药动学结果 (±s, n = 6)Table 15 Pharmacokinetic results (±s, n = 6)
与染料木素比较:*P<0.05**P<0.01;与Gen-Lip 比较:#P<0.05##P<0.01;与CS-Gen-Lip 比较:△P<0.05*P < 0.05**P < 0.01 vs genistein;#P < 0.05## P < 0.01 vs Gen-Lip; △P < 0.05 vs CS-Gen-Lip
参数 单位 染料木素 Gen-Lip CS-Gen-Lip BSA/CS-Gen-Lip tmax h 1.47±0.37 1.41±0.43 2.09±0.60*# 2.17±0.71*#t1/2 h 3.15±0.68 3.34±0.75 5.61±1.01*# 6.89±1.12*##Cmax ng∙mL−1 568.11±108.43 806.47±197.61* 1 459.88±412.86**## 1 325.71±457.06**##AUC0~t ng∙h∙mL−1 2 023.06±361.94 2 940.12±452.70* 6 642.83±813.71**## 8 098.47±926.52**##AUC0~∞ ng∙h∙mL−1 2 094.75±392.71 3 058.06±490.38* 6 768.02±846.79**## 8 309.76±958.18**##
3 讨论
壳聚糖是一种带正电荷的天然阳离子多糖,包覆在Gen-Lip 表面后会使电荷性质发生改变,因而本研究通过测定ζ 电位来筛选壳聚糖溶液的质量浓度。壳聚糖与脂质体的结合除了静电作用外,还存在疏水作用[26-27],疏水作用促进了壳聚糖材料在脂质体表面的吸附及沉积,因而两者结合较为紧密。在CS-Gen-Lip 表面继续包覆牛血清白蛋白制备成BSA/CS-Gen-Lip,白蛋白可利用自身多个疏水性位点及二硫键形成共价交联[28],从而在脂质体表面形成稳定的白蛋白修饰层,利于抵抗胃肠道pH 值、胃蛋白酶、胰蛋白酶等对脂质体的破坏[29],进一步增加稳定性、提高缓释效果。
前期试验结果显示,采用蔗糖制备冻干粉时粒径较大,而甘露醇可能由于自身具有结晶型针状结构[30],导致冻干粉包封率下降幅度远大于乳糖,故最终选择乳糖作为冻干保护剂。染料木素在BSA/CS-Gen-Lip 冻干粉以无定型状态存在,利于改善药物的溶解度及生物利用度。BSA/CS-Gen-Lip 冻干粉在各个时间点累积释放度略低于Gen-Lip 和CSGen-Lip 冻干粉,这可能是由于Gen-Lip 磷脂双分子层处于液晶相[27],药物释放相对容易,而壳聚糖包覆的CS-Gen-Lip 可以减缓药物释放,表现出一定的缓释特征。BSA/CS-Gen-Lip 由于牛血清和壳聚糖双层包覆作用从而使药物的缓释特征更为明显。稳定性结果显示,CS-Gen-Lip 和BSA/CS-Gen-Lip 冻干粉渗漏率和氧化指标均明显低于Gen-Lip 冻干粉,说明两者稳定性优于Gen-Lip 冻干粉。可能是由于未修饰的Gen-Lip 在储存过程中易发生氧化、聚集、融合等现象而导致药物泄露,修饰后的CSGen-Lip 和BSA/CS-Gen-Lip 通过增加机械稳定性、降低双分子层膜流动相、阻止磷脂双分子层向流体液晶相的转变、增加双分子层膜致密性等机制[26],从而提高了储存稳定性。
与染料木素原料药相比,BSA/CS-Gen-Lip 的Cmax及口服生物利用度显著性提高,可能是由于BSA/CS-Gen-Lip 改善了染料木素溶解度及溶出度,解决了药物体内吸收瓶颈;染料木素由晶态转变为无定型态,更易于体内吸收[13,17];染料木素胃肠道稳定性较差,制备成BSA/CS-Gen-Lip 后提高了胃肠道稳定性,更能发挥纳米粒子特殊的吸收机制,增加了药物吸收量;BSA/CS-Gen-Lip 粒径较小,与胃肠道接触面较大,促进了药物体内吸收[31-33];BSA/CS-Gen-Lip 处方中的壳聚糖、牛血清白蛋白等辅料本身具有促吸收作用[26,34-35]。另外,BSA/CSGen-Lip 的t1/2和口服吸收生物利用度均高于Gen-Lip 和CS-Gen-Lip,可能是由于白蛋白包覆后降低胃肠道各种酶、pH 值等因素对脂质体结构的破坏几率,更利于跨膜递送[35],说明BSA/CS-Gen-Lip 更具有开发研究价值。
综上,本研究完成了BSA/CS-Gen-Lip 及其冻干粉处方工艺研究,染料木素在BSA/CS-Gen-Lip 冻干粉中以无定型形式存在,且缓释作用明显,储存稳定性较高,促吸收作用较大,后续可对BSA/CSGen-Lip 冻干粉药效、毒性评价等进一步研究,为染料木素制剂开发提供有价值的参考资料。
利益冲突所有作者均声明不存在利益冲突
