酶联免疫法测定乳粉中黄曲霉毒素M1含量的不确定度评定
2023-12-24曹学思杨爱君陈蓓蕾
李 婕,曹学思,杨爱君,陈 欣,陈蓓蕾
广东燕塘乳业股份有限公司,广东 广州 510000
0 引言
黄曲霉毒素是由黄曲霉(Aspergillus flavus)和寄生曲霉(A.parasiticu)产生,具有很强的致癌、致畸、致突变作用的小分子代谢产物,它有B1、B2、G1、G2、M1和M2等6 种类型[1]。二呋喃环和香豆素是基本结构,可溶在如氯仿、乙腈、甲醇等有机溶剂中[2,3]。AFM1(黄曲霉毒素M1)较多残留在动物的乳治、肾脏、肝脏和尿液中,以乳中最常见[4],毒性与AFB1(黄曲霉毒素B1)相似。WHO(世界卫生组织)将它列为ⅡB类致癌物[5]。FDA(美国食品药品监督管理局)规定,牛乳中AFM1残留量有0.5 μg/kg的限量要求,我国也要求牛乳中AFM1含量限值要低于0.5 μg/kg[6]。
目前测定牛乳中黄曲霉毒素M1残留量的方法有:色谱法、免疫化学法、光电化学法、光电发光法及ELISA检测法等。在众多检验方法中,AFM1残留量的ELISA检测法较便捷,迫切需要将此方法的不确定度具体量化,有助于检测人员关注关键环节,使结果准确性提高[7]。本文用ELISA检测法对乳粉中AFM1残留量进行检测,并量化试验中带入的不确定度。
1 检验原理
黄曲霉毒素M1ELISA检测法的检测原理是:试剂盒应用直接竞争酶联免疫吸附原理。试剂盒孔洞内有AFM1特异抗体,在酶联耦合物、样品、标准品中的AFM1会竞争性与此特异抗体相结合。在规定反应时间后,洗液冲洗掉未结合部分。再加入显色液进行显色反应,最后加入终止液终止该反应过程。试验所得孔板通过酶标仪测量吸光光度值。所得吸光光度值结果录入计算机软件,得到工作标准曲线,通过该曲线计算对应样品的AFM1浓度结果。
2 材料与方法
2.1 仪器和材料
METTLER电子天平;SIGMA离心机;Thermo酶标仪;BRAND单、多道移液器;AHYG恒温振荡器;CRYSTAL旋涡振荡器;Romer Labs AFM1 ELSA检测试剂盒。
2.2 试验步骤
2.2.1 试验样品预处理
(1)称取待测样乳粉;
(2)稀释并均匀溶解待测样乳粉;
(3)冷藏静置并离心待测样;
(4)取离心上清液与甲醇溶液按4∶1均匀混合,混合液待用。
2.2.2 样品检测
将ELISA检测试剂提前复热至室温。
(1)在检测用孔杯中加入酶联偶合物试剂液;
(2)在上述孔杯内依次均匀移入标准品和样品,并静置反应60 min;
(3)60 min后,用洗剂重复洗各孔杯5 次,拍干孔杯内洗液;
(4)再加入底物显色液,避光反应20 min;
(5)20 min后,加入酸类终止液终止反应,制成检测微孔板;
(6)用酶标仪测量各孔吸光光度值并记录,代入计算机软件得出待测样的浓度结果;
(7)判定结论:0 ng/kg标准品OD值需>0.5,否则说明试剂已失效。
使用软件计算结果时,其标准品曲线的线性相关系数(R)需为-0.990~-1.000。
3 结果计算数学模型
式中:W—待测乳粉中AFM1含量,单位μg/kg;
C—待测乳粉样液中AFM1浓度,单位μg/L;
m—待测乳粉的称量重量,单位kg;
f—待测乳粉样液的稀释倍数,f=10.8。
3.1 试验结果
本试验用同一万分之一的电子天平,平行称取同一质控样乳粉(质控样特性值:0.608 μg/kg,特性值区间0.385~0.830 μg/kg)6 份。根据上述试验样品预处理方法进行样品预处理,根据样品检测步骤进行样品检测。所得检验微孔板,经同一酶标仪平行测定。在计算机运算软件中代入各吸光度值,得到如下试验结果(表1)。测定结果平均值为:0.480 μg/kg。

表1 试验结果汇总表(n=6)
3.2 试验中不确定度的来源分析
本次试验中,造成结果不确定度的因素主要有:
(1)重复性测定引入的不确定度,此为A类不确定度。
(2)试验中使用各规格移液器,因温度和移液器自身误差这2 个因素代入的不确定度,此为B类不确定度。
(3)ELISA试剂盒的试剂稳定性及其质量造成试剂空白带入的不确定度,此为B类不确定度。
(4)酶标仪工作性能,如灵敏性、稳定性等带入的不确定度,此为B类不确定度。
(5)天平称量试验乳粉时带入的不确定度,此为B类不确定度。
(6)标准曲线带入的不确定度,此为B类不确定度。
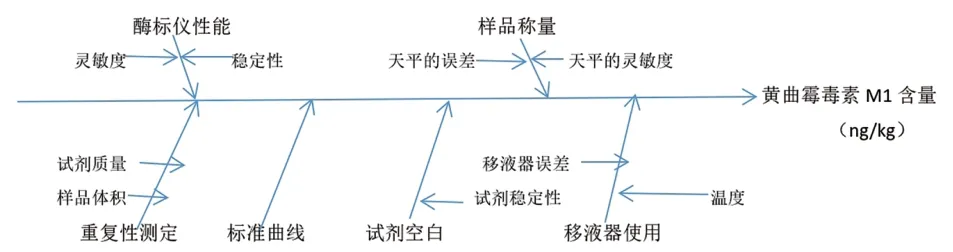
图1 试验中不确定度的来源分析
3.3 各项不确定度的量化分析计算
3.3.1 试验重复性测定带入的不确定度
由表1可知,本次试验的标准偏差:
3.3.2 移液器容量误差带入的标准不确定度
(1) 200 μL移液器的容量误差带入的标准不确定度本次试验的工作环境是室温20±5 ℃,2.1×10-4/℃是水在20 ℃的膨胀系数。取矩形分布,则本次试验中使用200 μL移液器移取100 μL待测乳粉,由于温度效应,引起溶剂体积变化的标准不确定度为:
1.119 ×10-3/℃是甲醇在20 ℃的膨胀系数,本试验工作环境是室温为20±5 ℃,取矩形分布,则本次试验中使用200 μL移液器移取100 μL甲醇溶液,温度效应引起溶液体积变化的标准不确定度为:
查询编号LE 202200065的移液器计量证书:可调移液器20~200 μL容量相对误差测量结果扩展不确定度U=0.5%,k=2。本次试验因使用200 μL移液器产生的标准不确定度为:(取矩形分布)
使用200 μL移液器移取水溶液样品时由(u温)和(u容)两项因素带进的标准不确定度为:
使用200 μL移液器移取甲醇溶液时由(u温2)和(u容)带进的标准不确定度为:
本试验有3步涉及应用200 μL移液器进行溶液移取。其中水溶液的移取为2 步:100 μL乳样的u(温2)、u(容)在该过程互为独立。加样过程中本次试验因200 μL移液器由这几个因素带进的标准不确定度为:
200 μL移液器在本次试验带进的相对标准不确定度:
(2)1 mL移液器的容量误差带入的标准不确定度
本次试验的工作环境是室温20±5 ℃,2.1×10-4/℃是水在20℃的膨胀系数。取矩形分布,本次试验中使用1 mL移液器移取400 μL待测乳样,温度效应引起溶剂体积变化的标准不确定度为:
查询编号LE 202200066的移液器计量证书中:可调移液器0.1~1 mL容量相对误差测量结果扩展不确定度U=0.3%,k=2,本次试验因使用1 mL移液器产生的标准不确定度为:(取矩形分布)
本试验总共1 步涉及应用1 mL单道移液器进行溶液移取,u(温)、u(容)在该过程互为独立,加样过程中本次试验因1 mL移液器由这两个因素带进的标准不确定。那么,1 mL移液器在本次试验过程中的使用,由其带进的相对标准不确定度为:
(3) 10 mL移液器容量误差带入的标准不确定度
本次试验的工作环境是室温20±5 ℃,2.1×10-4/℃是水在20 ℃的膨胀系数。取矩形分布,本次试验中使用10 mL移液器移取二级水,温度效应引起溶剂体积变化的标准不确定度为:
查询编号LE 202216773的移液器计量证书:可调移液器1~10 mL容量相对误差测量结果扩展不确定度U=0.2%,k=2,本次试验因使用10 mL移液器产生的标准不确定度为:(取矩形分布)
本试验总共1 步涉及应用10 mL单道移液器进行二级水移取,u(温)、u(容)在该过程互为独立,加样过程本次试验因10 mL移液器由这两个因素带进的标准不确定度为:
10 mL移液器在此次试验带进的相对标准不确定度为:
3.3.3 试剂空白引入的不确定度
黄曲霉毒素M1ELISA检测试剂是正规厂家按照国标要求生产的检验用试剂,因而由试剂空白造成的标准不确定度u(空)在本文中忽略不计。
3.3.4 由酶标仪性能带入的相对标准不确定度
本次试验使用同一酶标仪对试验微孔板进行样品测试,因此,不计因灵敏度造成的不确定度。查询书编号NG 202301468的酶标仪计量证书:酶标仪的吸光度示值误差的扩展不确定度U=0.012,k=2,本次试验因使用该酶标仪所引入的标准不确定度为:(根据矩形分布)
3.3.5 样品称量带进的不确定度
试验使用同一台万分之一电子天平,分别称取6 个平行的1 g待测乳粉样品,因而不计灵敏度造成的不确定度。查询证书编号LJ 202310184的电子天平计量证书:天平最大秤量示值误差的测量结果扩展不确定度U=0.08 mg(70 g),k=2。本次试验因使用该电子天平称量待测样乳粉带入的标准不确定度为:(根据矩形分布)
本次样品称量带入的相对标准不确定度为:
3.3.6 标准曲线带入的不确定度
根据上述ELISA黄曲霉毒素M1试剂盒试验步骤进行检验操作,将检验操作所得同一孔杯板用同一酶标仪进行两次上机测量,读取两组试剂盒已知浓度标样的对应吸光度A值。并用该组吸光光度值生成标准曲线,结果见表2。

表2 工作曲线测定结果表
录入电脑的数据处理工作文档进行计算,以标准溶液浓度的对数值Log(Conc.)为X轴,Logit(A/A0)值为Y轴。得标准曲线回归方程:Y=2.468 1-1.185 9X,R=-0.998 3。通过该标准曲线可得,待测样品奶粉还原稀释液浓度对数平均值:LogX样=1.663 9,X样=46.12 ng/L 。得工作曲线的标准偏差为:
式中:Yi—表2中Logit(A/A0)各数值;
Xi—表2中Log(Conc.)各值;
a—表2中截距值2.468 1;
b—表2中斜率值-1.185 9;
n=12
计算本次试验因标准曲线带入的标准不确定度为:
式中:S(曲):工作曲线的标准差;
b:表2中斜率,b=-1.185 9;
k:样品的测量次数——2,;
n:标准品的测量总次数——12;
g0:LogX样值——1.663 9;
g:表2中Log(Conc.)的平均值;
gi:表2中Log(Conc.)各值。
可得:
可得:本次试验中工作(表3)曲线带进的相对标准不确定度:

表3 各项不确定度汇总
4 各项不确定度结果对比分析
各项不确定度见表3。对本次乳粉中黄曲霉毒素M1残留量ELISA法测定结果的不确定度影响较大的是由标准曲线拟合引入的相对标准不确定度。
4.1 合成标准不确定度
将上述各项不确定度量化计算结果合并,本次试验的标准不确定度为:
其中0.480 μg/kg是上述本次试验实测样品AFM1含量平均值。
4.2 扩展不确定度
测定结果符合正态分布,按照置信水平95%,包含因子k=2,本次试验乳粉样品中黄曲霉毒素M1测定的扩展不确定度:
5 结论
本文试验采用ELISA法测定乳粉样品中黄曲霉M1含量结果应表示为0.480±0.023 μg/kg,k=2。其中对不确定度影响较大的因素是由标准曲线引入的不确定度。将来检验工作中,可酌情增加加标样或质控样测试次数,以减少其不确定度对测定结果带来影响。
