依赖IL-5增殖的细胞株TF-1-9E3的驯化及验证
2023-12-21李诗洁代维燕王雪莲柯文锋陈永奇白仲虎
李诗洁,代维燕,王雪莲,柯文锋,韩 飞,陈永奇,刘 畅,白仲虎
(1.珠海瑞思普利医药科技有限公司,珠海 519040; 2.江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122; 3.江南大学 生物工程学院 工业生物技术教育部重点实验室,无锡 214122; 4.江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,无锡 214122)
IL-5(Human interleukin-5)是一种由链间二硫键连接的同源二聚体细胞因子,由Th2淋巴细胞、肥大细胞、Ⅱ型固有淋巴细胞(ILC2s)、自然杀伤性T细胞、嗜酸性粒细胞表达和产生[1]。IL-5也是嗜酸性粒细胞的关键调节因子,在嗜酸性粒细胞的增殖、激活和成熟中起核心作用[2-3],可以促进嗜酸性粒细胞从骨髓释放到循环中[4-5]。由于嗜酸性粒细胞在严重嗜酸性粒细胞哮喘的发病机制中具有突出作用,引起气道上皮损伤和支气管重塑[6],且嗜酸性粒细胞与较高的恶化频率有关,导致患者肺功能下降[7]。嗜酸性粒细胞表面表达IL-5Rα,可以与IL-5特异性结合。IL-5与IL-5Rα结合形成复合物后,这个中间复合物将招募共同的β(βc)受体[IL-5与IL-3(Human interleukin-3)及GM-CSF(granulocyte-macrophage colony-stimulating factor)共享βc受体,CD131]形成三元复合物,JAK/STAT信号级联随之被激活,促进嗜酸性粒细胞的增殖,因此,通过阻断炎症因子IL-5的信号通路进而减少嗜酸性粒细胞的数量已经成为治疗严重嗜酸性粒细胞哮喘非常有效的方法[8]。
目前阻断IL-5与IL-5Rα结合的抗体[Reslizumab(靶向IL-5),Mepolizumab(靶向IL-5)、Benralizumab(靶向IL-5Rα)]的特异性单克隆抗体已被批准用于不受控制的嗜酸性粒细胞性(2型)哮喘的附加治疗。IL-5是嗜酸性粒细胞哮喘的关键细胞因子,尽管已经有上市的靶向IL-5或IL-5Rα的抗体药存在,但均为注射给药,随着吸入给药方式的发展[9],阻断IL-5与IL-5Rα结合的抗体(纳米抗体、抗体片段等)用于吸入给药治疗哮喘备受关注,因此,优化候选抗体生物活性筛选方法非常重要。IL-5的体外活性检测方法有ELISA(酶联免疫吸附测定)法、SPR(表面等离子体共振)法、FACS(Fluorescence activated cell sorting)、murine BCL1 增殖检测[10-12]、IL-5介导的CTLL-2增殖[13]、报告基因(reporter gene assay,RGA)[14]和TF-1增殖[15]等,在IL-5阻断抗体的开发过程中,TF-1增殖抑制是常用的生物活性检测方法。虽然已有相关报道介绍依赖IL-5的TF-1细胞用于IL-5活性检测,但没有详细描述驯化过程,且细胞对低含量的血清耐受程度差,在细胞增殖检测过程中,需要较高含量血清维持细胞生长,而高含量血清成分较为复杂,会导致检测变异系数高、信噪比低。
TF-1生长完全依赖IL-3或GM-CSF,多种因子(IL-1、IL-4、IL-6、IL-9、IL-11、IL-13、CSF、LIF和NGF)对TF-1细胞都有作用,但是该细胞对IL-5依赖很低或无反应[16],因此,需要驯化TF-1细胞使之对IL-5产生增殖依赖。为尽量减少血清中的生长因子对TF-1增殖的影响,本研究通过降血清培养及驯化获得依赖IL-5增殖的单克隆细胞株,通过细胞量、血清含量、血清品牌等条件优化,得到了细胞依赖IL-5增殖的最优条件,以期用于检测IL-5蛋白的活性及抗体发现过程中,筛选具有阻断作用的候选抗体,加速抗体药物的开发。
1 材料与方法
1.1 材料
TF-1细胞(CL-0232)及TF-1细胞专用培养基(货号:CM-0232)购自普诺赛生命科技有限公司;IL-5(15673-H08H)蛋白购自北京义翘神州科技股份有限公司;CCK-8 购自大连美仑生物有限公司;RPMI 1640购自Sigma;PE-anti CD125(FAB253P)购自Bio-Techne;胎牛血清(30067334)购自Gibco;胎牛血清(FS201-02)购自北京全式金生物技术股份有限公司(TransGen);胎牛血清(11011-8611)购自浙江天杭生物科技股份有限公司(四季青);胎牛血清(B21001)购自中山康天晟合生物技术有限公司(Quacell);胎牛血清(086-150)购自维森特生物技术有限公司(WISENT)。
1.2 方法
1.2.1 TF-1细胞驯化
TF-1细胞用TF-1专用培养基培养并传代3次后,用完全培养基[RPMI 1640(Sigma)+10 ng/mL IL-5+10% FBS+1% P/S]直接替代TF-1专用培养基,继续培养,直至细胞状态恢复正常(30 d和35 d),逐步降血清至8%、6%及4%并分别在37 ℃,5% CO2的培养条件下传代3~5次。
1.2.2 IL-5依赖TF-1细胞的亚克隆
将在含8%、6%、4% FBS(Gibco)的培养基(RPMI 1640+10 ng/mL IL-5+1% P/S)中培养的TF-1细胞吹悬计数,按照平均0.7~0.8个细胞/孔(1个96孔板,加入约70~80个细胞)铺板至96孔板中,每个血清含量铺板5块,在37 ℃,5% CO2条件下静置培养,约15 d可以看到克隆出现,根据细胞状态和生长速度依次进行扩大培养(24孔板,6孔板,T25细胞培养瓶)。
1.2.3 FACS检测单克隆细胞株上IL-5Rα蛋白的过表达
800 r/min离心5 min收集待检测的单克隆细胞株,用PBS洗2遍,加入等体积的FACS staining buffer(PBS+2% FBS)重悬细胞并计数,加入1.5 mL EP管(0.5×106~1×106个细胞/管)中,加入PE-anti CD125,4 ℃避光孵育40 min,离心后弃上清液,加入200 μL FACS staining buffer 洗一遍,加入500 μL FACS staining buffer重悬后,用流式细胞仪(BD,FACEAriaⅢ)进行FACS检测,采用flowjo软件(https://www.flowjo.com/)进行结果分析。
1.2.4 FACS阳性克隆依赖IL-5增殖检测
800 r/min离心5 min收集待检测的细胞株,用5 mL无血清的RPMI 1640培养基洗两遍,重悬至1 mL无血清的RPMI 1640培养基中,细胞计数,用无血清RPMI 1640培养基稀释细胞至密度2×105个细胞/mL。铺96孔板,每个孔加入50 μL细胞悬液。每个待测单克隆细胞加18个孔(3个为一组,共6组),弃剩余细胞。配制含6% FBS(Gibco)的RPMI 1640培养基,10倍梯度稀释IL-5,首孔100 ng/mL IL-5,将IL-5稀释液加入上述细胞孔中,每孔50 μL。最终首孔质量浓度为50 ng/mL IL-5,血清含量为3%。37 ℃培养54 h后加入CCK-8(每孔10 μL)后37 ℃孵6 h,检测OD450值,采用GraphPad Prism 5软件进行数据分析。
1.2.5 TF-1-9E3细胞株增殖条件优化
使用1.2.4节中筛选得到的依赖IL-5增殖的TF-1-9E3细胞株,进行细胞量、血清含量、血清品牌的优化。(1)细胞量优化。取细胞量5 000、1×104、2×104、3×104和4×104,按照1.2.4节的方法对IL-5进行稀释和检测,血清的终含量为3%,培养54 h,每孔加入CCK-8 10 μL,孵育6 h后读取OD450值,采用GraphPad Prism 5软件分析数据。(2)血清含量优化。取细胞量2×104个/孔进行增殖检测,按照1.2.4节的方法采用不同含量血清的RPMI 1640培养基对IL-5蛋白进行稀释和检测,血清的终含量分别为0.5%、1%、2%、3%、4%、5%和6%,培养54 h,每孔加入CCK-8 10 μL,孵育6 h后读取OD450值,采用GraphPad Prism 5软件分析数据。(3)血清品牌优化。取细胞量2×104个细胞/孔进行增殖检测,按照1.2.4节的方法采用含不同品牌血清的RPMI 1640培养基对IL-5蛋白进行稀释和检测,血清的终含量为3%,培养54 h每孔加入CCK-8 10 μL,孵育6 h后读取OD450值,采用GraphPad Prism 5软件分析数据。
1.2.6 TF-1-9E3细胞用于IL-5与IL-5Rα阻断抗体的增殖抑制检测
将TF-1-9E3细胞用无血清RPMI 1640洗两遍后,按照2×104个细胞/孔进行铺板,每孔50 μL,采用含6% FBS和20 ng/mL IL-5的RPMI 1640培养基梯度稀释待测抗体,将稀释后的抗体加入细胞孔中,每孔50 μL,培养54 h后加入10 μL CCK-8试剂,继续孵育6 h后用酶标仪读取OD450值。
1.3 数据处理
根据阻断抗体增殖抑制结果,对阻断抗体与IgG1之间OD450值(抗体最高质量浓度下的OD450)使用t检验的方法进行比较,*** 为P≤0.001,表示两组数据之间具有显著性差异。
2 结果与分析
2.1 TF-1细胞的驯化
对TF-1细胞进行驯化使之依赖IL-5进行增殖,直接将TF-1增殖所必需的GM-CSF替换成IL-5,在相差倒置显微镜(目镜10倍×物镜10倍)下进行观察拍照,如图1所示,在替换成IL-5进行培养后,部分TF-1细胞发生细胞分化(出现梭型细胞),在无GM-CSF培养的第11天细胞出现明显死亡,出现大量细胞碎片及细胞聚集情况,且细胞大小不一。继续培养20 d后,随着传代次数的增加,细胞状态逐步恢复正常(31 d和35 d),此细胞可以在不外加GM-CSF的条件下进行增殖。

(a)驯化前TF-1细胞(GM-CSF);(b) IL-5驯化第3天;(c) IL-5驯化第8天;(d) IL-5驯化第11 天;(e) IL-5驯化第31天;(f) IL-5驯化第35天。
2.2 IL-5依赖TF-1细胞的亚克隆
为获得依赖IL-5增殖的单克隆细胞株,在不同血清含量下对细胞进行稀释并铺板,并在不同阶段对不同血清含量下存活的细胞孔进行计数(图2)。在8% FBS培养条件下,各时间段克隆数明显优于6%和4% FBS产生的克隆,血清含量越高,越有利于克隆的存活。随着培养时间增加,在扩大培养的过程中有部分克隆死亡,最终只有14个克隆完成扩大培养,其中,在6% FBS条件下,仅一个克隆9E3完成扩大培养,而在低含量(4%)的血清条件下,细胞无法长时间存活。
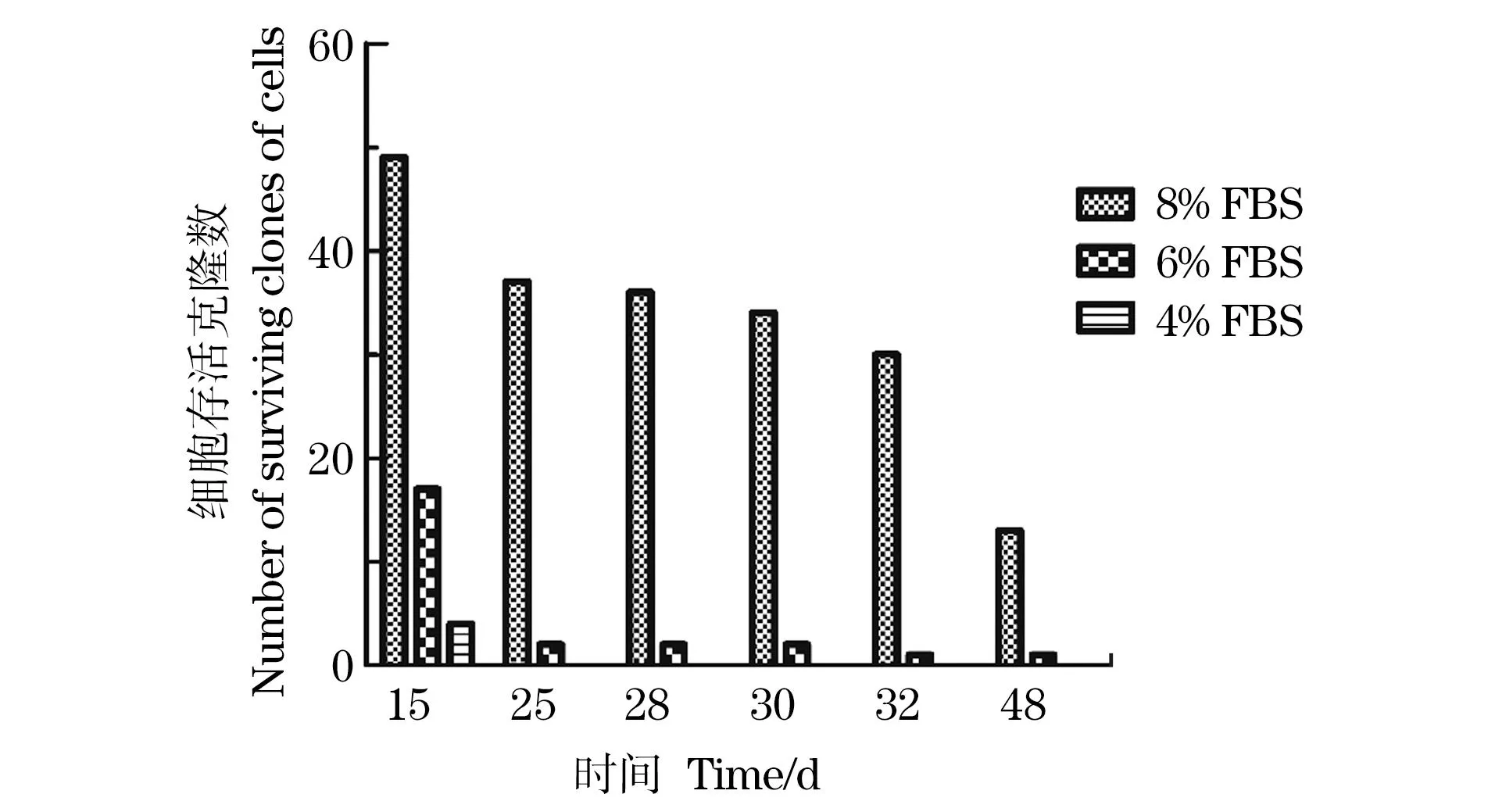
图2 随培养时间变化的存活细胞克隆数
2.3 FACS检测亚克隆细胞株上IL-5Rα蛋白的过表达
TF-1细胞依赖IL-5进行增殖需要过表达IL-5Rα,因此,对所有单克隆细胞株采用IL-5Rα特异性的流式抗体PE-anti CD125进行FACS检测,以确定单克隆细胞株表面是否存在IL-5Rα过表达。以驯化前的TF-1细胞作为阴性对照,对亚克隆得到的14个细胞株进行FACS检测,结果如图3所示,相比单克隆细胞株2C5、1D6、4B9、3F5和1C11,其他单克隆细胞株(1D3、2C10、3C9、1F5、2E8、2D6、2F8、3E9和9E3)与驯化前的TF-1相比,细胞表面 IL-5Rα蛋白的表达提高较为明显。因此,选用单克隆细胞株1D3、2C10、3C9、1F5、2E8、2D6、2F8、3E9和9E3,采用CCK-8试剂进行后续细胞依赖IL-5的增殖检测。

图3 通过FACS检测不同细胞株表面IL-5Rα的过表达
2.4 IL-5增殖检测
为检测FACS阳性的细胞株(细胞表面过表达IL-5Rα细胞株)是否具有依赖IL-5增殖的作用,采用CCK-8试剂进行细胞增殖检测,同时以IL-5Rα无明显过表达的细胞株2C5作为IL-5增殖检测的阴性对照,检测结果如图4所示,仅在6% FBS条件下长出的克隆9E3具有明显的依赖IL-5增殖,其他细胞株(1D3、2C10、3C9、1F5、2E8、2D6、2F8和3E9)尽管细胞表面过表达IL-5Rα,但并无明显依赖IL-5增殖的现象。因此,选用克隆9E3用于增殖条件优化,测定IL-5蛋白的生物活性。

图4 不同单克隆细胞株依赖IL-5的增殖检测
2.5 细胞增殖条件优化
为得到细胞增殖的最佳条件,采用驯化得到的单克隆细胞株TF-1-9E3对细胞量、血清含量、血清品牌进行优化。首先对细胞量进行优化,在相同血清含量和品牌的条件下进行实验,如图5(a)和表1所示,不同的细胞量(5×103~4×104)培养54 h后,加入CCK-8检测试剂孵育后的OD450值均随IL-5质量浓度增加而增加,其中,细胞量为2×104的Emax区间(Emax区间为2.077)最大,细胞量为1×104的信噪比(信噪比为3.05)最高,综合增殖趋势图[图5(a)],选择2×104的细胞量用于后续实验。随后对不同血清含量进行优化,在相同细胞量和品牌的条件下进行实验,如图5(b)所示,在低含量血清(0.5%~2%)且含低质量浓度的IL-5时,细胞由于生长状态差,细胞死亡较多,因此,初始OD450值较3%~6%浓度的要低。当血清含量在3%~5%时,曲线基本重叠,而含量为6%的Emax区间明显高于3%~5%的。结合不同血清含量的Emax区间和信噪比(表2)以及细胞状态,为尽量减少血清中生长因子对增殖检测的影响,后续检测选择血清含量为3%。最后对不同血清品牌进行优化,在相同的细胞量和血清含量的条件下进行实验,除了前期用于细胞培养采用的Gibco血清以外,研究选择了另外4种不同品牌(四季青、Quacell、WISENT和TransGen)的胎牛血清进行增殖检测[图5(c)],虽然TransGen具有最大的信噪比(信噪比为4.14),但是在IL-5-His质量浓度较低时,细胞状态较差,综合Emax和信噪比的结果(表1),最终选择Gibco胎牛血清用于增殖抑制检测。
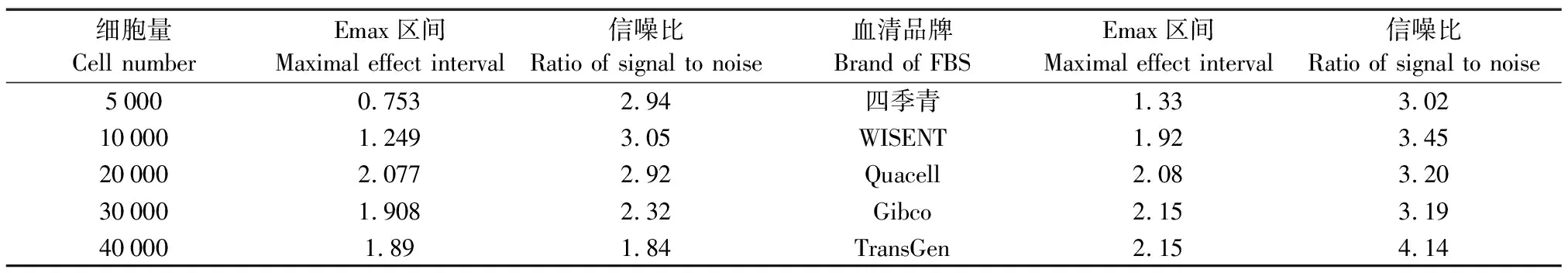
表1 9E3细胞株在不同细胞量及血清品牌条件下的增殖检测的Emax区间和信噪比
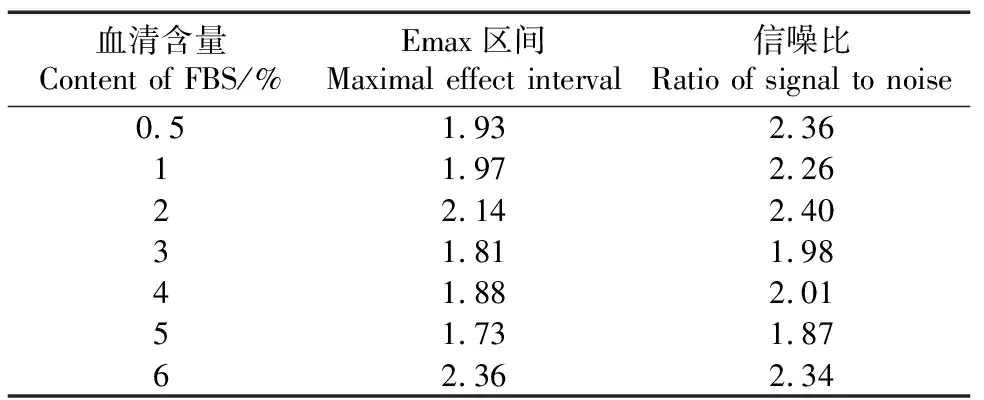
表2 9E3细胞株在不同血清含量条件下的增殖检测的Emax区间和信噪比

(a)不同细胞量CCK-8增殖检测;(b)不同血清含量CCK-8增殖检测;(c)不同血清品牌增殖检测。
2.6 TF-1-9E3细胞用于IL-5与IL-5Rα阻断抗体的增殖抑制检测
为评估TF-1-9E3细胞用于抗体增殖抑制检测的情况,采用具有阻断IL-5与IL-5Rα结合的靶向IL-5[Reslizumab[17],Mepolizumab[17],huNB66(专利号CN112225807B)]及IL-5Rα抗体(Benralizumab)[17]作为测试抗体,同时采用不具备IL-5阻断作用的抗体IgG1(抗IL-5的单克隆抗体)作为阴性对照进行增殖抑制检测。如图6所示,所有具有阻断作用的抗体均有抑制TF-1-9E3细胞增殖的作用,对阻断抗体与IgG1之间OD450值(测试的抗体最高质量浓度下的OD450值)使用t检验的方法进行比较,所有的阻断抗体在高质量浓度IL-5条件下与IgG1具有显著性差异,因此,该细胞可以用作靶向IL-5或者IL-5Rα候选抗体阻断作用的筛选。

(a)huNB66增殖抑制检测;(b)Benralizumab增殖抑制检测;(c)Reslizumab增殖抑制检测;(d)Mepolizumab增殖抑制检测。*** 表示阻断抗体与IgG1在最高抗体质量浓度下OD450值的显著性差异。
3 讨论与结论
研究详细描述了TF-1细胞的驯化过程,TF-1细胞从日本的红白血病人体内分离而来[18],其生长完全依赖GM-CSF和IL-3,而不依赖IL-5,这与TF-1细胞低表达IL-5Rα有关[14]。为获得高表达IL-5Rα的TF-1细胞株且依赖IL-5增殖,本研究通过长时间的IL-5驯化(>30 d),细胞生长状态恢复正常。对驯化后的细胞采用IL-5进行增殖检测,发现细胞并没有依赖IL-5增殖的趋势,推测血清中复杂的生长因子也会维持细胞生长,促进细胞增殖。为尽可能降低血清中生长因子等对驯化的影响,逐步降低血清含量进行培养,采用同样的方法依旧没有发现明显的细胞依赖IL-5增殖,结果表明,血清中复杂成分对驯化存在严重干扰,大部分细胞并不依赖IL-5增殖,可能是依靠血清中的成分增殖或维持细胞状态。为分离出依赖IL-5增殖的单克隆细胞株,通过有限稀释法进行细胞亚克隆,虽然铺板时超过80%的细胞孔均有细胞,但是最终可以存活的单克隆较少,这与细胞本身具有密度依赖性有关,细胞量过少不利于细胞增殖。
为确定单克隆细胞表面IL-5Rα是否存在过表达,本研究采用FACS进行检测,结果表明,尽管部分细胞能顺利扩大培养,但细胞株表面并没有过表达IL-5Rα蛋白,因而没有依赖IL-5增殖的能力,进一步证实了血清中复杂的成分可以维持细胞生长。值得注意的是,即使部分细胞存在IL-5Rα过表达,通过IL-5增殖检测,也没有明显依赖IL-5增殖的能力,具体原因有待进一步分析。相比8% FBS,6% FBS 驯化得到的9E3细胞株具有明显依赖IL-5增殖的能力,减少血清含量,有利于筛选出具有依赖IL-5增殖的细胞株,但减少血清含量,也会降低单克隆细胞的存活率。在不同血清含量增殖检测实验中[图5(b)],当血清含量较低(低于2%)且外加IL-5含量低(低于0.01 ng/mL)时,细胞裂解出现大量细胞碎片,细胞大量死亡,随着IL-5质量浓度增加,细胞状态明显好转,当IL-5质量浓度达到5 ng/mL时,细胞状态正常,基本无明显的细胞碎片,表明IL-5除了可以促进增殖外,还可以促进细胞TF-1细胞存活,与报道一致[14]。
本研究通过降低血清含量进行细胞驯化,成功获得一株具有高依赖IL-5增殖且耐受低血清含量的细胞株TF-1-9E3,通过细胞量、血清含量和血清品牌的优化,确定了最优的增殖条件,具有信噪比高、操作简便、重现性好等优点,不仅为筛选阻断抗体和检测IL-5活性检测提供良好的细胞株,也提供了一个可行的驯化高依赖IL-5增殖细胞株的方法。
