橡胶炭疽菌HD-1的鉴定及拮抗药剂筛选
2023-12-21褚凌龙娄嘉雯刘文波靳鹏飞缪卫国
褚凌龙,娄嘉雯,刘文波,靳鹏飞,缪卫国
(海南大学 植物保护学院 热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
巴西橡胶树Heveabrasiliensis是一种较为典型的热带雨林植物,它所分泌的胶乳是重要的工业原料[1]。由炭疽菌引起的橡胶树炭疽病是我国橡胶树生产上最为严重的病害之一[2]。橡胶树炭疽病主要由炭疽菌属Colletotrichum的胶孢炭疽菌复合菌群C.gloeosporioidesspecies complex引起,是我国常见的炭疽菌总群,寄主范围广泛,主要通过角质层下内部侵染和细胞内半活体营养性侵染两种方式对寄主的叶片、叶柄和嫩梢进行侵染[3]。随着气候的变化,病原菌对环境的适应性逐渐增强,并且橡胶树的抗病能力有所下降,导致橡胶树炭疽病频繁发生,对胶乳的生产行业产生了许多不利的影响[4]。
到目前为止,区分炭疽菌属的真菌,是以传统的形态学和分子生物学为主体,对炭疽的种类进行初步鉴定,并结合纯培养学、寄主专一性等来明确菌株的确切的种[5]。在形态学鉴定方面,主要通过对菌株的菌落形态、分生孢子的形态和大小、附着胞,以及菌核的有无等方面进行观察,对菌株进行鉴定,而炭疽属的真菌,绝大多数的菌株都具有广泛的寄主,没有严格的转移寄生性[6]。在分子生物学鉴定方面[7],目前使用ITS、ACT、CHS-1、GAPDH、GS等基因,通过单个基因或者多个基因联合建立系统发育树,根据亲缘关系远近来确定菌株的分类地位。国际上将炭疽菌主要划分为几个类群:尖孢炭疽复合种TheC.acutatumspecies complex、白蜡树炭疽复合种TheC.spaethianumspecies complex、毁灭炭疽复合种TheC.dstructivumspecies complex、束状炭疽复合种TheC.demaliumspecies complex、胶孢炭疽复合种TheC.gloeosporioidesspecies complex、博宁炭疽复合种TheC.boninesespecies complex、禾生炭疽复合种TheC.graminicolaspecies complex、平头炭疽复合种TheC.truncatumspecies complex和圆孢炭疽复合种TheC.orbiscularespecies complex等9个复合种和部分独立的种[8]。
目前,田间对橡胶树炭疽病的防治主要从3个方面进行:农业防治、化学防治和生物防治。其中,化学防治是橡胶树炭疽病的主要防治方法,但是多年来防治方法较为单一、药剂少,导致病原菌已出现耐药性[9-12]。我国目前登记用于炭疽病防治的药剂中,根据杀菌剂的化学结构可大致分为11类,主要为咪唑类、三唑类、甲氧基丙烯酸酯类、二硫代氨基甲酸盐类等。其中,以苯醚甲环唑为代表的三唑类杀菌剂和以多菌灵为代表的苯并咪唑类杀菌剂是防治橡胶树炭疽病的主要药剂[13]。三唑类和咪唑类杀菌剂都属于脱甲基化酶抑制剂(DMI)类杀菌剂,通称为唑类,如咪鲜胺。这一类的化合物可以通过对CYP51酶的活性进行抑制,从而导致炭疽菌合成麦角甾醇的前体物质在菌体细胞中不断累积,对细胞膜的结构进行破坏,产生一定的毒害作用,最终导致菌体细胞死亡[14-16]。研究表明DMI类杀菌剂对炭疽病的防效差异较大[13],C.gloeosporioides复合种对所有被测DMI药剂均敏感;但在2个亲缘关系极为相近的同属C.acutatum复合种中,C.fioriniae也对所有被测DMI药剂敏感,C.nymphaeae却对粉唑醇和腈苯唑表现为抗性;此外,C.truncatum对大多数DMI类药剂表现为抗性或者不敏感[11]。炭疽病菌对DMI类药剂存在天然抗性,频繁使用药剂也会导致病菌敏感性下降。采自浙江省葡萄上的胶孢炭疽菌菌株对戊唑醇已产生了中等抗性[17]。
生物防治因具有高效、低毒、环保的特点而备受瞩目,已报道的可防治炭疽病的生防菌种类较多,其中,以芽孢杆菌和放线菌被研究得最为广泛。樊兰艳[18]发现枯草芽孢杆菌Czk1所产生的挥发性物质以及脂肽类物质能够有效抑制橡胶炭疽菌;枯草芽孢杆菌BD0310能够很好地控制茶叶炭疽菌[19];从文心兰叶片中分离出的菌株EB75经鉴定为一株解淀粉芽孢杆菌,通过平板对峙实验发现,该菌株对胶孢炭疽菌的抑制率为58.79%,其发酵原液对胶孢炭疽菌的抑制率达到了77.69%,即使高温处理后仍具有41.26%的抑制率[20];竺利红等[21]研究表明,不同稀释倍数的贝莱斯芽孢杆菌SM905发酵上清液对胶孢炭疽菌具有一定的抑制作用,其5倍稀释液对菌丝生长的抑制率达到97.89%,经处理后的气生菌丝表现为空洞、畸形、色素积累,菌丝生长稀疏、膨大。
本研究通过形态学和ITS单基因构建系统发育树的方式对一株从海南省儋州市橡胶园采集的橡胶树叶片上分离得到的橡胶炭疽菌HD-1进行初步鉴定,并且对该菌株的生物学特性进行了研究,测定并比较了4种传统化学农药和生防菌B.velezensisHN-2发酵上清液正丁醇提取物对该菌株的EC50,本研究为田间橡胶树炭疽病的防控提供了理论依据与技术支撑。
1 材料与方法
1.1 材料
1.1.1 菌株来源
橡胶炭疽菌HD-1和贝莱斯芽孢杆菌(B.velezensis)HN-2由海南大学植物保护学院分子植物病理实验室提供。
1.1.2 培养基
实验所用培养基具体见表1。
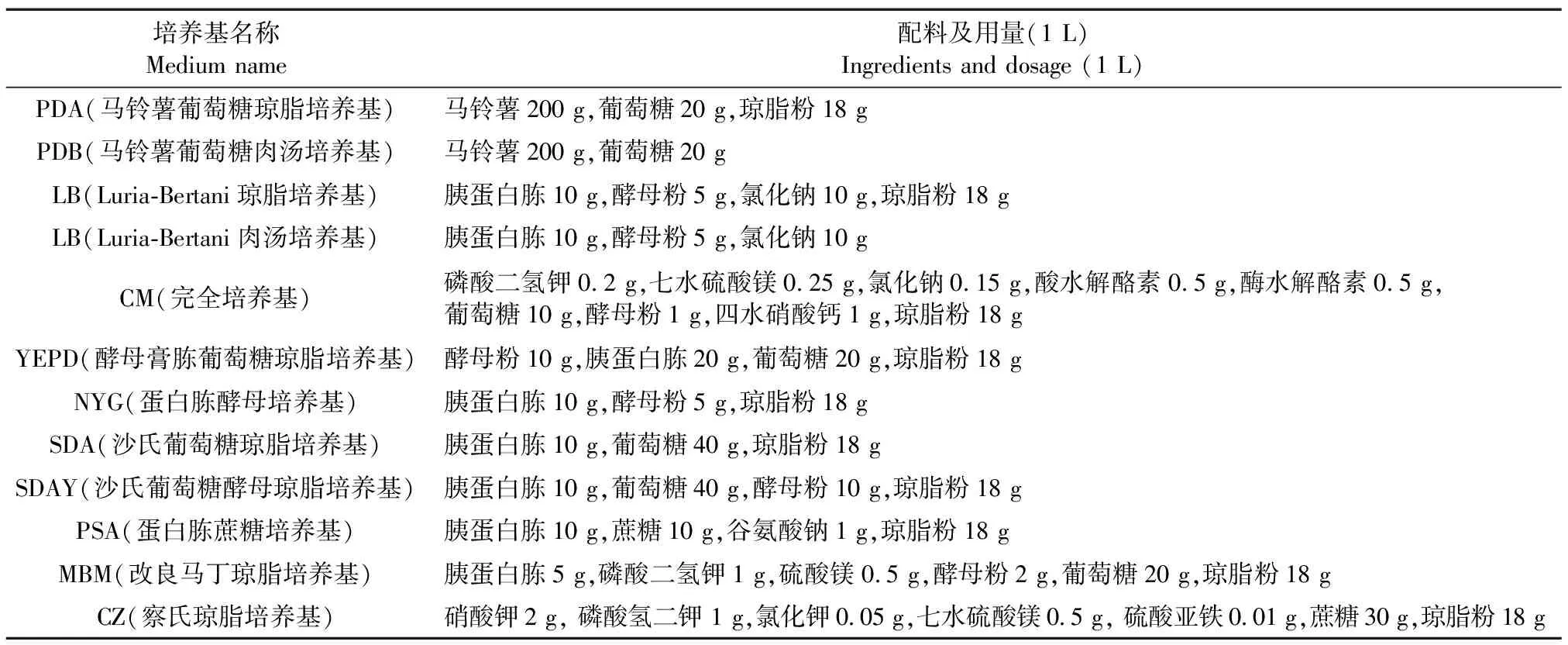
表1 实验所用培养基
1.2 方法
1.2.1 菌株HD-1形态学观察
(1)菌落、菌丝观察。将菌株HD-1接种于PDA平板上,培养3 d后,在菌落边缘取6 mm菌饼,接种至新的PDA平板中央,28 ℃下恒温培养5 d,观察菌落形态,利用生长速率法计算平均生长速率。从菌落边缘挑取菌丝,放在滴加了适量水的载玻片上,在光学显微镜下观察菌丝的形态及特征。
(2)孢子、附着胞观察。取新鲜的菌落边缘菌饼,于100 mL的PDB培养基中,180 r/min,28 ℃振荡培养5 d后,将密封的锥形瓶放于光照下静置3 d,期间对菌液进行镜检,观察孢子是否生成,待有大量孢子生成后,过滤菌丝,6 000 r/min离心5 min,弃上清液,计算孢子浓度,调整浓度为106mL-1。使用光学显微镜观察孢子的形态特征并测量孢子大小,进行生物学统计。吸取30 μL的孢子悬浮液(106mL-1)滴加在无菌的单凹载玻片上,置于铺有潮湿的无菌滤纸的培养皿中,28 ℃保湿培养,每隔0.5 h取出载玻片盖上盖玻片后在显微镜下观察附着胞的形状并记录。
1.2.2 菌株HD-1分子生物学鉴定
(1)菌株HD-1的基因组DNA提取。将菌株HD-1接种至PDA培养基上,28 ℃培养5 d,刮取菌丝,使用植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司]进行基因组DNA的提取。
(2)序列扩增。使用菌株HD-1的基因组DNA为模板,引物ITS1和ITS4(表2)对基因ITS进行扩增。

表2 ITS引物
PCR(25 μL)体系:2×TaqPCR MasterMix Ⅱ[天根生化科技(北京)有限公司)]12.5 μL;HD-1 DNA 1 μL;引物ITS1/4 1 μL;ddH2O 9.5 μL。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃复性30 s,72 ℃延伸1 min,循环数为30次;72 ℃再延伸10 min。
(3)测序及分析。取5 μL PCR产物使用1%琼脂糖凝胶电泳检测,确定条带正确后将PCR产物送华大基因科技股份有限公司测序;将测序所得序列以及GenBank上下载的各菌株序列用MEGA 7.0软件进行处理,序列对准后切齐,然后用最大似然估计法(Maximum likelihood)构建系统发育树,以自举法(bootstrap method)进行检测,共循环500次。
1.2.3 菌株HD-1生物学特性
(1)不同培养基对菌株生长的影响。将6 mm菌饼接种于上述含有不同琼脂培养基的平板中央,每个处理重复3次,28 ℃培养5 d,使用十字交叉法测量菌落直径。
(2)不同pH对菌株生长的影响。用1 mol/L的NaOH和HCl溶液调节PDA培养基的pH值至4、5、6、7、8、9、10共7组处理,将6 mm菌饼接种于上述含有不同pH的PDA的平板中央,每个处理重复3次,28 ℃黑暗培养5 d,使用十字交叉法测量菌落直径。
(3)不同碳源、氮源对菌株生长的影响。用果糖、葡萄糖、山梨醇、半乳糖、麦芽糖和甘露醇对察氏琼脂培养基中的蔗糖进行等碳量替换,用硫酸铵、氯化铵、硝酸钾、牛肉浸膏、蛋白胨、脯氨酸、谷氨酰胺和甘氨酸对察氏培养基中的硝酸钠进行等氮量替换,制成含有不同碳源、氮源的培养基平板,将6 mm菌饼接种于上述平板中央,每个处理重复3次,28 ℃黑暗培养5 d,使用十字交叉法测量菌落直径。
(4)致病性测定。取淡绿期的橡胶树叶片,使用75%乙醇进行叶片表面消毒。使用灭菌牙签将叶片刺出大小约为3 mm×3 mm的伤口,取6 mm新鲜的菌饼接种于伤口上,使用等大的PDA培养基琼脂块作为对照,于28 ℃黑暗条件下保湿培养,定期观察。
1.2.4 室内毒力测定
(1)药剂。25%咪鲜胺水乳剂,山东禾益生物科技有限公司;10%苯醚甲环唑水乳剂,陕西汤普森生物科技有限公司;40%锰锌·三唑酮可湿性粉剂,四川国光农化股份有限公司;75%三环唑可湿性粉剂,上海沪联生物药业(夏邑)股份有限公司;HN-2正丁醇提取物由本实验室提取。将各药剂配制成不同浓度的母液,并使用0.22 μm的细菌过滤器进行过滤。
(2)室内毒力测定。使用生长速率法,测定5种药剂对菌株HD-1的室内毒力。在PDA培养基中加入不同体积的药剂母液,充分混匀,制成含有不同药剂的平板。每种药剂设置5个不同的含量,取6 mm的菌饼接种于各个平板中央,28 ℃培养5 d,使用十字交叉法测量菌落直径。按照公式计算抑菌率。
1.3 数据处理及分析
试验数据使用Excel计算方差与平均值,通过SPSS 21计算不同药剂的EC50值,采用Duncan新复极差法进行差异显著性分析(P<0.05),使用GraphPad Prism 8.0进行科研绘图。
2 结果与分析
2.1 形态学观察
菌株HD-1在PDA上28 ℃培养5 d后菌落直径为(74.44±1.66) mm。菌落在1~4 d内呈白色,5 d后中央由白色变为灰至黑色[图1(a)],背面产生黑色沉淀[图1(b)];菌落边缘整齐,呈圆形,颜色较浅,白色至浅灰色;菌落正面着生气生菌丝,浅灰色。菌丝茂密,直径为(4.98±0.75) μm[图1(c)]。分生孢子无色、无弯曲、光滑、椭圆形、基部钝圆或稍尖,大小约(0.93±0.10) μm×(0.38±0.06) μm[图1(d)]。附着胞圆至椭圆形,边缘光滑、规则,偶尔有不规则状[图1(e)]。

(a)菌落正面(5 d);(b)菌落反面(5 d);(c)菌丝;(d)分生孢子;(e)附着胞。
2.2 菌株HD-1致病性检测
结果显示,刺伤4 d后发病,发病部位呈现黑色轮纹状,边缘有黄色晕圈产生,与田间症状一致,见图2。对发病部位进行分离仍能得到所接种的菌株,通过柯赫氏法则确定该菌株为橡胶炭疽病的病原菌。
2.3 菌株HD-1分子生物学鉴定
通过测序得到菌株HD-1的ITS基因的部分片段大小为573 bp。将测序所得序列在NCBI-nucleotide数据库中进行比对,使用MEGA 7.0对HD-1-ITS及下载的各菌株的ITS序列进行系统发育树构建。如图3所示,该菌株与胶孢炭疽菌复合菌群中的C.fructicola聚为一个分支,综上结合形态学观察,将菌株HD-1鉴定为果生刺盘孢菌C.fructicola。
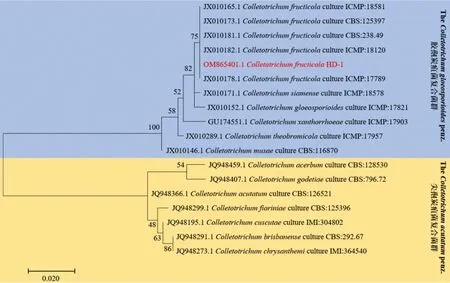
图3 系统发育树
2.4 菌株HD-1生物学特性
2.4.1 培养基对菌丝生长的影响
在测定的10种培养基中(图4),最适HD-1生长的培养基是PDA,在第5天时菌落平均直径为(74.44±1.66) mm,平均生长速率为14.89 mm/d;在LB上菌落直径为(73.94±1.04) mm,平均生长速率为14.79 mm/d,但菌丝生长稀疏;在MBM、CD、NYG和YEPD上菌落直径分别为(71.57±1.45)、(69.14±0.75)、(61.56±2.80)和(59.38±4.31) mm,平均生长速率分别为14.31、13.83、13.31和11.88 mm/d;HD-1在CM、SDA和SDAY上生长相对较差,菌落直径分别为(57.71±1.49)、(52.45±0.77)和(50.73±3.45) mm,生长速率分别为11.54、10.49和10.15 mm/d;HD-1在PSA上生长最不好,菌落平均直径为(43.73±0.64) mm,平均生长速率8.75 mm/d。
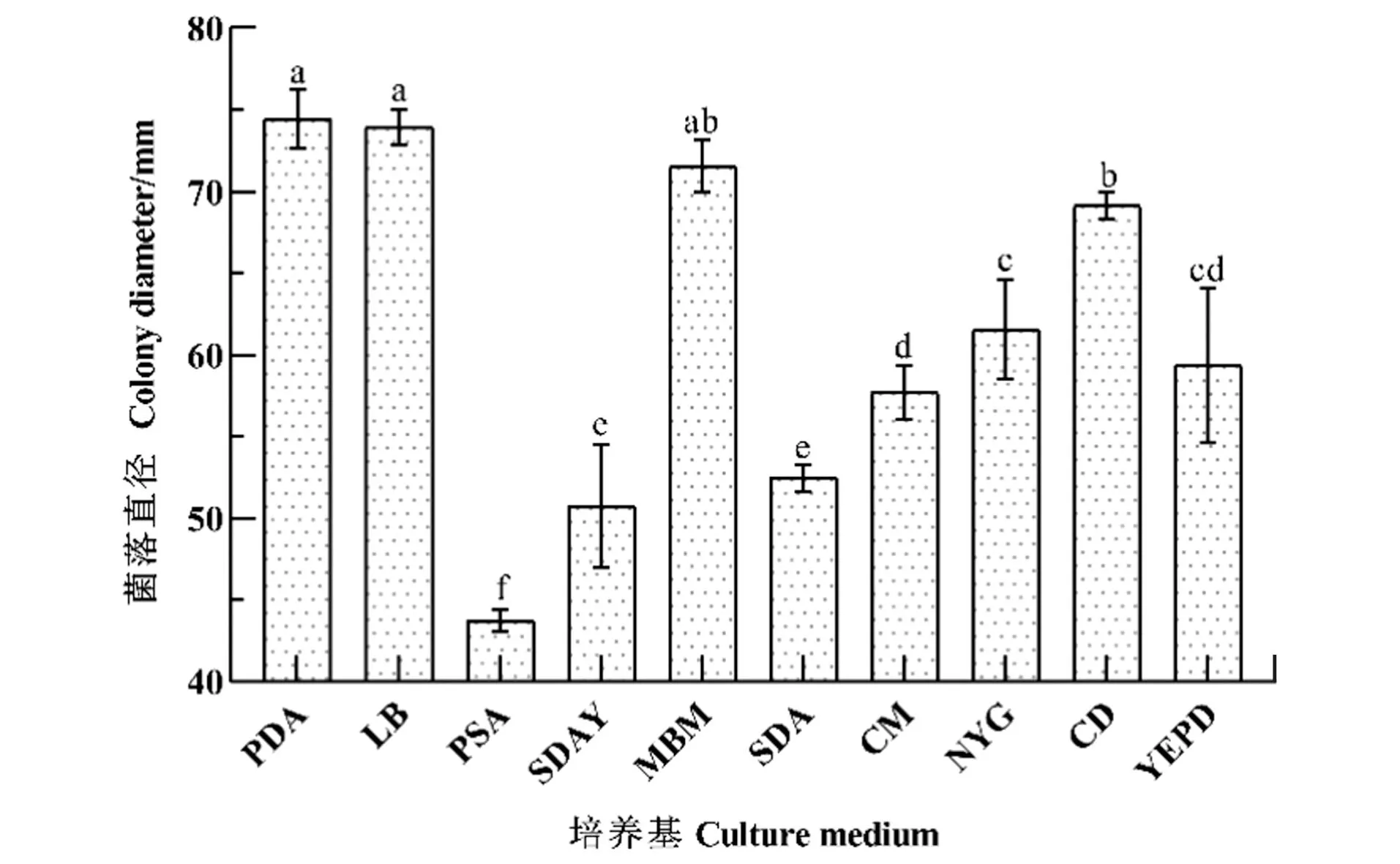
数据为平均数±标准误,不同小写字母表示经Duncan检验法检验差异显著(P<0.05)。
2.4.2 pH对菌丝生长影响
菌株HD-1在pH 4.0~10.0的范围内均能生长(图5),pH值在7.0~10.0时,菌落大小相近,且菌丝生长都较为密集,最适pH值为8.0,其菌落直径为(70.37±1.44) mm,平均生长速率为14.07 mm/d,这一结果说明该菌株对pH的适应范围较广。
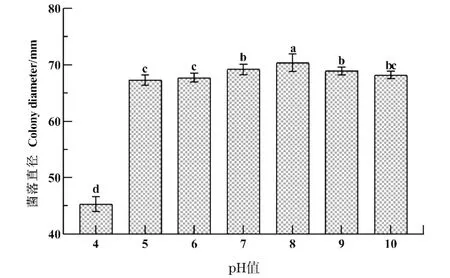
数据为平均数±标准误,不同小写字母表示经Duncan检验法检验差异显著(P<0.05)。
2.4.3 碳源对菌丝生长的影响
如图6,菌落生长5 d后,在山梨醇和甘露醇为碳源的培养基上菌落直径显著大于其他碳源,分别为(59.41±1.19) mm和(58.53±1.69) mm,平均生长速率分别为11.88和11.71 mm/d;在含有麦芽糖、果糖和蔗糖培养基上分别为(49.39±1.32)、(48.77±2.77)和(48.53±1.22) mm,平均生长速率分别为9.88、9.75、9.71 mm/d,无显著差异;HD-1对葡萄糖的利用相对较差,菌落直径为(46.64±1.69) mm,平均生长速率为9.33 mm/d;以半乳糖为碳源的菌落直径仅(28.66±1.12) mm,平均生长速率为5.73 mm/d。
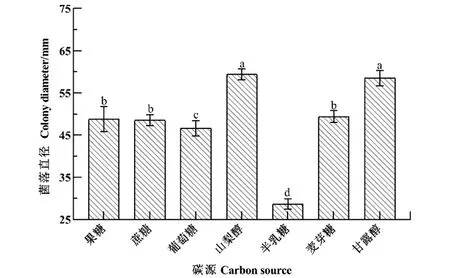
数据为平均数±标准误,不同小写字母表示经Duncan检验法检验差异显著(P<0.05)。
2.4.4 氮源对菌丝生长的影响
如图7,菌落生长5 d后,在以牛肉浸膏为氮源的培养基上菌落直径为(68.60±0.53) mm,平均生长速率达到13.72 mm/d,明显高于其他氮源;以硝酸钾、脯氨酸和甘氨酸作为氮源则生长较差,分别为(52.58±2.25)、(51.64±1.38)和(52.68±1.92) mm,平均生长速率为10.52、10.33和10.54 mm/d;以胰蛋白胨作为氮源的菌落生长较差,为(48.38±1.01) mm,平均生长速率为9.68 mm/d;以硫酸铵、氯化铵和谷氨酰胺为氮源不利于HD-1生长,菌落直径分别为(41.79±2.25)、(42.95±2.36)、(41.67±2.66) mm,平均生长速率分别为8.36、8.59、8.33 mm/d。
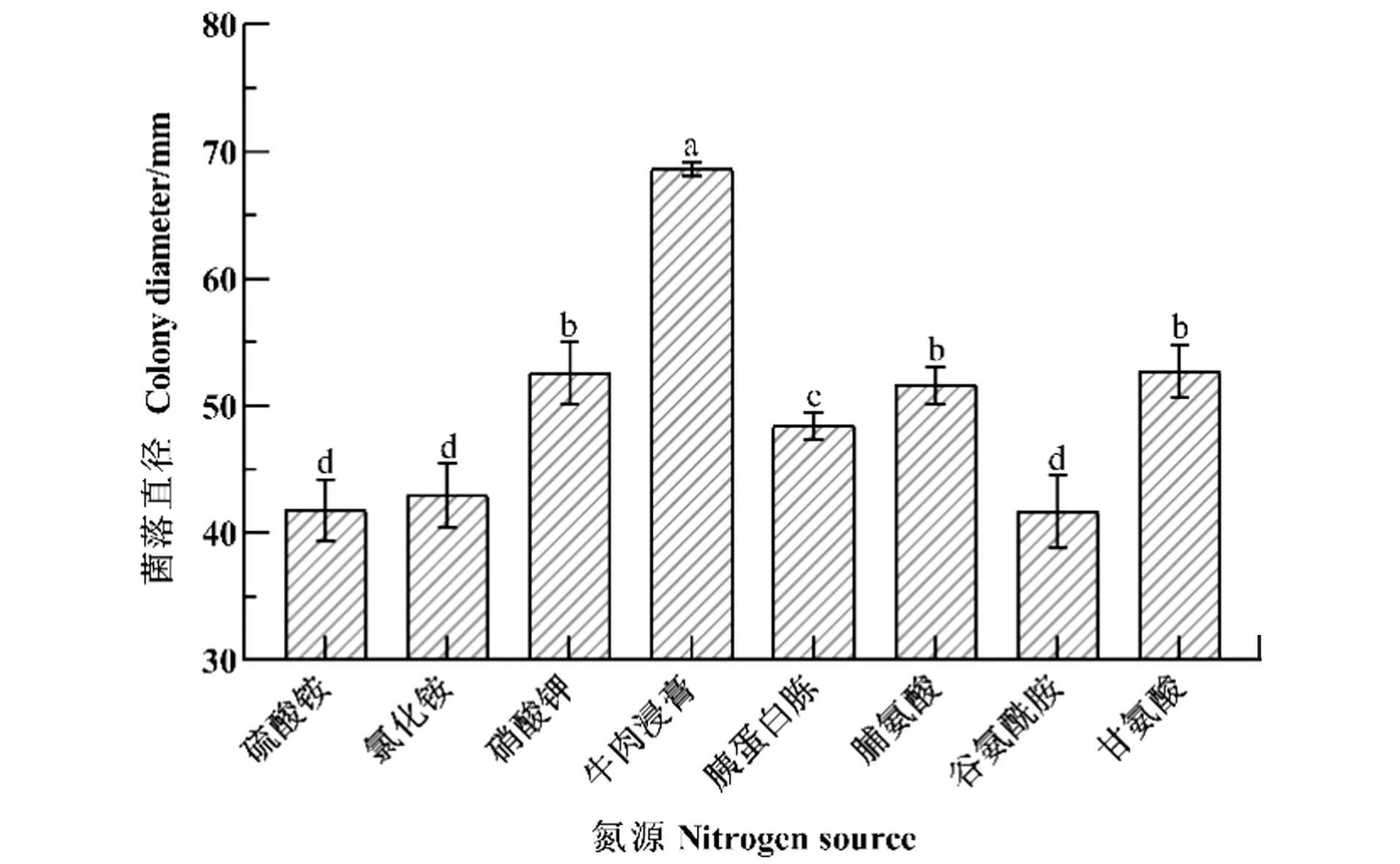
数据为平均数±标准误,不同小写字母表示经Duncan检验法检验差异显著(P<0.05)。
2.4.5 室内毒力测定
5种不同药剂对菌株HD-1毒力测定结果(表3)显示,咪鲜胺、苯醚甲环唑、三环唑、锰锌·三唑酮和HN-2正丁醇提取物的EC50值分别为0.12、19.31、102.50、415.76和56.77 μg/mL。如图8所示,在含有HN-2正丁醇提取物的培养基上生长的菌株HD-1,菌落背面出现了明显的黑化现象,同时对菌丝进行显微观察,可以明显观察到菌丝膨大成球状,而在含有三环唑的培养基上生长的菌株HD-1,菌落背面呈现深红色。
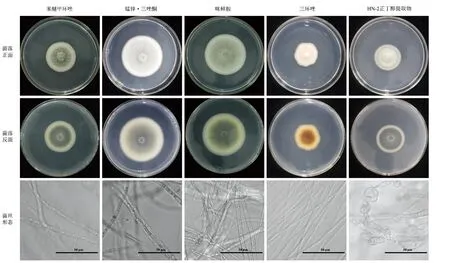
图8 不同药剂处理的菌落图片及菌丝观察
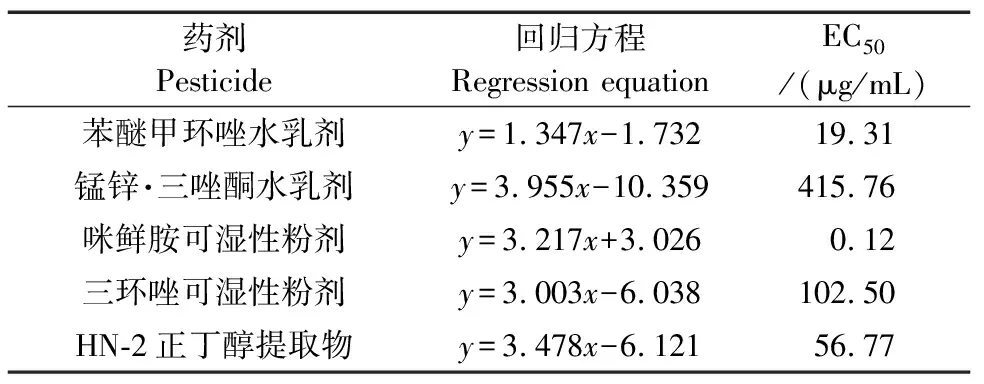
表3 药剂对菌株HD-1的室内毒力
3 讨论
由橡胶炭疽菌引起的橡胶树炭疽病是一种常见的病害,会影响橡胶树的产胶量,严重时会导致橡胶树死亡,造成经济损失。经过形态学与分子生物学鉴定和形态学观察,初步鉴定菌株HD-1为果生刺盘孢菌C.fructicola。林春花等[22]对在云南、海南、广东和广西等4处垦区的橡胶树病叶上分离得到的病原菌进行鉴定,有22株胶孢炭疽菌和15株尖孢炭疽菌;有研究表明,果生刺盘孢菌不仅可以侵染橡胶树,还可以在多个寄主植物上分离得到,例如油茶、臭椿、枫香和草莓等[23]。
使用生长速率法,测定不同培养基、pH、碳源和氮源对该菌生长的影响。在测定的培养基中,该菌在PDA培养基上生长情况最好;在测定的pH范围内,最适生长的pH值为8;在测定的碳源、氮源中,菌株HD-1对山梨醇和牛肉浸膏的利用最好。不同培养基对菌丝生长的影响与菌种有关,姚英等[24]认为马铃薯蔗糖琼脂培养基最有利于胶孢炭疽菌CB-2的生长,而在PDA培养基上的菌落直径显著降低。雷娇娇等[25]的实验中,菌落的直径大小由SNA培养基、OA培养基到PDA培养基依次递减;这些结果与本实验结果不同之处可能是由菌株差异、生理差异、培养基中其他成分的含量不同所造成的。在pH方面,本实验的研究结果与陈贵华[26]的研究结果相符,他认为酸碱度对菌丝生长的影响不大,pH值在4~10的范围内菌丝均能较好生长。不同菌株对pH的适应能力也有所不同:舒娟[27]对果生刺盘孢菌HN47-2和GZ15-1的研究发现,这两种菌株生长最适pH值为5;对油茶上分离出的代表性果生刺盘孢菌DHYC14研究发现,该菌株喜弱酸性环境,生长最适pH值为5~7[28]。在碳源和氮源方面,对闽楠上分离的胶孢炭疽菌的研究发现,分别以麦芽糖和酵母浸膏为碳源和氮源时菌落直径最大[24];李戌清等[29]研究的三叶青株系则在以山梨醇为碳源,牛肉浸膏为氮源的培养基上生长最好,而氯化铵对菌丝生长有一定的抑制作用。
同一药剂对同一复合种内的不同菌株也有不同的毒力,于秀敏等[30]使用6种不同的杀菌剂对一株胶孢炭疽菌进行了毒力测定,结果显示25%咪鲜胺的抑菌效果最好,其EC50仅有0.117 5 μg/mL。有研究表明[31]在9种杀菌剂对柱花草炭疽病的毒力测定中,咪鲜胺和苯醚甲环唑的抑菌效果最好,其EC50在0.032 3~0.735 2 μg/mL,三唑酮的抑菌效果最差,EC50为285.219 8 μg/mL。在周子骞等[32]对胶孢炭疽菌的毒力测定实验中,苯醚甲环唑的EC50为0.84 μg/mL,代森锰锌的毒力则较差,EC50为4 830.14 μg/mL,这可能是由于菌株产生了抗药性,而本实验中由代森锰锌和三唑酮复配的药剂锰锌·三唑酮的EC50却达到415.76 μg/mL,这可能与菌株的寄主、分离部位不同有关。咪鲜胺作为咪唑类杀菌剂,通过抑制麦角甾醇生物合成起到抑菌效果,对病原菌的抑制作用最强,EC50为0.12 μg/mL;苯醚甲环唑、HN-2正丁醇提取物、三环唑和锰锌·三唑酮的抑菌效果依次下降,锰锌·三唑酮的EC50达到415.76 μg/mL;生物防治由于其自身的优势被广泛应用于植物病害的防治中,高宇等[33]对B.malacitensisZ-5菌株的抑菌物质进行鉴定,其主要成分为脂肽抗生素C14Surfactin B,C14~C17Iturin A,C14、C15、C17Iturin B等;竺利红等[21]针对贝莱斯芽孢杆菌SM905对胶孢炭疽菌的抑菌活性进行了研究,发现其5倍稀释的发酵上清液对胶孢炭疽菌的抑制活性达到了97.89%,且经过处理的气生菌丝会表现为畸形、空洞、色素积累,且萌发后的菌丝稀疏、膨大,这些研究都与本实验结果相符。赵雅等[34]对贝莱斯芽孢杆菌HN-Q-8的发酵液活性成分分析后,鉴定其活性物质成分为丰源素(Fengycin)和表面活性素(Surfactin)。通过MALDI-TOF-MS对HN-2正丁醇提取物进行分析,发现其产生的脂肽类物质可能有伊枯草菌素A(C14、C15、C18Iturin A)、伊枯草菌素B(C13-14Iturin B)、杆菌霉素F(C14、C17Bacillomycin F)、杆菌霉素D(C14-15Bacillomycin D)、抗霉枯草菌素(C15Mycosubtilin)、表面活性素A(C13-14Surfactin A)、表面活性素B(C13-15Surfactin B)、表面活性素C(C13-14Surfactin C)和丰源素A(C14-16Fengycin A),这表明B.velezensisHN-2不仅可以产生表面活性素和伊枯草菌素,还可以产生杆菌抗霉素(Bacillomycin)和抗霉枯草菌素(Mycosubtilin),HN-2的抑菌粗提物在低浓度下就可以起到较好的抑菌效果,EC50仅为56.77 μg/mL。
值得注意的是,在含有HN-2正丁醇提取物的培养基上生长的HD-1的菌丝,通过显微观察可以发现其菌丝明显膨大,这与以往研究所证明的贝莱斯芽孢杆菌通过使病原菌菌丝畸形起到抑菌作用相符合,并且在本实验中所使用的三环唑属于细胞黑色素生物合成抑制剂,所以经过三环唑处理后的该菌菌落反面并非呈现灰色而是深红色,然而通过平板实验观察发现生防菌HN-2处理后的菌落呈深黑色。
4 结论与展望
研究对菌株HD-1进行了鉴定,确定了其种类,研究了其生物学特性,并测定了5种药剂对其的室内毒力,为防治橡胶树炭疽病提供一定的理论数据支持。同时发现在含有HN-2正丁醇提取物的PDA培养基上生长的HD-1菌株出现了黑色素过量积累的现象,我们推测HN-2正丁醇提取物可能对菌株HD-1是一种可以诱导黑色素合成的逆境物质,并且可能会通过影响菌体中的某个通路或者某个基因来影响黑色素的合成,并且发生在菌丝上的膨大现象也可能与贝莱斯芽孢杆菌抑菌机理相关,我们将对这其中的作用机理进行探究。生防菌HN-2对菌株HD-1有良好的活性,说明该菌株可以作为一种生防菌剂,具有良好的开发利用前景。
