不同体质量黄鳍金枪鱼能量代谢相关酶活性与基因表达
2023-12-21符文雅郭志强
李 倩,李 钰,符文雅,肖 娟,黄 海,郭志强,4
(1.海南大学生命健康学院,南海海洋资源利用国家重点实验室,海南 海口 570228;2.海南大学食品科学与工程学院,海南 海口 570228;3.热带海洋生物资源利用与保护教育部重点实验室,海南省热带海洋渔业资源保护与利用重点实验室,海南热带海洋学院水产与生命学院,海南 三亚 572022;4.海南大学海洋科学与工程学院,海南 海口 570228)
金枪鱼(Thunnus)肉质鲜美,富含蛋白质、脂质、不饱和脂肪酸等多种营养物质,备受消费者喜爱,具有很高的市场需求[1]。黄鳍金枪鱼(Thunnus albacares)是金枪鱼的一种,具有游泳速度快、高代谢能力特点[2]。研究表明,在常规游泳速度条件下,黄鳍金枪鱼的氧代谢率为776 mg/(kg·h),约为其他硬骨鱼的6~8 倍[3]。此外,黄鳍金枪鱼可以通过增强心血管系统,增大鳃表面积来实现高代谢率[4]。有研究发现,糖原作为肌肉能量产生的关键底物,同时也是潜在的能量储存库,能够维持多种鱼类能量平衡[5-6]。鱼体内代谢受相关酶活性的影响,且代谢酶活性与基因表达调控有关[7-8]。因此,组织代谢能力高低可通过测定组织糖原含量、能量产生途径中关键代谢酶活性和相关基因的表达来评估。
鱼类的生长发育过程中,其体质量与鱼体代谢密切相关。Schultz 等[9]发现,高温条件下大西洋银汉鱼(Menidia menidia)小鱼相比大鱼消耗更多能量。Churova等[10]研究发现,大西洋鲑(Salmo salar)肌肉组织碳水化合物代谢相关酶活性与体质量呈正相关。此外,Vornanen 等[11]研究发现,小型黑鲫(Carassius carassius)的糖原储存含量明显高于大型黑鲫。黄鳍金枪鱼在其生长发育过程中,体质量变化很大,最大可达225 kg,从小鱼到大鱼不同阶段对能量的需求不同。同时,黄鳍金枪鱼为维持持续的游泳需要消耗大量能量,其运动和能量代谢与骨骼肌密切相关[12]。骨骼肌是维持全身代谢和运动的重要组织,根据功能主要分为两种类型:白色肌肉(下文简称“白肌”)和红色肌肉(下文简称“红肌”)[13]。白肌主要依赖于糖酵解支持的无氧代谢供能进行爆发性运动,红肌主要依赖于有氧代谢供能进行持续肌肉收缩运动[14],已经在多种鱼类的研究中被证实。Shibata 等[15]研究发现,太平洋蓝鳍金枪鱼(Thunnus orientalis)通过增加白肌中无氧代谢基因的表达和红肌中有氧代谢基因的表达来产生大量能量。Gao 等[16]对红鳍东方鲀(Takifugu rubripes)红肌和白肌组织研究发现,红肌比白肌具更好的氧化酶水平。另外,Wu 等[17]也在罗非鱼(Oreochromis niloticus)的肌肉组织中发现,白肌主要参与爆发性的肌肉收缩运动,红肌主要参与持续的肌肉收缩运动。
目前,国内金枪鱼人工养殖技术仍处于初步探索阶段,仅见南海水产研究所开展相关研究[18],且关于黄鳍金枪鱼红肌和白肌的能量代谢研究较少,也尚未见不同体质量黄鳍金枪鱼能量代谢差异的研究。基于此,本研究选取不同体质量的黄鳍金枪鱼红肌和白肌组织作为研究对象,通过对不同肌肉组织中糖原含量、能量代谢相关酶活性和基因表达量进行测定,探讨不同体质量下黄鳍金枪鱼肌肉组织能量代谢差异,了解不同生长阶段黄鳍金枪鱼的能量需求,为优化金枪鱼养殖方案,推动人工金枪鱼养殖产业发展提供理论依据。
1 材料与方法
1.1 材料
黄鳍金枪鱼样品于2022年5月以海钓的方式捕获于南海中部海域(17°41'N~18°17'N,110°60'E~112°14'E),共收获9 尾黄鳍金枪鱼样品。黄鳍金枪鱼样品捕获上船后,用1 g/L的MS-222(上海麦克林生化科技有限公司)进行麻醉处理30 s,立即解剖样品,采取红肌和白肌组织(白肌取自腹部肌肉,红肌取鱼体腹部侧线附近肌肉)。然后立即放入1.5 mL无菌离心管中并用液氮冷冻,后转移至-80 ℃冰箱保存待用。根据各样本体质量大小和性腺发育特征[19],将样品分为小鱼(0.85±0.03)kg、中鱼(9.77±0.15)kg 和大鱼(19.63 ± 0.37)kg 三个体质量组,样品基本信息如表1所示。

表1 不同体质量组黄鳍金枪鱼统计表Table 1 Statistical table of Thunnus albacares of different body mass groups
1.2 肌肉组织酶活性测定
称量各体质量组红肌和白肌组织样本,按照质量∶体积=1 g∶9 mL 的比例,加入提取液进行机械破碎以制备匀浆,在4 ℃、10 000 r/min 条件下离心10 min,取上清匀浆液。采用考马斯亮蓝法测定上清液中蛋白(TP)浓度,采用动力学方法用柠檬酸合成酶(CS)、琥珀酸脱氢酶(SDH)、己糖激酶(HK)、丙酮酸激酶(PK)、磷酸果糖激酶(PFK)、乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)和糖原试剂盒(南京建成生物工程研究所和北京索莱宝科技有限公司)测定不同体质量组红肌和白肌组织相关酶的活性以及糖原含量。其中CS、MDH、SDH、LDH 酶活性和蛋白浓度测定温度条件为37 ℃;HK、PK 和PFK酶活性测定温度条件为25 ℃;糖原含量在沸水浴条件下进行测定。
1.3 基因表达分析
用Trizol 试剂根据试剂盒说明提取肌肉组织的总RNA,然后用琼脂糖凝胶电泳、Nano Drop 2000C超微量分光光度计检测RNA 浓度和纯度。用诺唯赞生物试剂反转录合成cDNA,放置于-40 ℃用于测定基因表达量。依据NCBI 数据库中黄鳍金枪鱼基因组数据[Thunnus albacares-NCBI-NLM(nih.gov)]用Primer Premier5软件设计相关基因引物,并由擎科生物公司合成具体的基因引物序列如表2所示。最后以β-actin作为内参基因,使用SYBR qPCR试剂盒进行实时荧光定量PCR反应,并用2-ΔΔCt法计算基因表达量。

表2 实时荧光定量PCR引物序列Table 2 Real-time quantitative PCR primer sequence
1.4 数据分析与处理
所有实验均进行三次重复,结果均以平均值±标准误差(Mean ± SE)表示,使用IBM SPSS Statistics 23 软件进行分 析,GraphPad Prism 9.0 作图。当数据符合正态分布时使用单因素方差分析(One-Way ANOVA)和独立样本t检验,不符合正态分布时采用Kruskal-Wallis 和Mann-Whitney 检验,以P<0.05 表示差异显著,P<0.01 表示差异极显著。采用双因素方差分析(Two-way ANOVA)方法对体质量和肌肉类型进行分析。
2 结果与分析
2.1 不同体质量黄鳍金枪鱼糖原含量差异分析
如图1所示,与小鱼组相比,红肌糖原含量在中鱼组和大鱼组显著增加,且在大鱼组达到最大值(F=168.435,P<0.001)。白肌糖原含量在中鱼组最高,在大鱼组最低,且在三个体质量组中,红肌的糖原含量均极显著高于白肌(小鱼F=5.876,P=0.009;中鱼F=2.115,P<0.001;大鱼F=0.846,P<0.001)。
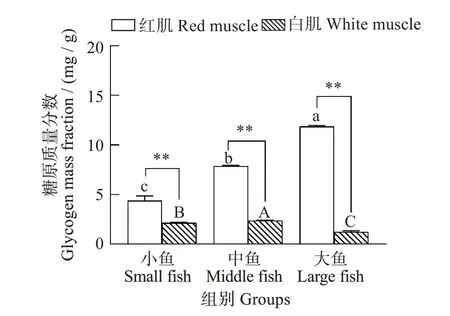
图1 不同体质量(小、中、大)黄鳍金枪鱼糖原含量Fig.1 Glycogen content in Thunnus albacares with different body mass(small,middle,and large)
2.2 不同体质量黄鳍金枪鱼无氧代谢关键酶活性和基因表达量差异
与无氧代谢相关的关键酶HK、PK、LDH 和PFK的酶活性测定和相关基因hk、pk、ldh和pfk的表达结果如图2 所示。红肌和白肌中HK 活性均在大鱼组最高,且显著高于小鱼组和中鱼组(红肌F=72.627,P<0.001;白肌F=168.730,P<0.001)。除小鱼组外,中鱼和大鱼组白肌的HK 活性显著高于红肌(中鱼F=1.249,P=0.022;大鱼F=2.638,P=0.007)(图2(A))。红肌和白肌中PK 活性均在大鱼组最高(红肌F=17.466,P=0.003;白肌F=51.567,P<0.001),且大鱼组白肌PK 活性显著高于红肌(F=2.067,P=0.018)(图2(C))。红肌和白肌中LDH 活性均在在大鱼组最高,在小鱼组最低(F=9.127,P=0.015),小鱼组和中鱼组红肌和白肌LDH活性差异不显著(小鱼F=5.285,P=0.986;中鱼F=0.606,P=0.309),但大鱼组白肌LDH 活性显著高于红肌(F=4.747,P=0.020)(图2(E))。红肌中PFK 活性差异不显著(F=2.374,P=0.174),与小鱼组相比,大鱼组白肌中PFK 活性增加。除小鱼组外,白肌中PFK 活性均显著高于红肌,并且在中鱼组差异最大(F=1.614,P=0.006)(图2(G))。
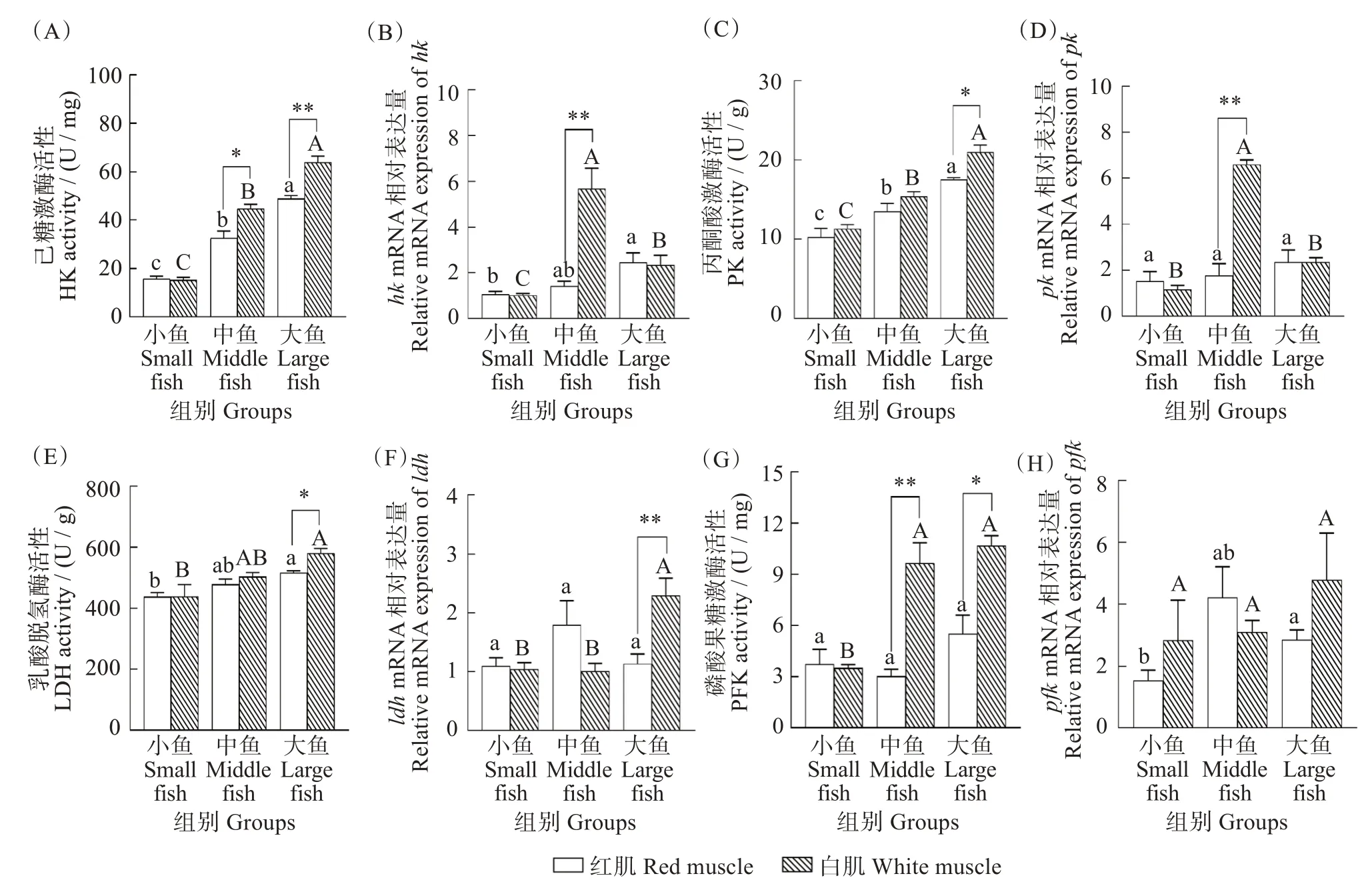
图2 不同体质量(小、中、大)黄鳍金枪鱼无氧代谢关键酶活性和基因表达Fig.2 Activities of key enzymes and gene expression in anaerobic metabolism of Thunnus albacares with different body mass(small,middle,and large)
对应基因的表达结果显示,红肌中大鱼组hk基因表达量显著高于其他两组(H=7.101,P=0.029),白肌中中鱼组hk基因表达量最高,并且极显著高于红肌(Z=-3.991,P<0.001)(图2(B))。红肌pk基因表达量在三个体质量组中差异不显著(H=3.067,P=0.216),白肌中pk基因表达量在中鱼组表达量最高,并且极显著高于红肌(Z=-4.160,P<0.001)(图2(D))。三个体质量组中红肌ldh基因的表达量无明显差异(H=0.470,P=0.790),白肌中ldh基因的表达量在大鱼组最高,并且显著高于红肌(Z=-3.235,P=0.001)(图2(F))。红肌中中鱼组和大鱼组pfk基因的表达量显著高于小鱼组,且在中鱼组表达量最高(H=8.031,P=0.018),白肌中pfk基因表达量与体质量变化整体差异显著(H=6.568,P=0.037),且在三个体质量组中红肌和白肌pfk基因表达量均无明显差异(图2(H))。
2.3 不同体质量黄鳍金枪鱼有氧代谢关键酶活性和基因表达量差异
与有氧代谢相关的关键酶CS、SDH 和MDH 的酶活性和cs、sdh和mdh三个基因的表达量结果如图3所示。红肌和白肌两种组织中CS活性均在大鱼组最高,且显著差异(红肌F=1529.123,P<0.001;白肌F=17.047,P=0.003)。所有体质量组中红肌CS活性均显著高于白肌(小鱼F=2.180,P=0.022;中鱼F=0.813,P<0.001;大鱼F=12.463,P=0.004),(图3(A))。与小鱼组和中鱼组相比,大鱼组红肌和白肌组织中SDH 活性最高(红肌F=212.623,P<0.001;白肌F=81.969,P<0.001)。小鱼组和中鱼组SDH 活性在红肌和白肌之间没有差异,大鱼组红肌SDH 活性显著高于白肌SDH 活性(F=0.883,P=0.011)(图3(B))。红肌和白肌组织中MDH活性均在大鱼组最高,在小鱼组最低,且差异显著(红肌F=43.606,P<0.001;白肌F=14.848,P=0.005)。红肌MDH 活性仅在小鱼组显著高于白肌(F=0.122,P=0.031),中鱼组和大鱼组无明显差异(图3(C))。
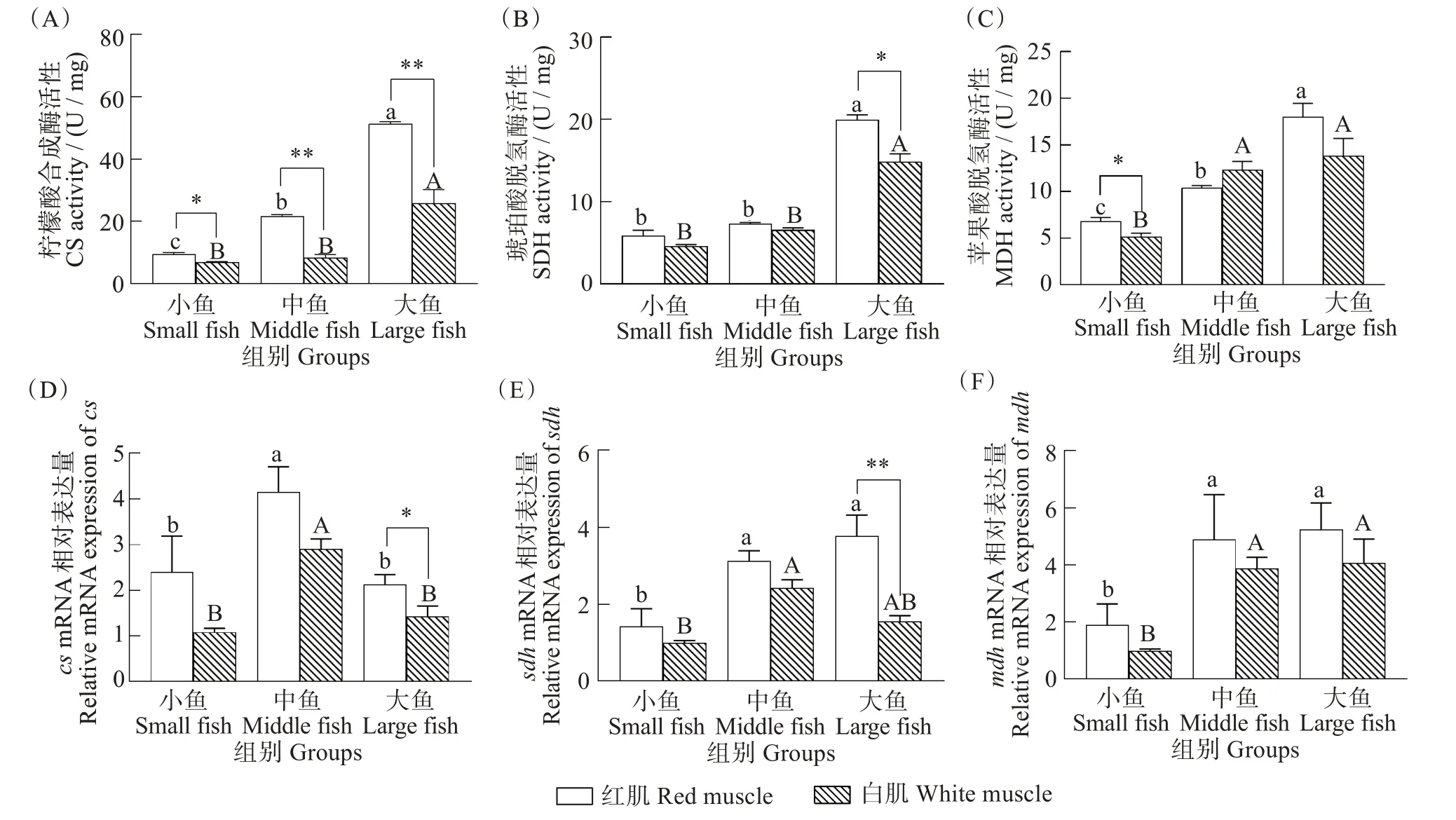
图3 不同体质量(小、中、大)黄鳍金枪鱼有氧代谢关键酶活性和基因表达Fig.3 Activities of key aerobic enzymes and gene expression in Thunnus albacares with different body mass(small,middle,and large)
有氧代谢关键酶cs、sdh和mdh三个基因的表达量测定结果显示,红肌和白肌中cs基因的表达量在中鱼组显著高于小鱼组和大鱼组(红肌H=10.051,P=0.007;白肌H=17.351,P<0.001),并且在大鱼组红肌cs基因的表达量显著高于白肌(Z=2.102,P=0.034)(图3(D))。红肌中sdh基因表达量在大鱼组最高,且与小鱼组差异显著(H=9.462,P=0.009);白肌中中鱼组sdh基因表达量最高,显著高于小鱼组(H=17.983,P<0.001),且在大鱼组红肌sdh基因的表达量与白肌sdh基因的表达量差异极显著(Z=2.922,P=0.002)(图3(E))。与小鱼组相比,中鱼和大鱼组红肌和白肌mdh基因的表达量显著增加(中鱼H=9.145,P=0.010;大鱼H=21.528,P<0.001),但三个体质量组红肌和白肌之间mdh基因表达量无明显差异(小鱼Z=-1.807,P=0.076;中鱼Z=-1.084,P=0.300;大鱼Z=0.230,P=0.847)(图3(F))。
2.4 不同体质量黄鳍金枪鱼代谢酶活性和基因表达量方差分析
关键代谢酶活和基因表达测定方差分析结果如表3 所示。体质量、肌肉类型以及体质量×肌肉类型3 种效应会显著影响HK、PFK、CS、SDH 活性和糖原含量(P<0.05)。PK活性的体质量和肌肉类型的主效应差异显著(P<0.05),体质量×肌肉类型交互作用不显著(P>0.05)。LDH 活性的体质量主效应差异显著(P<0.05)。MDH活性的肌肉类型主效应差异不显著(P>0.05),体质量主效应和体质量×肌肉类型交互作用差异显著(P<0.05)。

表3 酶活性和基因表达测定的方差分析结果Table 3 ANOVA results of enzyme activity and gene expression determinations
基因表达量与体质量,肌肉类型和体质量×肌肉类型交互作用对hk、ldh、pfk、cs、sdh和mdh的基因表达量差异均不显著(P>0.05)。pk基因的表达量与体质量主效应,肌肉类型主效应和体质量×肌肉类型交互作用差异显著(P<0.05)。
3 讨论
3.1 不同体质量黄鳍金枪鱼糖原含量差异
动物机体中,葡萄糖主要以糖原的形式储存在肌肉组织,代谢时会迅速产生能量,供给肌肉收缩,因此肌肉组织的糖原的水平可以反映鱼体糖代谢的状态[20-22]。鱼类的两种肌肉组织具有不同的生理功能和代谢过程,白肌中糖代谢为分解代谢,糖酵解能力较高;红肌中糖代谢为合成代谢,糖原合成较多[23-24]。此外,也有研究表明,白肌中葡萄糖代谢远高于红肌[25]。在本研究中,红肌中糖原含量在大鱼组最高,且显著高于白肌组织,表明红肌比白肌具有更高的合成糖原能力,可为黄鳍金枪鱼的持续游泳运动储存能量[26]。另外,本研究也发现大鱼组白肌组织中糖原含量下降,表明白肌中糖原分解,为后续肌肉的无氧糖酵解代谢提供充足的能量底物[27]。
3.2 不同体质量黄鳍金枪鱼无氧代谢酶活性及相关基因表达差异
HK、PK、LDH 和PFK 是无氧代谢途径的关键酶,其活性可作为判别组织无氧代谢能力的指标。本研究发现,红肌和白肌组织中HK、PK 和LDH 活性均在大鱼组达到最大值,这与Davies 等[28]、Churova 等[29]的研究结果相似。同时,本研究发现大鱼组中白肌的HK、PK 和LDH 活性均显著高于红肌,表明当黄鳍金枪鱼个体体质量较大时,白肌组织具有较高的无氧代谢能力从而应对高度剧烈运动时的能量需求。PFK 是糖酵解途径的关键酶,本研究发现白肌组织中体质量越大,PFK 活性越高,该结果与大西洋鳕(Gadus morhua)[30]的研究结果相似,表明体质量会影响糖酵解酶PFK 活性,从而促进机体的无氧代谢能力。另外,笔者也发现体质量是影响HK、PK、LDH 和PFK 活性表达的主要因素。研究表明,糖酵解酶可能在蛋白质合成的所有阶段受到基因调控[31]。若酶活性与基因表达水平变化趋势同步,表明酶活性与基因转录调有关[32],不一致,则可能存在多种复杂调控机制[28]。本研究发现,白肌hk和pk基因表达量在小鱼组、中鱼组与相应的酶活性变化一致,而在大鱼组变化不一致,该结果同样体现在不同体质量的虹鳟(Oncorhynchus mykiss)[33]上,表明黄鳍金枪鱼在一定体质量范围内,HK 和PK 活性受hk和pk基因转录调控调节。但鱼体体质量较大时,hk和pk基因的表达量出现下降,这可能与白肌中糖酵解水平下降有关。本研究中白肌组织中ldh基因的表达量与白肌中LDH活性表达趋势相一致,表明在个体发育过程中,白肌LDH 活性的差异与基因转录调控有关[28]。本研究还发现不同体质量组pfk基因与酶的活性表达完全不一致,推测可能pfk与PFK 活性之间存在复杂的转录调控机制[34]。
3.3 不同体质量黄鳍金枪鱼有氧代谢酶活性及相关基因表达差异
鱼类在生长发育的过程中大部分依赖于有氧代谢提供能量[35]。CS、SDH 和MDH 是三羧酸循环途径的关键酶,可以用来评定组织的有氧代谢能力。本研究发现,随着黄鳍金枪鱼体质量的增加,红肌和白肌组织中CS、SDH 和MDH 活性显著增加,在大西洋鳕(G.morhua)[36]和黑鲔(Euthynnus lineatus)[37]中有相似结果,表明黄鳍金枪鱼体质量的增加会促进有氧代谢酶CS 活性的表达。同时,本研究发现不同体质量组黄鳍金枪鱼红肌组织CS活性显著高于白肌组织,表明红肌组织具有更高的有氧代谢能力,以应对持续的肌肉收缩所需的能量[38]。另外,笔者也发现,体质量差异是影响CS、SDH 和MDH 活性表达的主要因素。在本研究中,sdh、mdh的基因表达量与SDH、MDH 酶活性的表达相一致,并随着体质量的增加呈现先增加后稳定趋势,表明sdh、mdh基因转录调控SDH、MDH 活性的表达。此外,本研究也发现,cs基因表达量随体质量的增加呈现先增加后下降趋势,与CS 活性表达不一致,此研究结果与Burness等[33]和Dalziel等[39]研究结果相似,可能是随着黄鳍金枪鱼体质量的增加,鱼体内翻译效率更高,转录产生更多的蛋白质,从而维持CS活性所需基因表达量较少所致[40]。
4 结论
在本研究中,与小鱼组相比,大鱼组红肌中糖原含量显著升高,白肌中糖原含量显著下降,并且在不同体质量组中红肌糖原含量均显著高于白肌,表明不同体质量黄鳍金枪鱼肌肉组织糖代谢能力差异。体质量的增加会促进肌肉组织中代谢酶活性的表达,其中白肌中无氧代谢关键酶(HK、PK、LDH、PFK)活性高表达,红肌中有氧代谢关键酶(CS、SDH、MDH)酶活性高表达,并且体质量是影响酶活性表达的主要因素。另外,对酶活基因表达定量分析,发现体质量会影响基因表达,并且基因表达与酶活性之间存在复杂调控机制,此部分尚需进一步深入研究。
