富DHA-磷脂酰胆碱对双酚S致小鼠肝损伤的影响
2023-12-21董佳昱田姗姗唐云平
董佳昱,田姗姗,钱 丽,姜 苏,唐云平
(1.浙江海洋大学食品与药学学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022;2.上海欧睿生物科技有限公司,上海 201101)
双酚A(Bisphenol A,BPA)是一种工业广泛使用的化合物,通常用于合成聚碳酸酯塑料、环氧树脂和其他聚合物材料[1,2],其可导致多种生殖毒性、肝肾损伤、糖尿病、血脂异常等毒性效应[2,3]。作为BPA的主要替代品之一,双酚S(BPS)其结构更稳定且更不易被生物降解[4],近年来其被广泛用于塑料、奶瓶、牙科材料、品罐内涂层和包装等产品中[5,6]。然而,近年来同样发现,BPS 能从各种产品中浸出,可进入水体、土壤、空气等并最终导致人体暴露[6]。BPS 暴露可引起内分泌紊乱、氧化应激和肝损伤等毒性效应[7,8]。
富二十二碳六烯酸-磷脂酰胆碱(DHA-PC)是一种富含DHA 的特殊海洋磷脂,其结构特征是sn-3位置结合磷脂酰胆碱,sn-2 位置结合的多不饱和脂肪酸以DHA 和二十碳五烯酸EPA 为主,具有缓解氧化应激损伤、降脂、护肝、护肾、调节肠道菌群等生物学功效[9-11]。马琴等[12]发现DHA-PC 对小鼠血清和肝脏中的胆固醇(TC)、甘油三酯(TG)含量有明显降低效果,同时能够提高肝脏及大脑中DHA含量。Zhang 等[13]发现DHA-PC 可通过调节脂质水平异常、线粒体和内质网膜结构形态和功能变化来改善高脂高果糖饮食诱导的小鼠非酒精性脂肪肝(NAFLD)。笔者前期研究发现,大西洋鲱(Clupea harengus)鱼籽的DHA-PC 可通过调节“肠-肝轴”来缓解高脂饮食导致的小鼠NAFLD[14]。然而,DHAPC 是否可缓解BPS 导致的氧化应激和肝损伤的研究目前尚未见报道。
本研究拟通过通过边造模边给药的方式,于小鼠饮用水中加入5 mg·(kg·d)-1的BPS,同时灌胃80 mg·(kg·d)-1的DHA-PC,饲喂10 周,后通过肝脏病理切片、氧化应激、炎症和脂质等指标综合评价DHA-PC对BPS导致的小鼠氧化应激和肝损伤的缓解作用,以期提供一种缓解双酚S 导致的氧化应激和肝损伤的可能策略。
1 材料与方法
1.1 材料与试剂
DHA-PC 是由本课题组从大西洋鲱(C.harengus)鱼籽中提取,其中DHA 质量分数为242 mg·g-1、EPA 质量分数为88 mg·g-1、PC 质量分数为461 mg·g-1[14]。所用的雄性C57BL/6 小鼠[n=24,5~6 周,(18±2)g]购自杭州子源实验动物科技有限公司(中国杭州)。在SPF 级环境[12 h/12 h 明暗循环,(23±2)℃]饲养。
谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆固醇(TC)、甘油三酯(TG)、游离脂肪酸(NEFA)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、总抗氧化能力(T-AOC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)测定试剂盒和苏木精-伊红(H&E)染色试剂盒均购自于南京建成生物工程研究所。白介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α测定试剂盒购自于武汉伊莱瑞特生物科技有限公司。
1.2 主要仪器与设备
酶标仪(美国Molecular Devices 公司);切片机(上海徕卡仪器有限公司);手持均质仪(北京兰杰柯科技有限公司);超声波细胞破碎仪(美国SONICS公司);光学显微镜CX31(日本Olympus)。
1.3 方法
1.3.1 实验设计 动物实验获得浙江海洋大学科研伦理与诚信委员动物伦理委员会批准(许可证No.2021038)。适应性喂养1 周后,将小鼠随机分为3 组(n=8),即对照组(CON)、模型组BPS 组[5 mg· (kg·d)-1BPS] 和给药组DHA-PC 组[5 mg·(kg·d)-1BPS+80 mg·(kg·d)-1DHA-PC]。配制50 mg/mL BPS乙醇溶液,取50 μL加入到100 mL饮用水中(0.25 mg/mL),按照每只20 g 小鼠每天饮水4 mL的剂量喂养,使模型组和实验组小鼠BPS摄入量约为5 mg·(kg·d)-1,后期按照小鼠体质量及时调整BPS 的加入量。同时,对照组的饮用水(100 mL)中加入50 μL乙醇。给药组小鼠除摄入含有BPS 的饮用水外,每天灌胃80 mg/kg DHA-PC。连续喂养10周,记录小鼠每天的饮水量和食物摄入量,根据能量摄入量=食物摄入量×饲料含能量得出数据。末次处理后,小鼠禁食(不禁水)24 h,称其质量并记录,用体积分数10%水合氯醛麻醉后对小鼠进行眼球取血并进行解剖,完整取出肝脏、附睾脂肪并称其质量。完整摘除肝脏并保存于-80 ℃冰箱用于后续的生化检测和病理实验。脏器指数=器官质量/体质量。
1.3.2 肝功能指标测定 称取0.1 g的小鼠肝脏,加入0.9 mL质量分数0.9%的生理盐水,用手持均质仪均质,即得质量分数10%的肝组织匀浆液。肝匀浆中的AST和ALT含量按照试剂盒中的说明进行测定。
1.3.3 肝脏组织病理学分析 将肝脏组织修剪至1 cm×1 cm 大小,置于质量分数4%的多聚甲醛中固定24 h。之后进行脱水、包埋及切片。按照试剂盒说明书进行H&E 染色,并在光学显微镜CX31 下拍摄观察切片染色状况。
1.3.4 肝脏组织炎症因子、脂质、抗氧化指标等含量测定 按照1.2.2节方法制备质量分数10%的肝脏组织匀浆液。肝匀浆中的IL-6、IL-1β、TNF-α 水平及TC、TG、NEFA、T-AOC、CAT、GSH-Px、SOD 活性和MDA浓度均按照对应的试剂盒说明书进行测定。
1.3.5 数据处理 每个指标平行测定三次。数据采用Origin 2021 和IMB SPSS statistics 27.0 软件进行统计分析,结果以均数±标准差表示。采用单因素方差分析(ANOVA)和LSD事后检验分析组间差异,显著性水平α=0.05。
2 结果与分析
2.1 小鼠体质量、脏器指数、附睾脂肪指数、食物和能量摄入量变化
各组小鼠体质量变化趋势如图1(A)所示。实验初始,各组小鼠平均体质量为(19.38±0.86)g,各组间无明显差异(P>0.05)。在第4 周,体质量开始出现显著变化。第10 周结束,BPS 组小鼠最终平均体质量(27.55±0.14)g 比CON 组(25.77±0.22)g 高6.91%(P<0.05)。而经DHA-PC 处理后,DHA-PC组小鼠最终平均体质量(27.07 ± 0.16)g,比BPS 组降低了1.74%(P<0.05)。
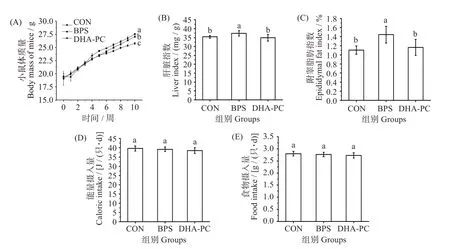
图1 不同处理对小鼠体质量、脏器指数、附睾脂肪指数、食物和能量摄入量的影响Fig.1 Effects of different treatments on mice body mass,organs index,epididymal fat index,food intake,and calorie intake
脏器指数可初步反映药物对器官所造成的影响,其值的升高能够间接体现组织的异常改变[14]。经BPS 处理后(图1(C)),BPS 组小鼠肝脏指数明显高于CON 组(P<0.05),而给药组小鼠肝脏指数与BPS 组相比,显著降低了6.76%(P<0.05)。此外,与CON 组相比,BPS 组小鼠附睾脂肪指数增加了30.91%(P<0.05),而给药组小鼠较BPS 组减少了19.44%(P<0.05)(图1(D))。这表明BPS 会导致小鼠肝脏的损伤,DHA-PC则能逆转这一趋势。
图1(E、F)可知,各组小鼠的食物和能量摄入量无显著差异(P>0.05)。
2.2 DHA-PC对BPS诱导小鼠肝功能指标的影响
AST 和ALT 是肝组织损伤的一个重要指标,通常肝细胞受损后AST 和ALT 含量会急剧升高[15]。如图2 所示,BPS 导致小鼠肝脏AST 和ALT 活性显著升高(P<0.05),这表明BPS的摄入会引起小鼠的肝功能异常。经DHA-PC 处理后,与模型组相比,给药组小鼠AST 活性[(137.19 ± 9.06)vs(191.76 ±6.79)U/g]和ALT 活性[(135.62 ± 2.78)vs(146.53 ±1.71)U/g]则显著降低(P<0.05),这表明DHA-PC可改善BPS诱导的小鼠肝功能损伤。

图2 不同处理对小鼠肝脏谷丙转氨酶和谷草转氨酶水平的影响Fig.2 Effects of different treatments on ALT and AST levels of murine liver
2.3 DHA-PC对BPS诱导小鼠肝脏组织病理学的影响
H&E 染色结果(图3)显示,DHA-PC 对于BPS引起的肝脏损伤有一定的修复作用。对照组小鼠的肝小叶结构清晰,肝索呈放射状,未发现实验饲喂乙醇剂量对小鼠的肝脏造成明显损伤。与CON组相比,BPS 组小鼠的肝小叶结构被破坏,肝索消失,无明显中央静脉,可见偌大空泡,显示肝脏发生局灶性脂肪病变。经DHA-PC 处理后,小鼠的肝小叶结构清晰,肝索结构为放射状,显示DHA-PC 对BPS导致的肝脏损伤具有一定的改善作用。
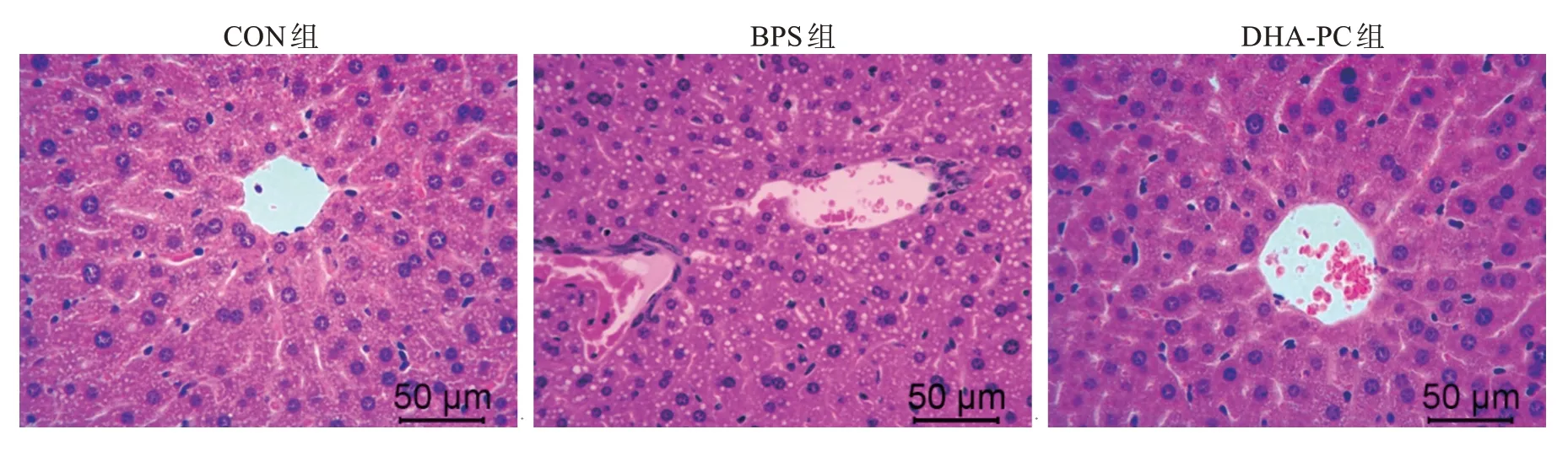
图3 不同处理对小鼠肝脏组织结构的影响Fig.3 Effects of different treatments on murine liver histopathology
2.4 DHA-PC对BPS诱导小鼠炎症因子水平的影响
如图4 所示,与对照组相比,BPS 暴露导致小鼠肝脏组织中炎症因子IL-1β、IL-6 和TNF-α 质量浓度的显著升高(P<0.05),提示BPS 可引起小鼠的肝脏炎症。在经DHA-PC 处理后,与BPS 组相比,IL-1β、IL-6 和TNF-α 含量均显著降低(P<0.05),与CON 组相比,IL-1β 和TNF-α 含量降低,但无显著差异(P>0.05)。该结果表明,DHA-PC 可通过抑制炎症反应来改善BPS诱导的小鼠肝损伤。
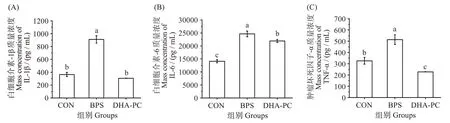
图4 不同处理对小鼠肝脏组织中炎症因子(白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α)含量的影响Fig.4 Effects of different treatments on inflammatory factors(IL-1β,IL-6,TNF-α)of liver in mice
2.5 DHA-PC对BPS诱导小鼠脂质水平的影响
TG、TC 和NEFA 是脂质水平紊乱的常见生物标志物[14]。如图5 所示,与对照组相比,BPS 导致小鼠肝脏TG、TC、NEFA 和LDL-C 质量摩尔浓度显著升高(P<0.05),HDL-C 水平显著降低(P<0.05)。在DHA-PC 干预后,与BPS 组相比,给药组小鼠肝脏TG、TC、NEFA 和LDL-C 水平均有效降低(P<0.05),而HDL-C 水平显著升高(P<0.05);与CON组相比,TG 质量摩尔浓度显著降低(P<0.05),NEFA、LDL-C 质量摩尔浓度未表现出显著差异(P>0.05)。该结果表明,DHA-PC 可有效改善BPS导致的小鼠肝脏脂质紊乱。
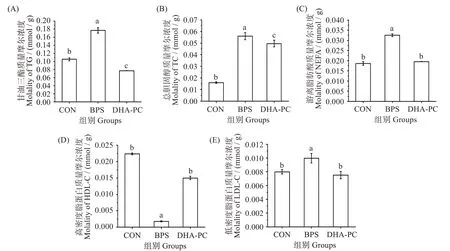
图5 不同处理对小鼠肝脏脂质水平的影响Fig.5 Effects of different treatments on lipid levels in mouse liver
2.6 DHA-PC对BPS诱导小鼠氧化应激水平的影响
如图6 所示,与对照组相比,BPS 组MDA 质量摩尔浓度显著升高(P<0.05),CAT、GSH-Px、SOD和T-AOC 活性显著降低(P<0.05)。与BPS 组MDA 质量摩尔浓度(2.48 ± 0.02)nmol/mg 相比,DHA-PC 组[(3.28 ± 0.02)nmol/mg]显著降低(P<0.05),CAT活性[(9.83±0.13)vs(15.02±1.32)U/mg]、GSH-Px 活性[(265.19 ± 32.48)vs(752.23 ± 30.19)U/mg]、T-AOC 活性[(0.03±0.001)vs(0.06±0.0004)U/mg]和SOD 活 性[(247.22 ± 8.88)vs(277.67 ±1.93)U/mg]活性显著升高(P<0.05),且接近正常水平。
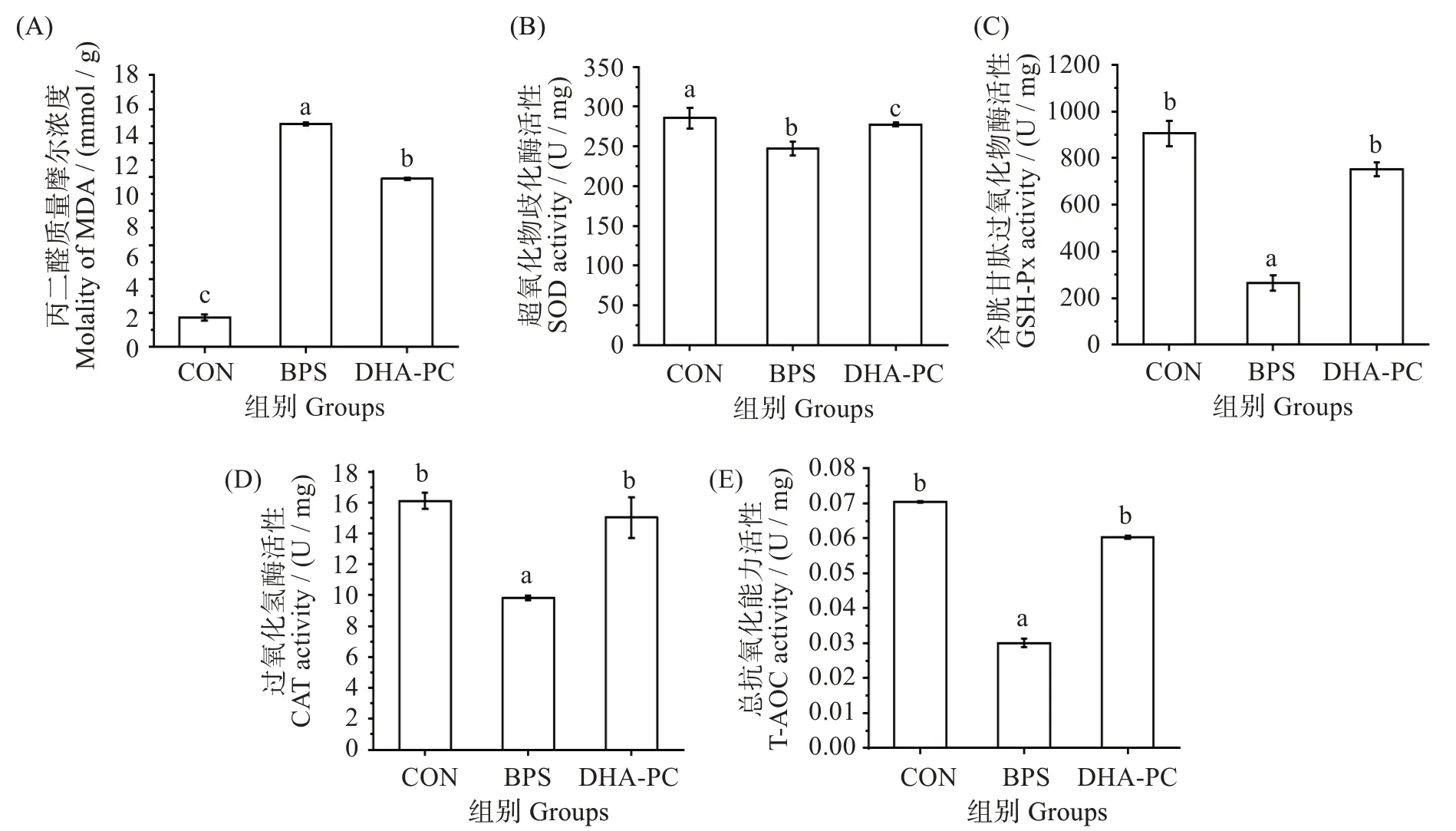
图6 不同处理对小鼠肝脏氧化应激的影响Fig.6 Effects of different treatments on oxidative stress in mice
3 讨论
DHA-PC 具有缓解氧化应激损伤、降脂和护肝等生物学功效[9,11]。本研究建立了BPS 诱导的小鼠肝损伤模型并评价DHA-PC 对其的改善作用。有研究表明,慢性暴露于BPS 会增强高脂饮食诱导的肥胖,且能诱导小鼠3T3-L1 前脂肪细胞生成,诱导更高的脂肪积累、上调脂肪生成标志物的基因表达[16]。BPS 暴露导致线粒体含量降低,改变代谢稳态和线粒体的能量代谢,引起显著的体质量增加[17],这与本研究结果一致。在本研究中,DHA-PC 可降低BPS 引起的肝脏指数升高、附睾脂肪指数升高,且能维持小鼠体质量稳定。经5 mg·(kg·d)-1BPS处理10周后,BPS组小鼠的AST和ALT活性显著高于CON 组,提示BPS导致小鼠肝功能损伤。肝脏组织病理学结果也进一步证实5 mg·(kg·d)-1BPS处理后会导致小鼠肝脏形态缺陷,并伴有肝细胞局灶脂肪病变。而经DHA-PC 处理后,AST 和ALT 活性较模型组显著下降,表明DHA-PC 可有效改善BPS 诱导的小鼠肝损伤。
肝脏是脂质代谢的重要器官,故脂质水平相关指标(如TC、TG、NEFA 等)异常升高常见于各种肝脏疾病[18,19]。经BPS 处理后,BPS 组小鼠肝脏组织中的TC、TG、NEFA 和LDL-C 水平较CON 组显著增加。LDL-C 作为TC 的主要载体,故LDL-C 水平的升高也会直接导致TC水平的升高[20],这说明BPS暴露造成小鼠肝脏中TC、TG、NEFA 和LDL-C 水平的积累,导致小鼠肝脏脂质代谢的紊乱,肝脏损伤[21],这与Zeng 等[22]的结论一致。Higuchi[23]等发现,鲱鱼鱼籽中的脂质(包括DHA和EPA)可以显著降低血清中TC、TG、LDL-C 水平,升高HDL-C 水平。有研究表明,BPS 会通过刺激雄性斑马鱼(Danio rerio)肝脏的β-氧化来增加三酰甘油(TAG)的水平,TAG水平的升高会增加脂质积累[24]。n-3多不饱和脂肪酸(PUFA)通过降低肝脏脂肪生成酶的表达来减少啮齿类动物肝脏中的TAG 合成[25]。在本研究中,小鼠经DHA-PC 处理后,其肝脏组织中的TC、TG、NEFA、HDL-C 和LDL-C 水平明显降低,这表明DHA-PC 能显著改善BPS 导致的小鼠肝脏脂质代谢紊乱。
多项研究表明,肝损伤与氧化应激和抗氧化防御系统的平衡有关[26]。BPS 会影响氧化-抗氧化平衡,诱导ROS 的产生,从而导致脏器毒性[27]。此外,脂质过氧化可激活过氧化氢生成,产生MDA等有毒化学物质,是氧化损伤的敏感指标。过量的MDA可引起细胞膜迁移性和通透性的改变,最终导致细胞结构和功能的破坏[28]。而SOD、CAT、GSH-Px 在ROS 代谢途径的不同位点协同抑制自由基的产生,防止氧化损伤[29]。在本研究中,经5 mg·(kg·d)-1BPS连续处理10 周后,小鼠肝脏组织中的MDA 含量显著升高,T-AOC、SOD、CAT 和GSH-Px 活性降低,表明小鼠的抗氧化防御系统受损,氧化-抗氧化平衡被打破,脂质过氧化增加。而DHA-PC 处理可显著增加SOD、CAT、GSH-Px及T-AOC 活性,降低MDA 含量,表明DHA-PC 可通过缓解氧化应激水平来改善BPS导致的小鼠肝脏毒性。
氧化应激导致生物分子的氧化损伤,引起机体内源性损伤相关分子模式产生和细胞因子释放[30]。而细胞因子能激活模式识别受体下游的信号通路,如NF-κB、JAK 和MAPK 等,导致细胞因子和趋化因子释放增加,招募和激活更多的炎性细胞,引起机体系统性的慢性炎症反应[31]。在本研究中,经5 mg·(kg·d)-1BPS 连续处理10 周后,小鼠肝脏组织中的IL-1β、IL-6、TNF-α 含量显著的升高。在经DHA-PC 处理后,IL-1β、IL-6、TNF-α 含量均显著降低,表明DHA-PC 可通过抑制炎症反应来改善BPS诱导的小鼠肝损伤。但本研究未对其分子作用机制进行深入研究,后续可通过转录组学、代谢组学和肠道菌群等对DHA-PC 改善BPS 导致小鼠肝损伤的作用机制进行深入研究。
4 结论
本研究结果表明,鲱鱼鱼籽源DHA-PC 干预可显著小鼠肝组织病理情况,显著降低小鼠平均体质量、肝脏指数和附睾脂肪指数,对食物摄入量和能量摄入量无影响,显著降低肝功能指标(ALT、AST)、炎症因子(IL-1β、IL-6、TNF-α)、脂质(TC、TG、NEFA、LDL-C)相关因子水平和MDA 含量,显著提高HDL-C、T-AOC、SOD、GSH-Px 和CAT 含量(α=0.05),说明DHA-PC 可抑制炎症、改善脂质代谢紊乱和氧化应激来改善BPS 导致的小鼠肝损伤。本研究结果将提供一种潜在的改善BPS 导致的肝损伤策略,同时也为缓解其他环境污染物导致的相关毒性提供借鉴意义。
