包膜丁酸钠对大规格刺参生长性能、消化、抗氧化和相关基因表达的影响
2023-12-21王成强李宝山孙永智王晓艳郝甜甜相智巍刘财礼王佩锋王际英
王成强 ,李宝山 ,孙永智 ,王晓艳 ,郝甜甜 ,相智巍 ,刘财礼,王佩锋,王际英
(1.山东省海洋资源与环境研究院/山东省海水渔用饲料工程技术研究中心/水生动物营养与饲料研发创新示范平台/山东省海洋生态修复重点实验室/烟台市海珍品质量安全控制与精深加工重点实验室,山东 烟台 264006;2.上海海洋大学水产与生命学院,上海 201306)
近年来,随着刺参(Apostichopus japonicus)养殖朝集约化方向不断发展,病害问题也频繁发生,严重制约了产业发展,同时在饲料禁抗大环境下,寻求能够提高刺参免疫能力和抗病力的适宜添加剂显得尤为重要。其中,丁酸钠(Sodium butyrate)是丁酸的钠盐,有效成分为丁酸,是肠道微生物发酵形成的短链脂肪酸,能够为肠上皮细胞提供能量,抑制肠炎发生,同时在提高生长性能和营养利用方面均具有积极作用,己成为目前备受关注的抗生素替代品之一[1-2]。
丁酸钠作为绿色替抗产品对水生动物的生理功能具有重要调节作用,在小规格刺参(3.20 g)[3]、斜带石斑鱼(Epinephelus coioides)[4]、草鱼(Ctenopharyngodon idella)[5]、凡纳滨对虾(Litopenaeus vannamei)[6]、大菱鲆(Scophthalmus maximusL.)[7]、鲫(Carassius auratus)[8]、尼罗罗非鱼(Oreochromis niloticus)[9]等研究中均表明,其在促生长、改善肠道健康和提高消化吸收能力方面具有不错表现。另外,丁酸钠还可以缓解机体氧化应激,提高鱼体抗应激能力,抑制炎症因子生成,减轻肠道炎症反应[10-12]。Liu等[3]对大菱鲆的研究表明,饲料丁酸钠通过抑制其肠道内核因子-κB (NF-κB)信号通路和降低肿瘤坏死因子-α(TNF-α)基因表达来减轻饲料中添加豆粕带来的肠道疾病。然而,在较大规格刺参中关于丁酸钠是否能够对其生长、饲料利用、消化和免疫能力产生积极影响尚未见相关报道。因此,本实验选取大规格刺参为研究对象,通过在饲料中添加不同水平的包膜丁酸钠,旨在探究丁酸钠对大规格刺参生长性能、消化能力和免疫能力的影响,以期为丁酸钠在刺参养成阶段生产中的合理利用提供一定的科学依据。
1 材料与方法
1.1 实验饲料
以鱼粉和谷朊粉为主要蛋白源,大豆卵磷脂为主要脂肪源,配制粗蛋白质质量分数约为16%、粗脂肪质量分数约为2%的基础饲料。通过在基础饲料中分别添加0、0.05%、0.10%、0.20%、0.40%、0.60% 的包膜丁酸钠(购自青岛根源生物技术有限公司,丁酸钠有效质量分数≥75%),制成6 组等氮等脂的实验饲料,其中未添加组为实验对照组。首先将所有原料粉碎过筛,之后将各种原料按逐级扩大法均匀混合,然后加入适量的水,制成面团,再用自动制粒机制粒,制好的饲料放置于45~50 ℃左右烘箱中烘干,保存于阴凉干燥处,备用。实验饲料组成及营养水平见表1。
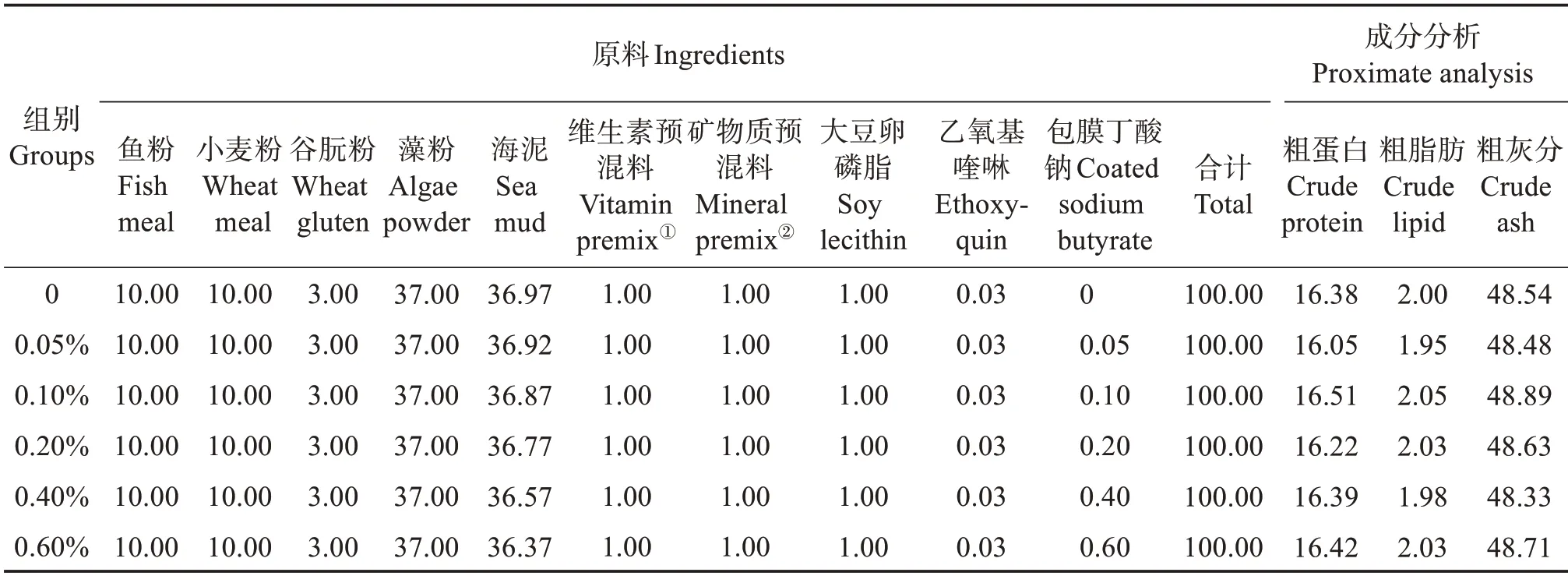
表1 不同包膜丁酸钠水平实验饲料的配方和营养组成质量分数Table 1 Formulation and nutrient compositions mass fraction of different coated sodium butyrate levels the experimental diets %
1.2 养殖管理
实验用刺参购自山东安源种业科技有限公司,实验地点是山东省海洋资源与环境研究院东营实验基地,养殖周期为8 周,养殖方式为循环水养殖。正式实验开始前,用基础饲料暂养2周,使其适应实验饲料与养殖环境。暂养结束后,停饲24 h,挑选参刺坚挺粗壮、大小均一的刺参[初始体质量为(55.96± 0.20) g]随机分到18 个养殖桶(直径75 cm,深度80 cm)中,每个养殖桶放置25 头刺参,每个实验组3 个重复,每个桶内放置1 个布满波纹板的海参专用筐,控制水深为60 cm。每天在规定时间(16:00)投喂,投喂量为刺参初始体质量的3%,具体投喂量要根据刺参摄食情况进行调整。实验期间,每3 d换水1 次,换水量为1/2,换水时用虹吸管将残饵和粪便吸出。同时,水温控制在15~18 ℃,盐度为25~27,溶解质量浓度>6.5 mg/L,氨氮和亚硝酸氮质量浓度均<0.05 mg/L。
1.3 样品采集与分析
养殖实验结束时,禁饲48 h,对每个养殖桶内刺参进行计数和称质量。之后,从每个养殖桶中随机取出10头刺参,置于白色托盘中,测量体质量,之后进行解剖,分别取体腔液、肠道及体壁,测量肠道质量,用于计算肠体比。将肠道样品及时保存于-80 ℃超低温冰箱中,体壁保存于-20 ℃冰柜中,同时对体腔液进行离心(3 000 r/min,4 ℃,10 min),取上清液分装在离心管中,之后也将其保存于-80 ℃超低温冰箱中。
另外,从每个养殖桶中随机取出3头刺参,在无菌条件下,进行解剖,取其肠道组织,放置于2 mL无RNase 的离心管中并迅速置于液氮中速冻,之后将样品放置于-80 ℃超低温冰箱中保存,用于肠道中相关基因的荧光定量分析。
1.4 样品常规及生化分析
实验饲料和刺参体壁的水分测定采用105 ℃烘干恒重法测定(GB/T6435—2014),粗蛋白质采用凯氏定氮法测定(GB/T6432—2018),粗脂肪采用索氏抽提法测定(GB/T6433—2006),粗灰分采用马弗炉550 ℃失重法测定(GB/T 6438—2007)。
肠道中淀粉酶(Amylase)、脂肪酶(Lipase)、蛋白酶(Protease)、总抗氧化能力酶(Total antioxidant capacity enzyme,T-AOC)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量均利用南京建成生物工程研究所生产的相应试剂盒测得,各种酶活性单位参照试剂盒说明书表示。
1.5 实时定量PCR(RT-PCR)
采用实时定量PCR 检测刺参肠道中Rel、P105和lysozyme基因相对表达量的变化。
1.5.1 总RAN 的提取 采用Trizol(Takara,日本)法提取刺参肠道中总RNA,具体操作流程参考王成强等[13]实验方法
1.5.2 RNA 反转录 首先使用超微量紫外分光光度计(Nanodrop 2000,美国)检测RNA 浓度和纯度,反转录时要求反应体系中总RNA 量不超过1 μg。再使用PrimeScript®RT reagent Kit With gDNA Eraser(Perfect Real Time) (Takara,日本)进行反转录合成cDNA,具体步骤参照试剂盒说明书,合成的cDNA保存于-80 ℃冰箱中备用。
1.5.3 引物设计 选用刺参β-actin基因作为管家基因,并根据NCBI 数据库中基因序列,利用Primer Premier 5设计引物,以上引物均由生工生物工程(上海)股份有限公司合成。本实验所用基因及引物序列详情见表2。
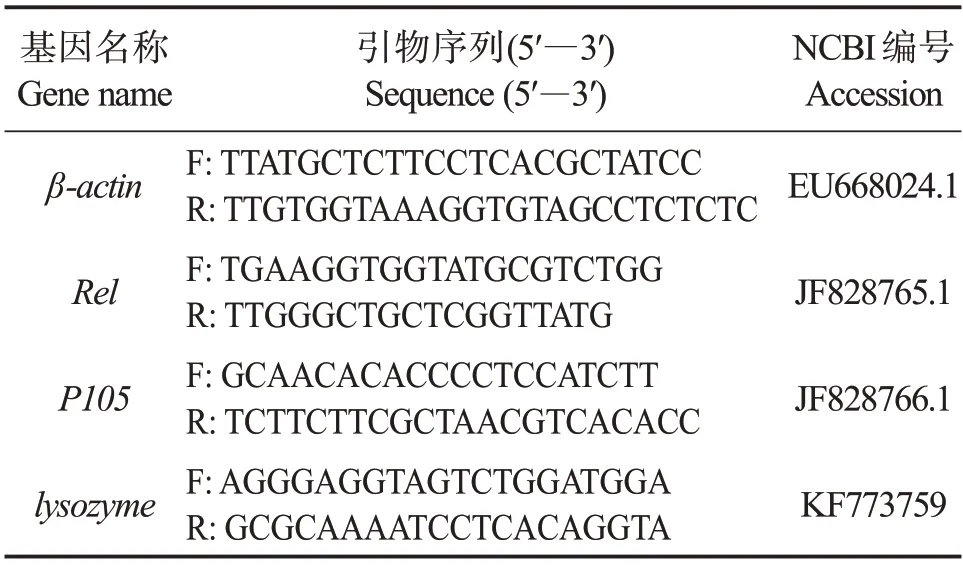
表2 实时定量PCR引物序列Table 2 The primer sequences used for real-time quantitative PCR
1.5.4 实时定量PCR 步骤 定量仪器为实时定量PCR 仪(Roche LightCycler®480Ⅱ,瑞士)。定量反应体系为20 μL,其中包括10 μL SYBR®Premix Ex TaqII (Tli RNaseH Plus) (2×) (Takara,日本)、0.8 μL上游引物(10 μmol/L)、0.8 μL 下游引物(10 umol/L)、2 μL cDNA 模板和6.4 μL 的无菌水。反应程序为95 ℃持续30 s,循环数为1;95 ℃持续5 s,56~60 ℃持续20 s,共进行40 个循环;溶解曲线按照已经默认程序进行。首先进行目的基因和内参基因(β-actin)扩增效率(E)一致性的验证,扩增效率的计算公式为E=10×(-1/S)-1,其中S是以Cq值为纵坐标,lg (相对模板拷贝数)为横坐标得到的斜率。在验证目的基因与内参基因扩增效率一致后,采用2-ΔΔCq方法测定目的基因的相对表达量,其中ΔΔCq=实验组(Cq 目的基因-Cq 管家基因) -对照组(Cq目的基因-Cq管家基因)。
1.6 计算公式及统计分析
存活率=终末数量/初始数量;
在警察高校的教学体系中,理论教学是实验教学的前提和基础,实验教学则是培养和提高学生综合实践应用能力的主渠道。多数情况下,理论教学与实验教学同等重要。而对一些实践性、应用性极强的警察专业课程而言,实验教学则应明显重于理论教学。一直以来,警察高校对理论教学与实验教学的辩证关系问题,并没有深入思考和探究,更没有真正得以解决,在一定程度上成为了阻碍应用型人才培养目标实现的主要原因之一。
增重率=(终末体质量-初始体质量)/初始体质量;
特定生长率=ln (终末体质量) -ln(初始体质量)]/实验时间(d);
饲料效率=(终末体质量-初始体质量)/摄食饲料干质量;
肠体比=肠道质量/刺参体质量。
所得实验数据用平均值± 标准误差(Mean ±SE)来表示,用SPSS19.0 分析软件进行单因素方差分析(One-Way ANOVA),另外用Duncan's 法进行多重比较,当P<0.05时差异显著。
2 结果
2.1 饲料中添加包膜丁酸钠对刺参生长性能的影响
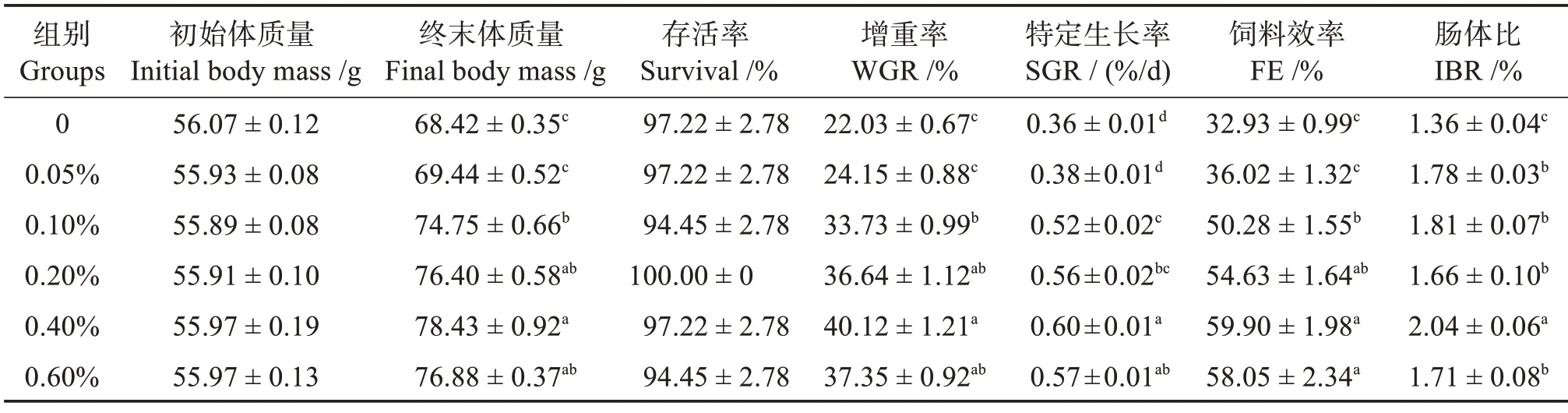
表3 饲料中添加包膜丁酸钠对刺参生长性能的影响Table 3 Effects of different coated sodium butyrate levels on growth performance of Apostichopus japonicus
2.2 饲料中添加包膜丁酸钠对刺参体壁化学组成的影响
由表4 可知,当饲料中添加不同水平的包膜丁酸钠时,各组刺参体壁的水分、粗蛋白质、粗脂肪以及粗灰分含量均无显著影响(P>0.05),其中干质量条件下,刺参体壁中粗蛋白质含量为45.32%~45.77%,粗脂肪含量为3.56%~3.71%,粗脂肪灰分含量为31.06%~32.46%。
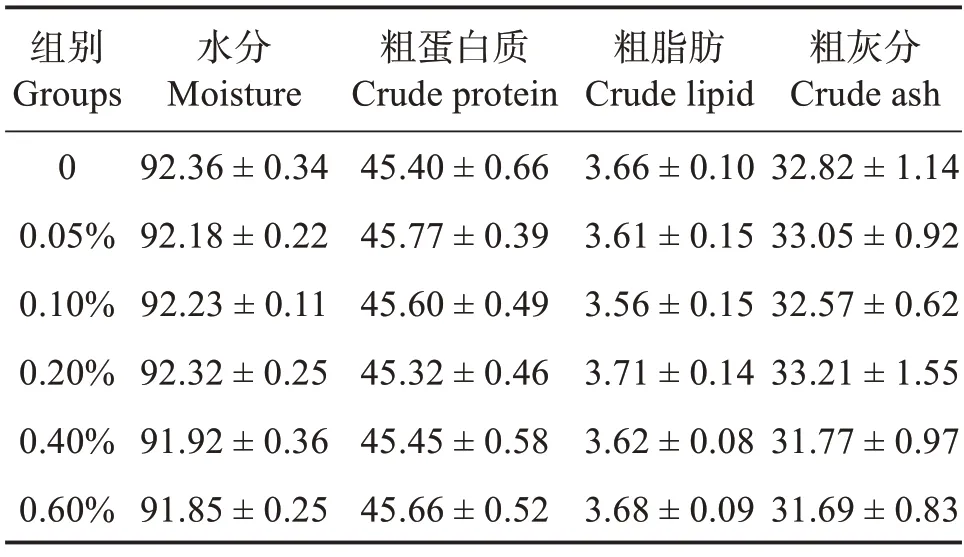
表4 饲料中添加包膜丁酸钠对刺参体壁化学组成的影响(干质量)Table 4 Effects of different coated sodium butyrate levels on body wall chemical composition of Apostichopus japonicus(dry mass)
2.3 饲料中添加包膜丁酸钠对刺参肠道消化酶活性的影响
由表5 可知,饲料中添加包膜丁酸钠对刺参肠道中蛋白酶和脂肪酶有显著影响,其中添加量为0.20%~0.60%时,刺参肠道的蛋白酶活性和脂肪酶活性显著高于对照组(P<0.05),且均在0.40%添加组达到最大值。当添加量为0.20%时,蛋白酶活性显著高于对照组(P<0.05),与其他实验组均无显著性差异(P>0.05),而脂肪酶活性却显著低于0.40%和0.60%添加组(P<0.05),同0.05%和0.10%添加组无显著差异(P>0.05)。另外,结果显示,刺参肠道中淀粉酶活性在不同实验组间无显著差异(P>0.05)。

表5 饲料中添加包膜丁酸钠对刺参肠道消化酶活性的影响Table 5 Effects of different coated sodium butyrate levels on digestive enzymes in intestinal tract of Apostichopus japonicus
2.4 饲料中添加包膜丁酸钠对刺参肠道抗氧化能力的影响
表6 显示,与对照组相比,饲料中添加0.10%~0.60%的包膜丁酸钠均显著提高刺参肠道中SOD、CAT 活性和T-AOC 水平,其中在添加量为0.40%和0.60%时,刺参肠道中SOD、CAT活性和T-AOC水平分别达到较高水平(P<0.05)。另外,添加量为0.05%时,刺参肠道中SOD、CAT 活性和T-AOC 水平同对照组均无显著差异(P>0.05)。刺参肠道中MDA 含量呈现同SOD 活性相反的变化趋势,在对照组和0.05%添加组处于较高水平,显著高于0.20%、0.40%和0.60%添加组(P<0.05),同0.10%添加组无显著差异(P>0.05)。而在0.20%、0.40%和0.60%组刺参肠道中MDA含量无显著差异(P>0.05)。
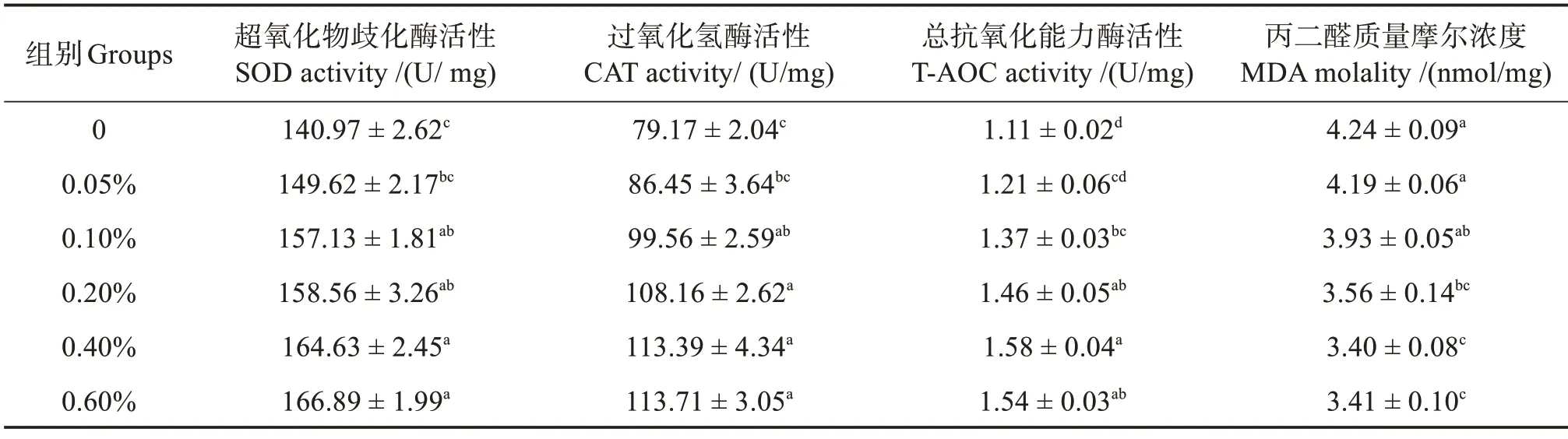
表6 饲料中添加包膜丁酸钠对刺参肠道抗氧化能力的影响Table 6 Effects of different coated sodium butyrate levels on antioxidant capacity in intestinal tract of Apostichopus japonicus
2.4 饲料中添加包膜丁酸钠对刺参肠道Rel、P105和lysozyme相对表达量的影响
由图1 可知,刺参肠道中Rel和lysozyme相对表达量均随包膜丁酸钠添加水平升高先显著升高,随后又下降,且最大值均出现在0.40%添加组,显著高于对照组、0.05%和0.10%添加组(P<0.05)。同时发现,0.40%添加组刺参肠道中lysozyme相对表达量显著高于0.60%添加组(P<0.05),同0.20%添加组无显著性差异(P>0.05)。另外,丁酸钠添加量在0.10%以上时,刺参肠道中P105相对表达量显著低于对照组和0.05%组(P<0.05),其中0.40%添加组表达量最低,与0.20%添加组无显著差异(P>0.05),而显著低于0.60%添加组(P<0.05)。

图1 饲料中添加包膜丁酸钠对刺参肠道免疫相关基因相对表达量的影响Fig.1 Effects of dietary coated sodium butyrate level on relative mRNA expression of immunity-related genes in intestinal tract of Apostichopus japonicus
3 讨论
3.1 饲料中添加包膜丁酸钠对刺参生长性能的影响
近年来一系列研究指出,饲料中添加适量丁酸钠对水生动物具有明显促生长作用。魏朝青等[7]研究指出,饲料中添加质量分数0.15%的丁酸钠能显著提高大菱鲆幼鱼的增重率和特定生长率,同时也提高了饲料效率。在斜带石斑鱼研究中发现,若以增重率为评价指标,丁酸钠的适宜添加水平为0.20%[4]。Liu 等[14]研究发现,添加1 000 或2 000 mg/kg 丁 酸钠的饲料均能显著提高草鱼的特定生长率。Silva等[15]在凡纳滨对虾研究中发现,饲喂适宜水平丁酸盐显著提高凡纳滨对虾产量,且丁酸钠0.20%添加组凡纳滨对虾的增重率最高。张松琳等[16]研究发现,在饲料中添加质量分数0.10%丁酸钠,美洲鳗鲡(Anguilla rostrata)的增重率提高37%,饲料系数降低26%。高永刚等[3]研究指出,饲料中添加质量分数0.20%和0.3%的包膜丁酸钠可提高小规格刺参(3.20 g)的生长性能。本实验结果也表明,当饲料中丁酸钠添加量为0.40%时,大规格刺参(55.96 g)获得最高的增重率和特定生长率,同时饲料效率也处于较高水平,这表明适宜丁酸钠可以对大规格刺参的生长性能产生积极影响,与上述相关研究结果相似。产生这一积极影响的原因应该与丁酸钠可影响肠道健康,调节肠道菌群,提高了刺参对营养物质的消化吸收有关[9,17]。
上述相关研究结果表明,不同水生动物对于丁酸钠需求量是不同的。而本研究中这一添加量高于上述其他研究,一方面可能是养殖种类、规格大小与养殖环境不同造成的;另一方面可能是因为刺参肠道中菌群丰度较鱼虾相对低,且对营养物质的利用不足导致的,具体原因有待进一步探究。另外,在本实验中,当丁酸钠添加量为0.60%时,刺参的增重率出现了一定的下降,这说明过量丁酸钠可能会对刺参生长产生抑制作用,分析原因可能是因为摄入过多丁酸钠会降低消化道内的pH,影响到相关消化酶活性,从而降低了肠道对营养物质利用[18],具体原因在下面研究中会得到进一步阐述。
3.2 饲料中添加包膜丁酸钠对刺参体壁化学组成的影响
本研究结果显示,饲料中不同丁酸钠添加水平对刺参体壁中粗蛋白质、粗脂肪和粗灰分含量均无显著影响。这与翟秋玲等[19]在菊黄东方鲀(Takifugu flavidus)、魏朝青等[7]在大菱鲆、Liu 等[14]在草鱼、黑鲷(Acanthopagrus schlegelii)[20]上的研究结果一致。但在尼罗罗非鱼和黄颡鱼(Tachysurus fulvidraco)的研究中发现,鱼体粗蛋白质含量会随饲料丁酸钠添加量增加显著提高,这可能与丁酸钠能够促进上皮细胞的增殖和分化,改善肠道吸收功能有关[21];也可能与丁酸钠可以提高小肽转运载体1 (PepT1)表达水平,促进小肽吸收,使得食物转化为结构蛋白的效率更高有关[22]。
3.3 饲料中添加包膜丁酸钠对刺参肠道消化酶活性的影响
消化酶活性直接影响养殖对象对饲料营养成分消化、吸收和利用率,也是评价肠道健康的重要指标之一。在水生动物的研究中已表明,丁酸钠可以提高肠道蛋白酶、脂肪酶和淀粉酶活性,如在巨骨舌鱼(Arapaima gigas)饲料中添加丁酸钠,饲喂45 d,肠道的蛋白酶、脂肪酶和淀粉酶的活性显著增加[23];在卵形鲳鲹(Trachinotus ovatus)的研究中表明,饲料中添加2.0、4.0 g/kg的丁酸钠可提高肠道蛋白酶、淀粉酶、碱性磷酸酶和Na/K-ATP酶的活性[24];在草鱼研究中表明,饲料中添加0.10%丁酸钠可显著提高肠道胰蛋白酶和蛋白酶活性,对淀粉酶无显著影响[17];在凡纳滨对虾(Litopenaeus vannamei)的研究中表明,添加丁酸钠可提高虾肠道脂肪酶、肝胰腺蛋白酶、胰蛋白酶和糜蛋白酶的活性,从而提高蛋白质、多糖和脂质的消化率[25]。同时,本实验结果也显示,饲料中添加质量分数0.40%包膜丁酸钠显著提高肠道蛋白酶和脂肪酶活性。这也进一步说明丁酸钠对陆生和水生动物的消化酶活性均有一定提高作用,这可能与丁酸钠可以改善肠道组织形态,调整肠道菌群结构等原因有关。
3.4 饲料中添加包膜丁酸钠对刺参肠道抗氧化能力的影响
SOD、CAT 和T-AOC 可以清除机体内部活性氧(ROS),以避免脂肪酸氧化的发生,减轻ROS的毒性作用,从而能够保护生物免受氧化损伤,在机体抗氧化中起关键作用[26]。因此,SOD、CAT 活性和T-AOC 可以反映机体抵抗氧化应激的能力,并间接体现水生动物免疫力水平。本研究结果显示,当饲料中添加超过质量分数0.10%的包膜丁酸钠时,刺参的肠道SOD 和CAT 活性及T-AOC 均显著高于对照组,且在添加量为0.40%时达到较高水平,较对照组分别提高了17%、43%和42%。
包膜丁酸钠的添加量为0.40%时,肠道MDA含量显著降低,较对照组降低了20%。而MDA 是自由基引发脂质过氧化反应后得到的最终分解产物,其含量可能间接反映水生动物的损伤程度和抗氧化能力,其含量越高说明机体受到的损害越严重[27]。因此,上述抗氧化能力相关指标的研究结果说明丁酸钠可以通过调节刺参机体的抗氧化能力,增强机体清除自由基的能力,减少组织和细胞损伤。这一结果同之前研究结果相似。Zhang 等[28]研究发现,饲料中添加1.0 g/kg 丁酸钠可明显提高美洲鳗鲡肝脏T-AOC、CAT 活性,降低MDA 含量;在虹鳟(Oncorhynchus mykiss)的研究中也表明,饲料中加入丁酸钠显著提高肠道抗氧化酶(如SOD、CAT 和GSH-Px)活性[29];魏朝青等[7]在大菱鲆的研究中证实,饲料中添加质量分数0.3%丁酸钠时,肝脏SOD和CAT活性及T-AOC均显著高于为添加组,且丁酸钠显著降低了肝脏MDA 含量。另外,在奶牛[30]、肉鸡[31]等陆生动物的研究中也得到了类似的结论。
3.5 饲料中添加包膜丁酸钠对刺参肠道Rel、P105和lysozyme相对表达量的影响
众多研究表明,丁酸盐除了能够为肠上皮细胞快速提供能量之外,还具有广泛的抗炎作用。目前研究最多的丁酸盐抗炎机制是丁酸钠对信号分子NF-κB 的抑制。NF-κB 广泛存在于动物细胞中,是进化上高度保守的信号模块,控制着包括抗菌肽、细胞因子、活性氧生成酶等在内的许多免疫基因的表达,在机体的炎症反应发生的过程中发挥着至关重要的作用[32]。汪婷婷[33]研究表明,在脂多糖刺激后,刺参体内NF-κB信号通路被激活,其中Rel呈先上升后下降,而P105呈显著降低后上升的趋势,而P50呈现同P105相反的变化趋势,这可能与P50和Rel一旦和转入核内,它们就会形成二聚体调控相关基因的表达有关。在草鱼中的研究也表明,饲料中补充丁酸钠显著改善与NF-κB 和p38丝裂原活化蛋白激酶信号通路相关的局部肠道免疫功能[17]。在欧洲海鲈(Dicentrarchus labrax)[34]、鲤(Cyprinus carpio)[35]等研究中均指出,饲料中添加丁酸钠可通过下调促炎因子,上调抗炎因子达到缓解/抑制炎症反应的目的。本研究发现,当包膜丁酸钠添加量在0.20%~0.40%时,刺参肠道Rel相对表达量处于较高水平,显著高于对照组,而此时P105相对表达量却处于较低水平,显著低于对照组。这说明在刺参中丁酸钠也能够通过调控NF-κB 信号通路来实现抗炎作用。此外,丁酸钠作为一种去乙酰化酶(HDAC)抑制剂,可能通过改变组蛋白的乙酰化程度来改变染色质结构,从而参与相关基因的调控,抑制炎症反应过程[36]。而丁酸调控NF-κB的作用可能也与其潜在的抑制组蛋白去乙酰酶的作用相关。
溶菌酶作为天然免疫中重要的免疫因子,在刺参防御病原微生物方面具有重要作用,溶菌酶受信号通路的调控从而发挥抗菌作用,增强机体抗病力。研究表明,溶菌酶的表达直接受NF-κB 信号通路的调控[37]。本研究结果显示,当包膜丁酸钠添加量在0.20%~0.40%时,肠道lysozyme相对表达量显著高于对照组,这说明在这一添加范围内,溶菌酶表达得到较大提升。同时,张晓晓等[6]研究也指出,饲料中添加适量丁酸钠可以提高凡纳滨对虾血清中溶菌酶活性,提高机体非特异性免疫能力。值得注意的是,本实验中lysozyme相对表达量的变化趋势同Rel相似,这也进一步验证了上述丁酸可以通过调控NF-κB 产生抗炎作用的研究结论。因此,表明在刺参中丁酸钠可以通过调控NF-κB 信号通路及相关转录因子,进而对溶菌酶产生积极影响,达到抗炎作用。
4 结论
综上可知,在本研究条件下,饲料中适量包膜丁酸钠(质量分数0.40%)对大规格刺参的生长性能、消化及抗氧化能力具有一定促进作用。丁酸钠可以通过调节NF-κB 信号通路相关因子影响刺参的肠道抗炎水平,进而对机体的免疫能力产生积极影响,具体影响机制有待进一步深入研究。
