非小细胞肺癌组织中THRSP、ACACA的表达及其与临床预后的关系
2023-12-21康华丽刘俊玲
康华丽 刘俊玲
肺癌为常见的呼吸系统恶性肿瘤,其中非小细胞肺癌(NSCLC)占75%~85%,包括肺鳞癌、肺腺癌、大细胞癌,NSCLC患者总体预后较差[1]。临床治疗多采用生物治疗、放化疗、分子靶向治疗等,但患者死亡率仍未显著降低[2]。目前NSCLC早期诊断水平有限,大部分患者确诊时已发生区域或远处转移,所以积极探究NSCLC进展、预后相关影响因子对肿瘤治疗至关重要[3]。既往研究发现THRSP蛋白的基因在乳腺癌中呈最高量表达,其在乳腺肿瘤中可控制肿瘤代谢、生长[4]。ACACA属于乙酰辅酶A羧化酶家族(ACC)成员,含生物素,可催化乙酰辅酶A生成丙二酰辅酶A,参与细胞内脂肪酸限速合成[5]。既往研究证实ACACA在肝细胞肝癌中呈上调表达,且与患者不良预后有关[6]。但是目前涉及到THRSP、ACACA与NSCLC的研究尚少。因此,本研究主要探讨THRSP、ACACA在NSCLC癌组织中的表达水平及其临床预后意义。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年12月我院收治的112例NSCLC患者作为研究对象,术中收集NSCLC患者的癌组织标本(NSCLC组)及对应的癌旁组织标本(癌旁组)。男性66例,女性46例;年龄41~75岁,平均年龄(52.43±5.57)岁。纳入标准:①经病理切片确诊为NSCLC;②行手术治疗患者;③临床及随访治疗完整。排除标准:①入组前接受放化疗者;②心肝肾等组织器官功能异常者;③合并其他部位恶性肿瘤者。经我院医学伦理委员会审核批准。
1.2 方法
1.2.1 THRSP、ACACA检测 采用免疫组化法检测THRSP、ACACA在NSCLC组织及癌旁组织中的表达,操作流程如下:①主要试剂与仪器:免疫组化链霉菌亲生物素蛋白-过氧化物酶连接(SP)试剂盒(上海酶联生物科技有限公司),兔抗人THRSP多克隆抗体(上海纪宁生物科技有限公司),鼠抗人ACACA多克隆抗体(美国Sigma公司),二氨基联苯胺(DAB)显色剂(北京博奥森公司)。②检测方法:常规固定(4%多聚甲醛)NSCLC组织及癌旁组织标本,60℃熔点石蜡包埋切至4 μm,脱蜡(二甲苯)、脱水(不同梯度的酒精),苏木精染色液染色确定病变区域,制片,柠檬酸钠溶液高压高温修复抗原,冷却后加入磷酸盐缓冲液(PBS)冲洗3次,5 min/次;山羊血清封闭液内滴加兔抗人THRSP多克隆抗体(稀释比1∶500)、鼠抗人ACACA多克隆抗体(稀释比1∶2000),4 ℃孵育,PBS清洗3次,3 min/次;加入兔抗鼠二抗(稀释比1∶500),37 ℃环境内孵育半小时,PBS冲洗3次。DAB显色剂显色3 min,苏木精复染、酒精脱水、树脂胶封片,高倍显微镜下观察THRSP、ACACA蛋白表达水平情况。③判定标准:显微镜示细胞质内出现棕黄色或棕褐色颗粒为阳性细胞。阳性细胞百分比:<5%为0分、5%~25%为1分、25%~50%为2分、50%~75%为3分、>75%为4分。阳性细胞染色强度:无着色为0分、浅黄或黄色为1分、棕黄色为2分、棕褐色为3分。染色指数(SI)=染色强度×阳性细胞百分比,阳性:SI>3分,阴性:SI≤3分。
1.2.2 随访 连续3年对出院NSCLC患者行电话、门诊复查随访,记录患者生存状况,截止至2022年12月,若患者死亡则随访终止。
1.3 统计学分析
统计软件为SPSS 24.0,采用例数和百分比(%)描述计数资料;采用χ2检验分析THRSP、ACACA表达与NSCLC患者临床病理特征的关系;采用多因素Cox回归分析影响NSCLC患者预后的相关因素,双侧检验水准α为0.05。
2 结果
2.1 2组THRSP、ACACA表达情况比较
NSCLC组THRSP、ACACA阳性表达率高于癌旁组(P<0.05),见表1。

表1 2组THRSP、ACACA表达情况比较(例,%)
2.2 THRSP、ACACA表达与NSCLC临床病理特征的关系
不同性别、年龄、原发肿瘤大小、浸润深度的NSCLC患者THRSP、ACACA表达情况比较,差异无统计学意义(P>0.05);低分化、TNM分期为Ⅲ期、有淋巴结转移的NSCLC患者THRSP、ACACA阳性表达率高于中/高分化、TNM分期为Ⅱ期、无淋巴结转移者(P<0.05),见表2。
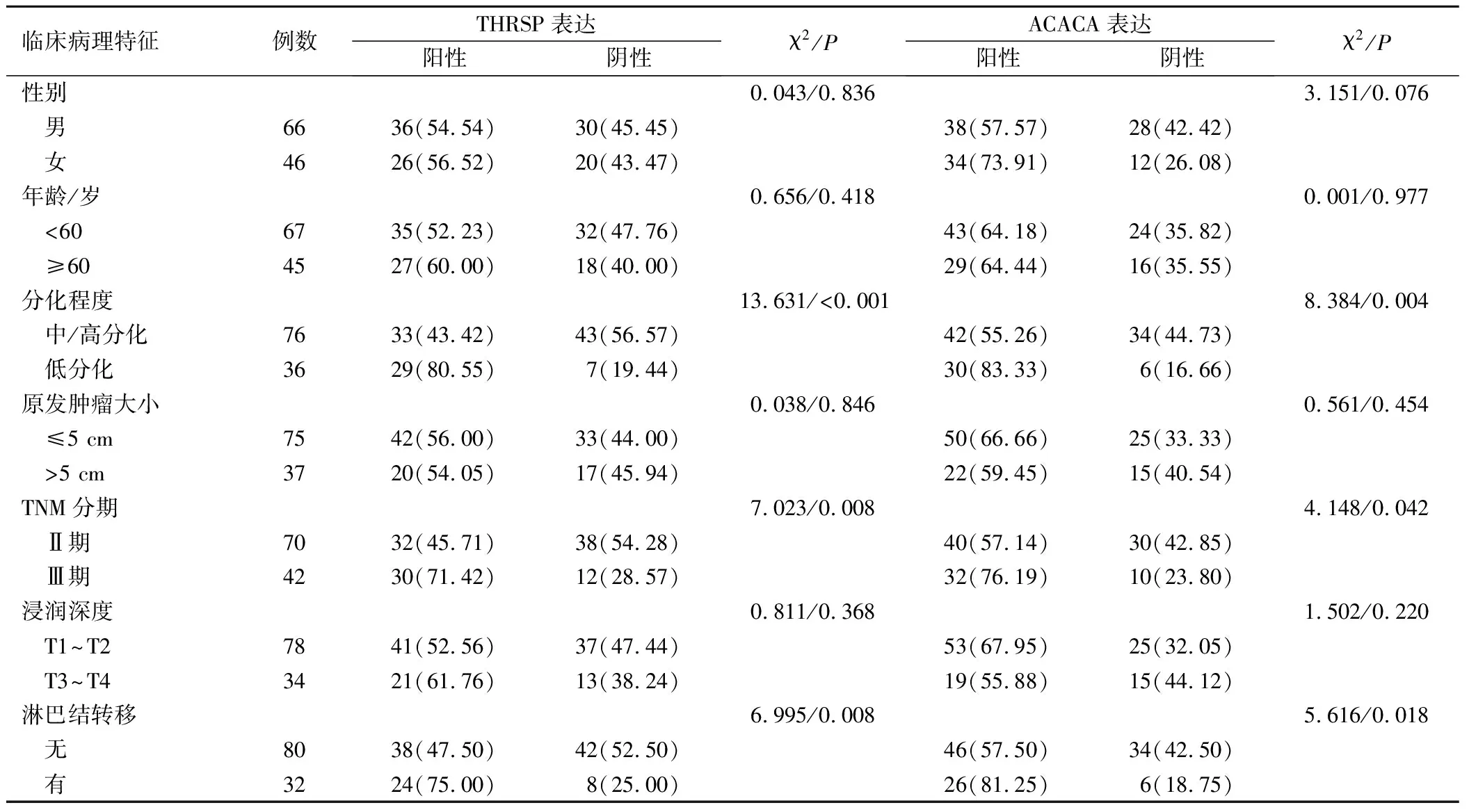
表2 THRSP、ACACA表达与NSCLC临床病理特征的关系(例,%)
2.3 NSCLC患者的预后生存情况及单因素分析
112例NSCLC患者随访3年后,62例患者存活,总体生存率为55.36%(62/112)。低分化、TNM分期为Ⅲ期、有淋巴结转移、THRSP阳性表达、ACACA阳性表达NSCLC患者的3年生存率低于中/高分化、临床分期为Ⅱ期、无淋巴结转移、THRSP阴性表达、ACACA阴性表达患者(P<0.05),见表3。

表3 NSCLC患者预后的单因素分析(例,%)
2.4 NSCLC患者预后的多因素Cox回归分析
将NSCLC患者的预后作为因变量,将单因素分析有意义的指标作为自变量进行多因素Cox回归分析,结果显示,低分化、TNM分期为Ⅲ期、THRSP阳性表达、ACACA阳性表达是NSCLC患者预后的危险因素(P<0.05),见表4。

表4 NSCLC患者预后的多因素Cox回归分析
3 讨论
肺癌是临床最常见的恶性肿瘤,其中NSCLC发病率较高,居所有类型恶性肿瘤首位[7],但其症状无典型特征,早期难以确诊,表现出呼吸困难、咳嗽、咳血等症状时已为中晚期,大多数已出现肿瘤细胞浸润及原发性病灶转移,无法进行手术治疗[8]。随诊断技术的发展,早期NSCLC检出率升高,但预后仍较差。因此,行预后的早期评估可为临床治疗提供指导方案。
ACACA位于细胞质内,为乳脂合成中的重要酶系之一,通过催化乙酰辅酶A生成丙二酰辅酶A,用于不同代谢反应过程,可促进细胞内脂肪酸从头合成[9-10]。较正常细胞用于贮存能量相比,合成的脂质作为促进癌细胞生存、生长原料,所以脂肪形成与促进癌细胞增殖、存活有关,癌细胞的脂肪酸合成被激活[11]。有研究发现,乳腺癌、前列腺癌中ACACA呈过度表达[12]。
还有研究表明,磷酸化ACACA蛋白表达和胃癌的肿瘤分级、发病阶段具有相关性[13]。代谢组学分析证实,ACACA缺乏的肝组织中抗氧化剂含量更高,ACACA参与肝细胞生长中的抗氧化调节。基因定量检测发现,肝细胞癌肿瘤组织中ACACA表达水平高于正常肝脏组织,说明可作为预测疾病预后的生物标志或肝细胞癌的治疗新靶点[14]。本研究结果显示,NSCLC组THRSP阳性表达率高于癌旁组(P<0.05);不同分化程度、TNM分期、淋巴结转移患者的THRSP表达情况比较有差异(P<0.05)。提示THRSP在NSCLC患者中呈高表达,且与病情进展有关。分析可能的原因,癌细胞增殖、存活有ACC活性强的作用,其可参与NSCLC发生、发展[15]。ACC分为ACCA、ACCB两种亚型,由不同基因编码,前者存在于脂肪合成活跃的肝脏、脂肪组织、乳腺,与脂肪酸合成相关,有研究发现,肝癌细胞HepG2中ACC表型为ACCA;后者存在于心肌、骨骼肌,与脂肪酸氧化相关;故抑制脂肪酸合成为新的肿瘤治疗手段[16-17]。
THRSP被发现于研究脂肪组织中甲状腺素的反应时,THRSP蛋白的编码基因处于11q13的染色体上,该基因存在于肝脏、脂肪、乳腺等脂肪生成组织内。THRSP蛋白可迅速对甲状腺素刺激和高葡萄糖水平产生应答反应。甲状腺激素可调节THRSP转录,继而调节脂肪酸合成酶基因转录[18]。有研究人员提取肝组织胞浆蛋白行双向凝胶电泳证明THRSP为胞浆蛋白,还有研究人员通过免疫组化法证实THRSP处于胞核[19]。本研究结果显示,NSCLC组ACACA阳性表达率高于癌旁组(P<0.05);不同分化程度、TNM分期、淋巴结转移患者的ACACA表达情况比较有差异(P<0.05)。提示ACACA在NSCLC患者中呈高表达,且与病情进展有关。究其原因,THRSP蛋白阳性过表达与其基因扩增有关,从而介导癌症发生。李润华等研究显示,THRSP基因过表达后蛋白表达上升,脂质合成加快影响乳腺癌细胞内信号通路传导,促进脂质型乳腺癌发生、发展[20]。本研究结果显示,THRSP、ACACA阳性表达NSCLC患者的3年生存率低于THRSP、ACACA阴性表达患者(P<0.05),提示THRSP、ACACA高表达与NSCLC患者预后不良有关,可作为评估NSCLC预后的标志物。多因素Cox回归分析结果显示,低分化、TNM分期为Ⅲ期、THRSP阳性表达、ACACA阳性表达是NSCLC患者预后的危险因素(P<0.05),提示THRSP、ACACA过表达会增加NSCLC预后不良风险,监测其水平变化可行预后预测。
综上所述,THRSP、ACACA在NSCLC组织中均呈高表达,且与临床病理特征及预后有关,可作为NSC-LC预后评估的生物学标志物。
