肿瘤突变负荷与免疫细胞浸润联合分析在非小细胞肺癌预后评估中的意义
2023-12-21陈淑慧李俊玉张怀文
谢 琛 许 晨 陈淑慧 李俊玉 张怀文
肺癌是世界上发病人数及死亡人数最多的恶性肿瘤。据估计,每年有209万肺癌新病例和176万肺癌死亡病例,其中肺腺癌(LUAD)及肺鳞癌(LUSC)占所有肺癌病例的70%[1-3]。目前免疫检查点抑制剂(ICI)疗法被认为是肺腺癌(LUAD)及肺鳞癌(LUSC)患者的有效治疗方法。ICI治疗肿瘤的主要作用原理是针对肿瘤细胞的免疫识别和免疫反应相关逃逸机制。肿瘤细胞上表达的PD-L1已被FDA列为筛选接受PD-1/PD-L1治疗人群的肺癌患者的伴随诊断或补充诊断[4-5]。然而研究表明,PD-L1作为生物标志物有一定的局限性,仍需与其他生物标志物相结合[6]。
肿瘤突变负担(tumor mutation burden,TMB)是指肿瘤样本中肿瘤细胞编码区每百万碱基的体细胞突变数。它被认为是衡量肿瘤突变水平的一个生物学标志[7]。肿瘤中新抗原的数量与TMB相关,高 TMB的患者更有可能产生免疫原性新抗原[8]。一些临床试验表明,TMB与T淋巴细胞的抗原识别和免疫疗法的有效性之间存在正相关,可用于预测PD-1/PD-L1抑制剂的疗效,如黑色素瘤[9]。目前,TMB被用来作为评估LUAD及LUSC患者从 ICI治疗中获益的指标[10]。 作为评估LUAD及LUSC患者接受ICI治疗后预后的一个因素,一些临床试验显示TMB与T淋巴细胞识别抗原和免疫治疗效果之间存在正相关[11]。在本研究中,我们打算通过探讨TMB、免疫细胞浸润与LUAD及LUSC患者预后之间的关系,进一步研究TMB影响预后的机制。
1 资料与方法
1.1 资料获取
我们使用“TCGAbiolinks”R软件包从TCGA 数据库(https://portal.gdc.cancer.gov/)中提取LUAD及LUSC患者的临床信息(年龄、性别、TNM分期)、总生存期(OS)、无进展生存期(PFS)等和突变谱。突变数据处理过程包括GDCquery和 GDCprepare(22)。我们使用“maftools”R软件包来可视化MAF文件(23)。数据处理是由R软件(vision4.2.2)进行。例如,通过“dplry”(24)和“stringr”[B]。此外,我们从免疫学数据库和分析门户ImmPort(https://immport.niaid.nih.gov)(25)获得IRG列表。
1.2 TMB的计算
我们使用“maxstat”R软件包(23)计算样本的TMB。TMB的计算方法是:TMB=(体细胞突变的数量)/(样本CDS区域的长度),CDS(编码序列)指的是蛋白质编码区域序列。计算TMB得分的中位数,将LUAD样本分数低于截断值的定义为低 TMB组,而分数高于截断值的定义为高TMB组。
1.3 高、低TMB组的存活率分析
我们通过Kaplan-Meier方法评估了高、低TMB对LUAD及LUSC患者 OS和PFS的影响。此外,我们还比较了不同临床基线特征对高、低TMB组患者预后的影响。采用Wilcoxon检验来分析2组之间的差异,分析中排除了缺失值的样本。
1.4 筛选出差异表达基因和与生存有关的免疫基因
我们选择用“Limma”(26)检测高、低TMB组的差异表达基因(DEGs)。我们设置差异倍数而不是对数(差异倍数)>1以减少混杂因素的影响,并进行多重检验校正以控制误发现率(FDR<0.05)(27)。我们将DEGs与IRG列表基因进行比较以筛选免疫相关的差异表达基因。用R软件对样本转录组数据结合临床信息数据进行批量生存分析,获得生存相关基因。将生存相关基因与免疫相关差异表达基因进行比较,筛选出生存相关的免疫基因。
1.5 基因通路富集分析
使用R语言对获取的差异表达基因进行功能分析包括KEGG(kyoto encylopedia of genes and genomes)和GO(gene oncology)富集分析。P值及q值定义为<0.05,FDR定义为<0.01。将分析结果以柱状图形式呈现。
1.6 免疫细胞浸润及免疫相关生存分析
我们CIBERSORT反卷积算法进行活化记忆性CD4T细胞、浆细胞、活化NK细胞、调节性T细胞等22种免疫细胞转录特征的模拟计算,设定模拟次数为1 000次,采用Kruskal-Wallis检验对P<0.05的数据进行分析绘制了NSCLC患者免疫浸润微环境景观,并计算22种免疫细胞在NSCLC样本中的比例,将其可视化。对高低TMB组之间的免疫细胞类型进行Pearson相关系数计算,采用秩和检验比较其差异。使用R软件包limma(version 3.40.6)对合并数据集按照|log2Fc|≥1,P<0.05的标准筛选差异表达基因,并绘制热图以及火山图。我们提取Immport数据库免疫相关基因与高低TMB组差异基因,使用“ggVennDiagram”包筛选出来7个差异免疫基因,单因素COX回归分析鉴定出1个与预后相关的基因。
1.7 统计学方法
数据可视化和差异分析由“limma”R包执行。Cox回归分析和Kaplan-Meier分析由“Survival”R包进行。Wilcoxon秩和检验是一种非参数检验,用于检测两组之间的差异。单、多因素COX回归分析差异表达的基因进行预后分析。通过Log Rank检验获得P值,分析免疫细胞浸润水平与其生存的关系。所有统计学分析均在R软件(版本4.2.2)上进行。以P<0.05代表差异具有统计学意义。
2 结果
2.1 NSCLC样本突变图谱分析
我们从TCGA下载了641例LUAD和506例LUSC患者的转录组和样本突变数据。删除缺失值的临床信息后,合并结果如表1所示。LUAD和LUSC患者的平均年龄分别为63.45岁和66.07岁。LUAD和LUSC患者的男女比例为1∶1.19,LUSC患者的男女比例为2.83∶1。同时,我们使用Quartile方法计算患者样本信息的TMB。我们分别对LUAD和LUSC样本的突变基因情况进行了可视化分析(图1、图2)。通过比较可以发现,在33种常见癌症中,LUAD和LUSC的突变负荷排名较高(图1A、图2A)。在LUAD和LUSC中,瀑布图显示了样本中突变频率最高的基因排名,如TP53、TTN、MUC16、CSMD3、RYR2(图1B、图2B)。突变比例最大的是错义突变,单核苷酸多态性明显高于插入或缺失。在LUAD中,最常见的单核苷酸变异类型是C>A,而在LUSC中,除上述类型外,C>T也较为常见(图1C、图2C)。对前15个突变基因的互斥突变和并发突变的映射显示,并发突变的基因较多,LUAD明显高于LUSC(图1D、图2D)。其次,我们观察了这些基因的克隆状态。在理想条件下,样本中克隆基因的平均等位基因频率约为50%(图1E、图2E)。

图1 肺腺癌突变全景图
注:A为恶性肿瘤突变负荷排名;B为非小细胞肺癌前15个突变基因的瀑布图;C为突变信息概况;D为互斥或共同发生的基因突变;E为非小细胞肺癌前15个突变基因克隆状态。

表1 样本信息的基线特征
2.2 高TMB组和低TMB组患者的生存率和生物功能分析
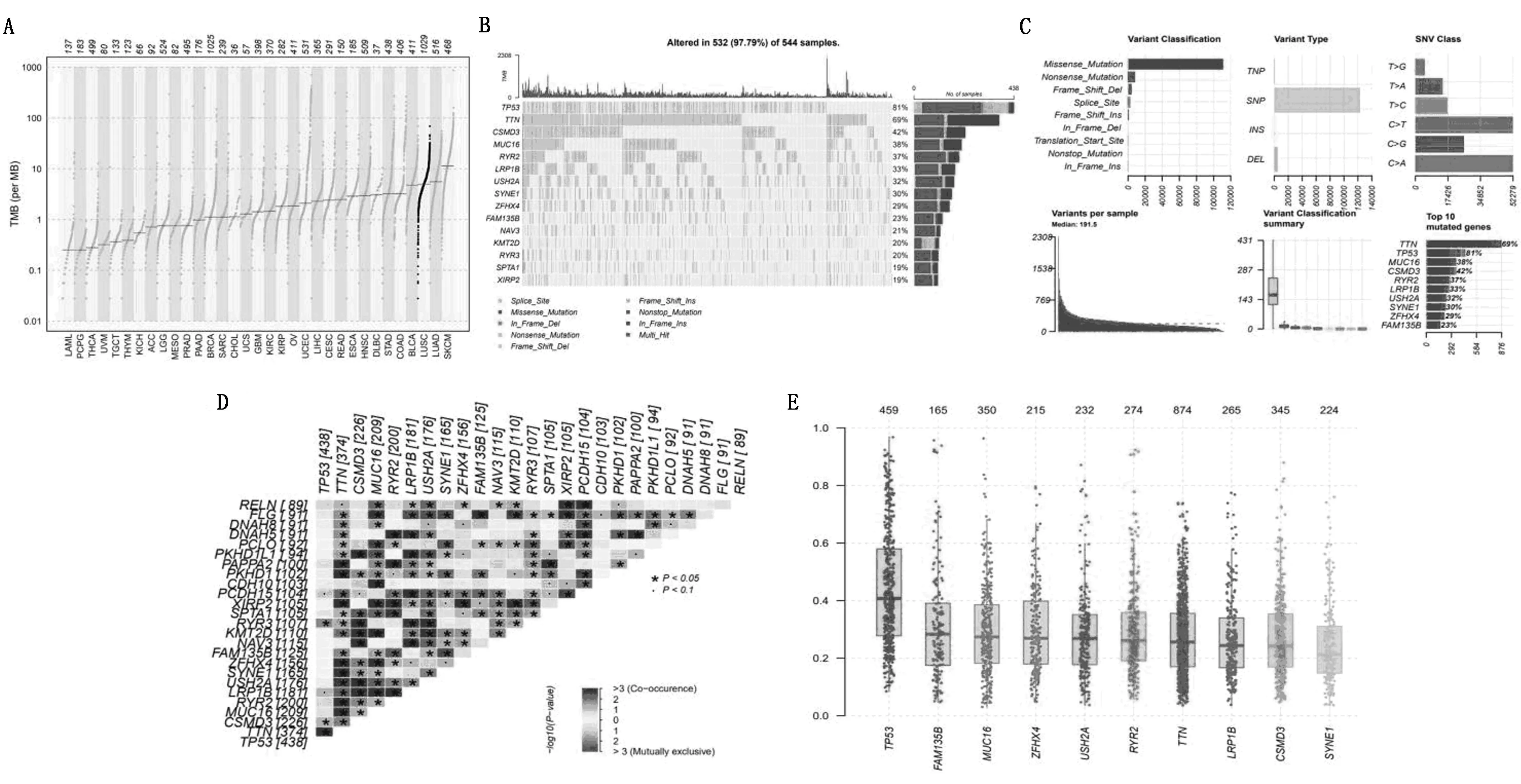
按照中位值将8.56作为TMB高低的划分为TMB高低组。通过绘制高TMB组和低TMB组NSCLC患者的OS生存曲线可以看出,高TMB组患者的生存率优于低TMB组(图3A)。我们进一步进行了差异分析并绘制了基因热图,发现高TMB组和低TMB组的基因表达存在显著差异(图3B、图3C)。在生物学功能方面,KEGG结果表明,这些基因在神经活性配体-受体相互作用、细胞周期、黏附、吞噬体和细胞外基质-受体相互作用中明显富集。GO分析表明,它们可能与区域化、姐妹染色单体聚集、含胶原的细胞外基质、胶原修复、运动活性、微管结合等生物过程有关(图3D、图3E)。
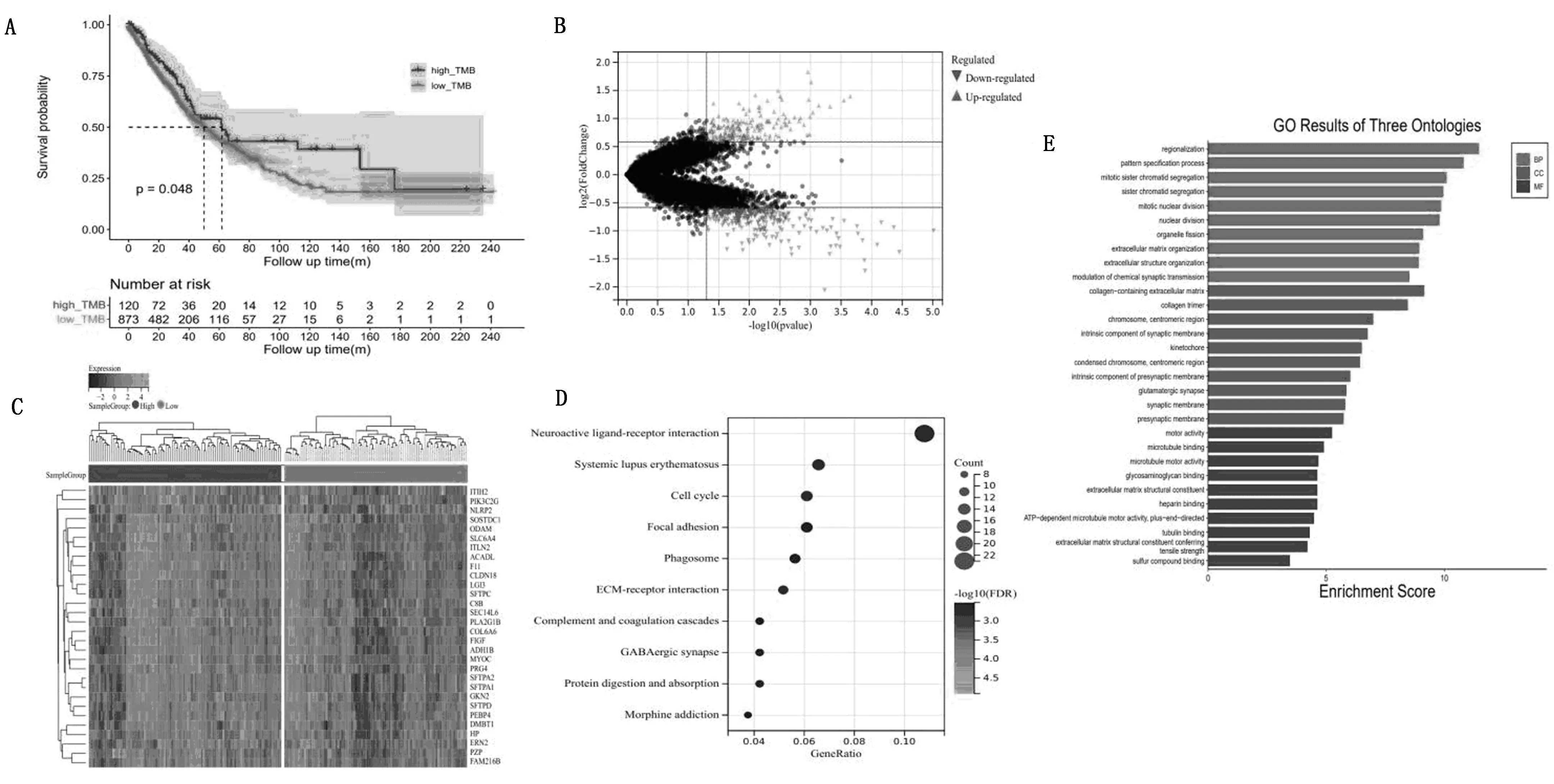
注:A为高低TMB与OS相关性;B-C为高低TMB组差异表达基因火山图及热图;D为GO分析;E,KEGG通路。
2.3 高TMB组和低TMB组免疫相关基因的表达情况
将差异基因与从ImmPort下载的免疫相关基因列表进行比较,我们分析了LUAD患者高TMB组和低TMB组免疫相关基因的差异(见图4)。可以看出,TIGIT、PDCD1、CTLA4和LAG3在高TMB组有明显表达,有统计学意义(P<0.05),而CD274在两组中无明显差异,无统计学意义(P>0.05)。
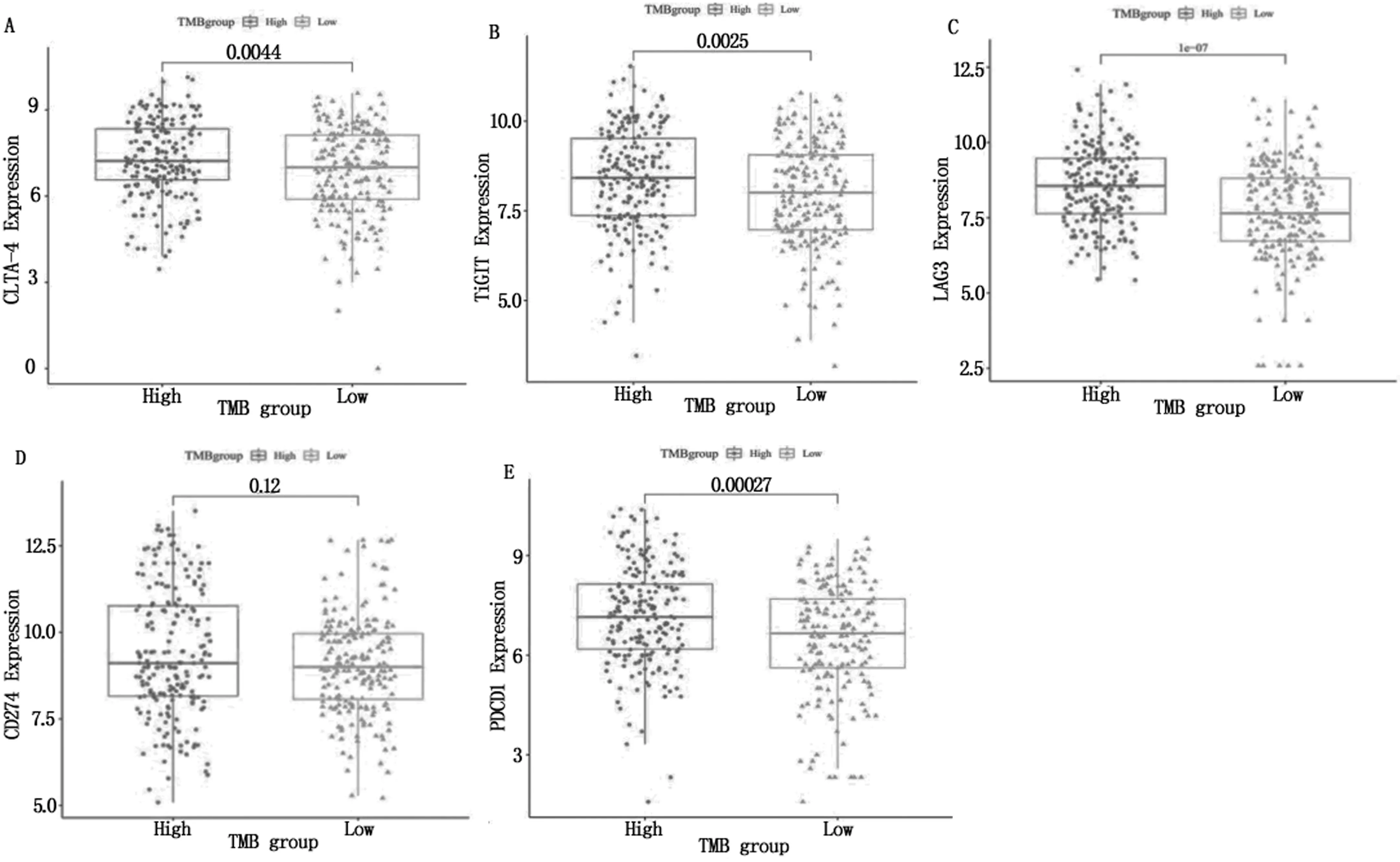
注:A为CLTA-4在高低TMB组表达差异;B为TiGIT在高低TMB组表达差异;C为LAG3在高低TMB组差异;D为CD274在高低TMB组表达差异;E为PDCD1在高低TMB组表达差。
2.4 高TMB组和低TMB组LUAD及LUSC患者的免疫细胞浸润比较
根据TMB水平将LUAD及LUSC患者分为2组,通过“CIBERSORT”R包比较高TMB和低TMB组中的22个免疫细胞。每个GC患者中22个免疫细胞的比例如图5A,可视化图如图5B所示,不同的颜色代表不同的免疫细胞类型。 此外,小提琴图(图 5C)用于可视化免疫细胞比例。Wilcoxon's rank-sum 检验显示,CD8+T细胞、激活期记忆CD4+ T细胞、M1巨噬细胞在高TMB组中浸润高于低TMB组;记忆B细胞、静止期记忆CD4+ T细胞、静止期树突状细胞、激活期静止期树突状细胞在低TMB组中浸润低于低TMB组。将DEGs和免疫相关基因取交集进行多因素Cox回归分析后筛选出CRABP1、CXCL17、DMBT1、PGC、SFTPA1、SFTPA2、SFTPD 7 个基因来构建预后模型。将得到的预后模型行 Kaplan-Meier 生存分析,其结果显示只有CXCL17基因的生存曲线中高、低表达组患者的预后存在显著差异。

注:A为可视化免疫细胞含量柱状图;B为22种类型的免疫细胞浸润状态分布图;C为小提琴图 TMB-high (红色)和TMB-low (绿色)组免疫细胞浸润的比较;D为维恩图,识别差异表达的免疫相关基因;E为TMB药治疗肺腺癌及肺鳞癌等非小细胞肺癌的有效率仅有差异基因与免疫浸润基因交集CRABP1、CXCL17、DMBT1、PGC、SFTPA1、SFTPA2、SFTPD7的高、低表达组患者的生存曲线。
3 讨论
免疫治疗成为目前最有前景的恶性肿瘤治疗手段,为驱动基因阴性的非小细胞肺癌带来了突破性的希望。免疫治疗能为一部分患者带来长期生存,其中临床试验提示PD-L1高表达的晚期非小细胞肺癌5年生存率可以高达29.6%[12]。尽管如此,免疫治疗单不到20%,且PD-L1不能很好预测单药维持治疗的疗效[13]。TMB是最近发现的预测免疫治疗的独立预后标志物,其预测能力已经在黑色素瘤[14],肺腺癌[15]等多种肿瘤被证实。同时TMB结果可以兼顾肿瘤标本的异质性,但其与免疫浸润的关系研究较少。探索分析NSCLC的肿瘤突变负荷及免疫细胞浸润等信息与预后的相关性,为提高非小细胞肺癌的临床治疗水平提供理论基础。
既往研究针对高低TMB的定义有争议,部分研究按四分法将TMB值位于前25%定义为高TMB,将位于后25%定义为低TMB[16]。也有相当一部分RCT研究将TMB值大于10[17]或19[18]作为截断值。T绝对值或者百分比都可以作为TMB高低的划分方法,但考虑其临床推广应用,绝对值更加适合在临床中广泛使用。但TMB的绝对值在不同的样本其阈值不一样,因此在本研究中根据数据训练,得出最佳的TMB高低阈值,将患者分为TMB高低组,我们认为这种TMB分组增加了研究的精确度和结果的意义。在LUSC及LUAD患者高TMB组中TP53、TTN、MUC16属于前3的突变基因,其中TP53是最常见的促癌基因[19],TTN是目前最长的基因,会影响心脏和骨骼肌的发育与调节,已被证实与TMB水平和在实体瘤中对 ICIs的反应高度相关[20]。MUC16是各种癌症中最常见的突变基因之一,与癌细胞的生长和转移增强有关,与高TMB与肿瘤的良好预后有关[21]。
Biagio Ricciuti通过回顾性研究发现高TMB的患者免疫浸润增加,炎性T淋巴细胞反应增加,同时对免疫治疗更加敏感,因此预后更好[18]。但在可切除的不抽烟的NSCLC中,Louis-Jacques Ruel发现高TMB患者的DFS明显短于低TMB患者,其5年生存率仅有64%,而低TMB患者的5年生存率高达87%[22]。本研究中我们发现,高TMB的LUAD及LUSC患者生存预后优于低TMB的人群。TMB作为免疫治疗的疗效预测指标之一,目前普遍认为TMB高的NSCLC,其免疫治疗疗效优于TMB低人群。Louis研究的人群中更多的是不抽烟的NSCLC,这类人群中EGFR突变患者占比高于抽烟的患者,而EGFR、ALK、ROS基因突变的患者其TMB显著不高[23]。而这些有突变的患者随着靶向药物出现,生存明显延长,导致TMB低人群预后提升,在我们的研究中,覆盖了肺腺癌及鳞癌人群,突变人群在整体人群占比不高,可以更真实反映未突变人群TMB高表达预后更好。高铮研究发现TMB表达水平与EGFR突变的NSCLC预后呈负相关[24],也进一步证实这点。本研究通过759 个 DEGs,将得到的DEGs进行GO和KEGG富集分析,结果显示这些DEGs主要参与神经活性配体-受体相互作用、细胞周期、黏附、吞噬体和细胞外基质-受体通路。通过进一步的单变量和多变量 Cox 分析筛选出与NSCLC患者预后相关的基因CXCL17,同时还发现基因的突变与免疫细胞浸润有关。CXCL1是一个与黏膜相关的内环境稳定趋化因子,对血管生成有调控作用以及对树突状细胞和单核细胞有趋化作用:其中对血管生存的调控可以改善肿瘤微环境,而对单核细胞的趋化能调控巨噬细胞极化[25]。
免疫细胞浸润是肿瘤微环境调控免疫治疗疗效的主要手段之一,在本研究中,研究者探讨了TMB值与NSCLC患者免疫浸润之间的潜在关系。通过比较发现22个免疫细胞中CD8+T细胞、激活期记忆CD4+ T细胞、M1巨噬细胞在高TMB组中浸润高于低TMB组;记忆B细胞、静止期记忆CD4+ T细胞、静止期树突状细胞、激活期静止期树突状细胞在高TMB组中浸润低于低TMB组。Chen等研究同样证实了CD8+T细胞、M1巨噬细胞都是在肿瘤免疫调控中发挥正向调控的细胞[26],其中CD8+T细胞直接对肿瘤发挥杀伤作用,而M1巨噬细胞能抑制肿瘤的增殖、转移。
本研究还存在一定的局限性:首先,研究中所有的数据来自TCGA数据库,没有使用外部数据库进行验证;其次,目前非小细胞肺癌驱动基因突变阳性患者接受免疫治疗比例很低,研究中收集的LUAD及LUSC患者并未将EGFR、ALK、ROS等常见的突变患者剔除;再次,TMB作为一个连续变量,目前尚无TMB阈值的共识,同时TMB的检测手段没有标准化,因此在未来的临床推广应用上存在一定局限性。
总之,本研究基于TCGA数据库发现高TMB与非小细胞肺癌更好的生存预后相关,其中CXCL17基因是生存预后的独立因素,其中CD8+T细胞及M1型巨噬细胞浸润提示非小细胞肺癌预后较好。
