鼻咽原发肿瘤微环境中免疫反应对鼻咽癌预后的影响
2023-12-20邵静魏鑫鑫范栩嫚
邵静,魏鑫鑫,范栩嫚
(南阳市中心医院耳鼻喉科,河南 南阳 473000)
鼻咽癌作为常发于鼻咽腔侧壁或者顶端的恶性肿瘤, 常发于我国南方地区, 具有一定的地域性。 鼻咽癌发病较为隐匿,易发生转移[1-2]。 肿瘤微环境一方面为肿瘤的发生、 发展等过程提供了条件, 另一方面肿瘤微环境也是机体免疫系统与肿瘤进行博弈的场所[3]。 肿瘤微环境免疫反应不仅能起到抑癌作用,还能起到促癌的作用,故肿瘤微环境中的免疫反应在肿瘤的发展进程中发挥着重要作用[4]。T 细胞是淋巴细胞中数量较多、功能较为复杂的一类细胞,其中CD4+与CD8+是成熟T 细胞亚群的主要标志[5]。FOXP3 分子是作用于调节性T 细胞(Treg)进行细胞免疫的重要分子并且其具有特异性高等特点,具有作为分子标志物的优势[6],而TGF-β1 作为肿瘤分泌的炎性细胞因子,具有调节T 细胞作用,对肿瘤的发生、发展具有一定的抑制作用[7]。 目前研究表明原发肿瘤体积、发生远处转移、某些蛋白的表达(如LINC00161)是影响鼻咽癌预后的因素[8-9],但是关于鼻咽原发肿瘤微环境中免疫反应对鼻咽癌预后的影响尚未见文献报道。
1 资料与方法
1.1 一般资料 选取2014 年6 月至2017 年6 月南阳市中心医院收治的鼻咽癌患者50 例。 纳入标准:(1)患者组织病理学检测证实为鼻咽癌;(2)符合鼻咽癌诊断标准[10];(3)术前未接受过放化疗、分子靶向治疗等抗肿瘤治疗;(4) 临床病理资料完整;(5)患者及其家属同意参与本研究,并签署知情同意书。 排除标准:(1) 患有严重免疫疾病者;(2)伴有其他恶性肿瘤者;(3)患有严重心肾疾病者。 纳入患者男性30 例,女性20 例;年龄25~72岁,平均年龄(55.92±4.21)岁;肿瘤TNM 分期Ⅰ~Ⅱ期39 例, Ⅲ~Ⅳ期11 例; 发生淋巴结转移23例,未发生转移27 例;肿瘤分期T1+T2 30 例,T3+T4 20 例。 本研究经我院医学伦理委员会批准,所有患者均知情同意。本研究随访截止时间:2020 年6 月30 日。
1.2 免疫组化方法 利用免疫组化双染色法对分子标志物FOXP3、CD4+/CD8+、TGF-β1 进行检测。将制备好的组织切片于56 °C 烘干30~60 min,按照常规方法进行脱蜡及脱水。 利用双内源酶阻消除内源性过氧化物酶的活性。 按照1:10 000 的比例滴加一抗,4 °C 孵育过夜。 清洗3 次, 1:5 000的比例滴加二抗,37 °C 条件下孵育30 min, PBS清洗3 次, 每次10 min, 1:50 的比例滴加DAB 显色剂显色, 8 min,蒸馏水冲洗终止显色反应。 苏木素复染15~30 min,流水冲洗,于含1%盐酸的酒精中进行分化2 s,利用蒸馏水冲洗,切片再次返蓝。之后利用80%、95%及100%的乙醇对切片梯度脱水, 65 °C 恒温箱干燥,二甲苯透明处理后,中性树胶封片。
1.3 观察指标 采用双盲的方式对免疫组化结果进行判定, 选取对患者病情不知情的3 位病理学医生对结果进行判定。3 位医生判定结果一致纳入结果, 不一致则邀请其他病理学医生进行再一次判定。FOXP3 阳性信号定位于淋巴细胞核中,CD4+/CD8+阳性信号定位于淋巴细胞胞膜上,TGF-β1定位于淋巴细胞胞浆中。 首先在×100 低倍镜下选取肿瘤淋巴细胞最丰富的区域, 在×400 高倍视野下随机选取3 个不重复且具有代表性的视野,统计每个视野下阳性细胞的个数, 取其平均值即为高倍镜视野阳性细胞百分率[11]。 计算Cut-off值将分子标志物FOXP3、CD4+/CD8+、TGF-β1 分别分为高表达、低表达。
1.4 统计学方法 所有研究数据均在SPSS 19.0 软件上运行处理,治疗前后计量资料用(±s)表示,符合正态分布的数据组间比较采用t检验,不符合正态分布数据比较采用Mann-Whitney秩和检验;计数资料用百分数 (%) 表示, 组间比较采用χ2与Fisher确切概率法(n<5)检验。Cut-off值采用最小P值法计算,患者生存率采用Kaplan-Meier法进行估计,影响预后的因素采用Cox比例风险模型,检验标准设置为P<0.05。
2 结果
2.1 FOXP3、CD4+/CD8+、TGF-β1 在鼻咽原发肿瘤组织中的表达情况 在鼻咽原发肿瘤组织中FOXP3 在淋巴细胞核中表达,CD4+/CD8+在淋巴细胞胞膜上表达, TGF-β1 在淋巴细胞胞浆中表达,见图1。

图1 FOXP3、CD4+/CD8+、TGF-β1 在鼻咽原发肿瘤组织中的表达情况
2.2 单因素Cox生存分析 单因素Cox生存分析发现, 间质与癌巢中FOXP3、CD4+/CD8+、、TGF-β1等免疫细胞浸润较多的患者较数量少的患者发生转移与死亡的风险较低(P<0.05),见表1。
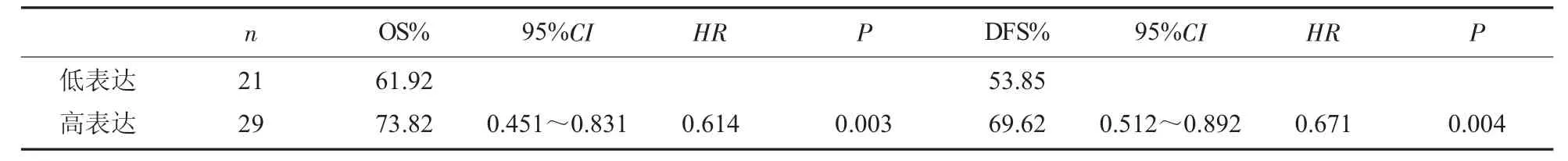
表1 总生存与无瘤生存单因素Cox 生存分析
2.3 FOXP3、CD4+/CD8+、TGF-β1 数量对鼻咽癌患者预后的影响 以患者ROC曲线建立的Cut-off值作为临界值, 将FOXP3、CD4+/CD8+、TGF-β1 分为高、低表达组,Cut-off值为3.0,Kaplan-Meier生存曲线和Log-rank统计结果表明,FOXP3、CD4+/CD8+、TGF-β1 细胞与鼻咽癌患者无瘤生存时间及总体生存时间呈现正相关, 表达量高者患者预后较好, 差异有统计学意义 (χ2=7.031,P=0.000,χ2=7.324,P=0.000),见图2。

图2 微环境中免疫反应与患者的Kaplan-Meier 累计生存曲线
2.4 FOXP3、CD4+/CD8+、TGF-β1 与各项临床参数之间的相关性 结果详见表2。
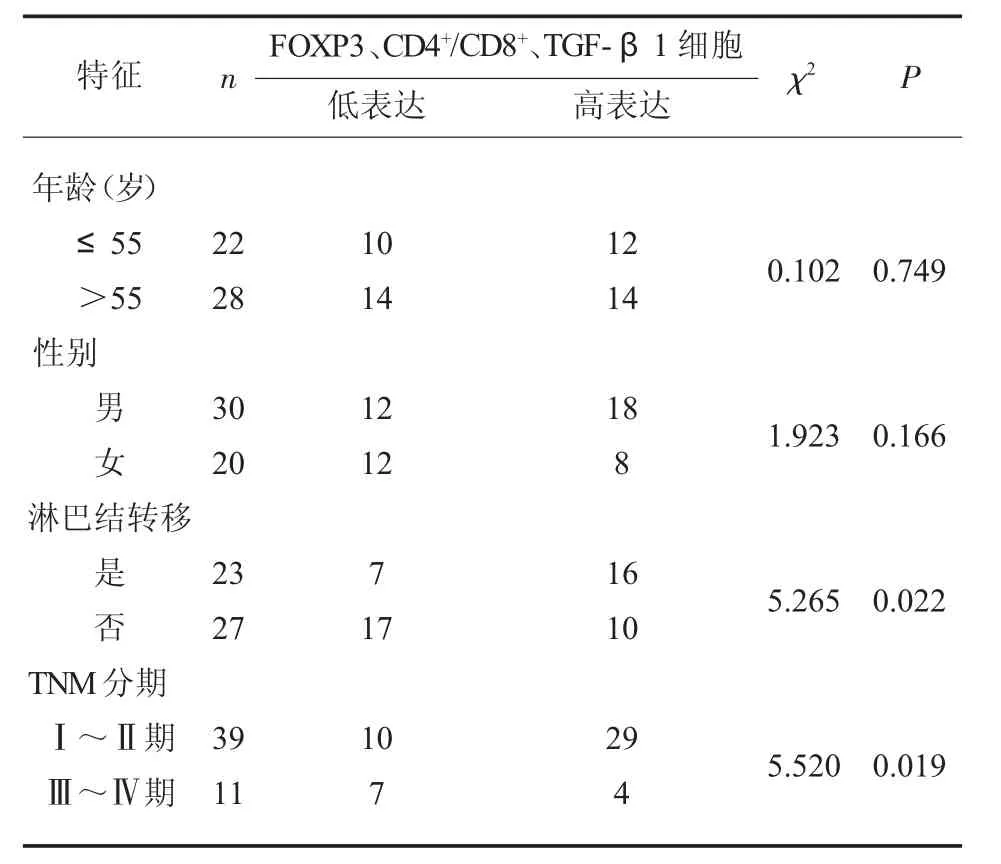
表2 FOXP3、CD4+/CD8+、TGF-β1与各项临床参数之间的相关性
3 讨论
鼻咽癌是遭受EB 病毒感染后发生的一种恶性肿瘤, 鼻咽原发肿瘤组织局部存在大量的淋巴细胞,并且还存在其他的免疫浸润[12]。 由于鼻咽癌发病较为隐匿,早期缺乏相应的检测方法,缺少有效的辅助治疗手段, 易导致鼻咽癌患者较早的发生复发与转移[13]。 免疫微环境作为肿瘤的“第七大标记性特征”,是肿瘤微环境有机整体的重要组成部分[14]。某些免疫细胞浸润在肿瘤微环境中会对整个肿瘤微环境的免疫应答产生影响, 从而影响肿瘤的发生发展[15]。
CD4+T 细胞可以通过分泌不同的细胞因子,进而对免疫系统进行调节, 而CD8+T 细胞浸润则对患者预后具有积极作用, 能够通过释放穿孔素等因子来杀死肿瘤细胞[16-17]。FOXP3 是一种编码位于X 染色体上的, 该分子是调节Treg 免疫抑制功能的主要分子, 是一种具有特异性的较为可靠的分子标志物[18]。 TGF-β1 作为肿瘤分泌的炎性细胞因子,其能够诱导CD4+Treg 细胞的扩增,同时其还能将非调节性CD4+T 细胞转化为CD4+Treg,在一定程度上起到抗肿瘤的作用[19]。本研究结果表明,间质与癌巢中FOXP3、CD4+/CD8+、TGF-β1 等免疫细胞浸润较多的患者较数量少的患者发生转移与死亡的风险较低且患者预后较好, 提示FOXP3、CD4+/CD8+及TGF-β1 在鼻咽癌患者免疫反应中起着抗肿瘤的作用,并且能够改善患者预后,减少复发、转移等风险的产生。 Treg 作为肿瘤免疫逃逸的重要机制之一, 其能够通过抑制效应细胞的免疫反应来抑制机体的抗肿瘤免疫应答[20]。Treg 细胞在鼻咽原发肿瘤微环境中表达量明显升高, 阳性细胞中FOXP3、CD4+/CD8+数量明显上升, 在微环境中被诱导分化后,发挥抗肿瘤作用[21]。有研究表明,在胰腺癌等肿瘤细胞中, 大量的Treg 能够在胰腺导管组织中大量聚集,被肿瘤微环境招募,进而发挥抗肿瘤作用, 影响患者预后[22]。 TGF-β1 是由Treg 细胞分泌的免疫抑制因子, 其能够与白细胞介素等细胞因子共同发挥作用阻碍树突状细胞的分化以及抗原的提呈等作用, 影响细胞免疫在抗肿瘤过程中的作用,影响T 细胞亚群的分化,在免疫反应过程中发挥作用,影响患者的预后[23]。 结肠癌研究中发现TGF-β1 能够起到免疫抑制的作用[24]。 本研究结果表明,FOXP3、CD4+/CD8+、TGFβ1 表达与患者TNM 分期、发生淋巴结转移及肿瘤分期相关。 鼻咽原发肿瘤恶化程度越高,其转移趋势逐渐变强, 鼻咽原发肿瘤微环境中免疫反应FOXP3、CD4+/CD8+、TGF-β1 等可以通过调控淋巴管中的调控因子的表达,抑制淋巴管的生成,阻止鼻咽癌的淋巴结转移,发挥抗肿瘤的免疫反应,是影响预后的良好指标[20]。
综上所述, 鼻咽原发肿瘤微环境中免疫反应能够促进机体的免疫应答,抑制肿瘤的发生、发展等过程,影响患者的预后。
