血清Smad4、TK1、VEGF 对原发性肝癌诊断及预后评估的临床价值分析
2023-12-20张晓华李素娟侯得山
张晓华,李素娟,侯得山
(郑州煤炭工业(集团)有限公司总医院,河南 郑州 450000)
PHC 是恶性肿瘤之一, 每年的新发病例和死亡病例均超过80 万例,而我国的肝癌病例约占全球病例的一半,该病具有发病隐匿、进展迅速、恶性程度高及致死率高等特点[1-3]。 由于发病隐匿,大部分患者在患病早期没有任何临床症状, 经检查确诊时病情已发展至中晚期, 导致进行手术切除的可能性渺小。因此,如何对PHC 进行早期诊断及其预后评估对临床降低PHC 患者的死亡率有重要意义。 血清Smad4 是调节细胞侵袭迁移的重要下游信号通路,与肿瘤扩散关系密切;TK1 是嘧啶补救合成的关键酶,与肿瘤细胞的增殖具有很高的相关性[4-5];VEGF 是最强的促新生血管形成的生长因子,在肝癌形成与进展中起关键作用[6]。 现阶段,临床关于Smad4、TK1、VEGF 三者联合诊断PHC 和预测其患者预后的报道尚少, 故本研究分析PHC患 者 血 清Smad4、TK1、VEGF 水 平 变 化 及 其 与PHC 发生和预后的关系,为PHC 的早期诊断和预后评估提供依据,现报告如下。
1 资料与方法
1.1 临床资料 选取2017 年4 月至2019 年4 月医院确诊的102 例PHC 患者, 将一般资料及随访资料均完整的96 例PHC 患者纳入病例组,其中男52 例,女44 例,年龄39~70(55.42±8.17)岁。 纳入标准:经病理学检查确诊为PHC;既往没有接受过手术切除治疗;临床资料完整;患者及家属了解并积极配合研究治疗,符合《赫尔辛基宣言》相关标准。 排除标准:伴有心、肺、肾功能障碍者;有凝血功能、免疫系统疾病者;其他肿瘤或巨块型者。 选择年龄相似的健康体检者96 例作为对照组,男58例,女38 例,年龄36~73(53.48±8.36)岁。两组患者性别、年龄比较,差异无统计学意义(P>0.05)。
1.2 方法 (1)Smad4:于清早收集被检者的空腹外周静脉血4 mL, 以转速为3 500 r/min 离心10 min, 留取血清,-80 °C 冷藏待检, 使用酶联免疫(ELISA)法测定Smad4 水平,步骤按照检测试剂盒(美国Biolegend 公司) 的说明书严格操作。 (2)TK1: 同上收集肘部静脉血4 mL 放于真空采血管中, 室温静置30 min, 转速4 000 r/min 离心10 min,留取血清,-25 °C 冷藏待检,使用CIS-1 型化学发光数字成像分析仪测定TK1 水平, 步骤按照检测试剂盒 (深圳华瑞同康生物技术深圳有限公司)的说明书严格操作。 (3)VEGF:同上收集静脉血4 mL,室温静置30 min,转速2 500 r/min 离心15 min,留取血清,-30 °C 冷藏待检,ELISA 法测定VEGF 水平,步骤按照检测试剂盒(上海铭睿生物科技有限公司)的说明书严格操作。
1.3 治疗与随访 病例组患者确诊后均予以保肝、白蛋白补充、营养支持等对症治疗,当患者肝功能改善达到A 级,且一般情况好转后,择期进行肝切除术, 并于术后5 周开始行辅助性的经导管动脉化疗栓塞术治疗。 术后每2 个月通过门诊复查患者血清指标以及肝脏B 超, 每4 个月复查胸部X线片。 对可能复发的患者进行腹部CT 扫描和(或)MRI 检查以证实。 必要情况下,可进行超声引导下穿刺活组织病理学检查明确诊断, 随访总时间为手术后1 年或死亡。 以末次随访记录作为随访结果,患者肿瘤复发、死亡、淋巴结转移定义为预后不良,收集发生预后不良的患者数,分为预后不良组和预后良好组。
1.4 统计学处理 采用统计学软件SPSS 19.0 处理数据,计数资料采用(%)表示,行χ2检验,计量资料采用(±s)表示,t检验,采用Logistic回归分析影响患者预后的独立危险因素,P<0.05 为差异有统计学意义。应用受试者工作特征曲线(ROC)及曲线下面积(AUC)评价各时间点Smad4、TK1、VEGF预测PHC 患者预后评估的准确度。
2 结果
2.1 病例组与对照组血清Smad4、TK1、VEGF 水平比较 病例组术后血清Smad4、TK1、VEGF 水平低于术前,差异有统计学意义(P<0.05),且病例组术前和术后血清Smad4、TK1、VEGF 水平均高于对照组,差异有统计学意义(P<0.05),见表1。
表1 病例组与对照组血清Smad4、TK1、VEGF 水平比较(±s)

表1 病例组与对照组血清Smad4、TK1、VEGF 水平比较(±s)
注:与病例组术前比较,①P<0.05;与病例组术后比较,②P<0.05
组别 n 观察时间 Smad4(ng/mL) TK1(pmol/L) VEGF(pg/mL)病例组96术前术后对照组96 23.65±2.63 16.87±1.51①12.54±2.14①②5.67±1.13 3.14±0.23①0.81±0.22①②206.85±29.36 158.82±11.27①84.73±13.21①②
2.2 血清Smad4、TK1、VEGF 水平及三者联合诊断PHC 的ROC曲线 根据AUC选取Smad4、TK1、VEGF 的最佳诊断截点,ROC曲线分析显示,Smad4、TK1、VEGF 联合的AUC为0.889 高于单一指 标Smad4 的0.796、TK1 的0.675 和VEGF 的0.793(Z=9.360、4.485、9.088,P<0.05),见图1,表2。
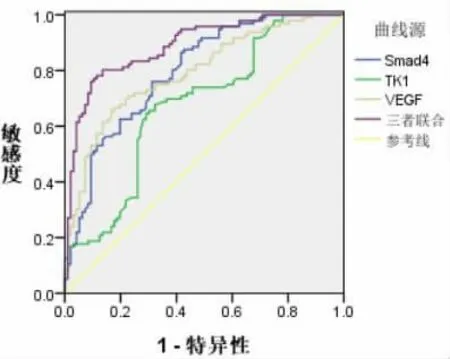
图1 Smad4、TK1、VEGF 及联合诊断PHC 的ROC 曲线
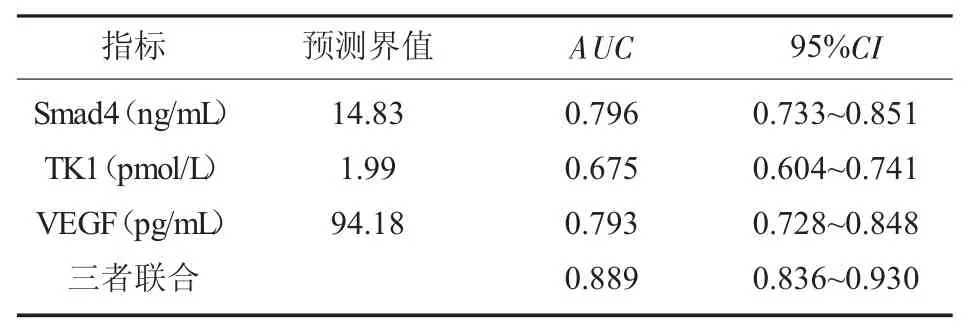
表2 Smad4、TK1、VEGF 及联合诊断PHC 结果分析
2.3 PHC 预后不良与预后良好组血清Smad4、TK1、VEGF 水平比较 96 例PHC 患者中,24 例预后不良,其中肿瘤复发10 例,淋巴结转移8 例,死亡6 例,预后不良率为25.00%。预后不良组术前和术后血清Smad4、TK1、VEGF 水平高于预后良好组,差异有统计学意义(P<0.05),见表3。
表3 病例组预后不良和预后良好组患者血清Smad4、TK1、VEGF 水平比较(±s)

表3 病例组预后不良和预后良好组患者血清Smad4、TK1、VEGF 水平比较(±s)
注:与预后不良组术前比较,①P<0.05;与预后不良组术后比较,②P<0.05;与本组术前比较,③P<0.05。
组别 n 观察时间 Smad4(ng/mL) TK1(pmol/L) VEGF(pg/mL)预后不良组24预后良好组72术前术后术前术后33.27±7.61 19.16±1.24③20.55±3.42①16.31±1.51②③9.83±1.96 3.76±0.21③4.37±0.86①3.01±0.23②③237.21±67.09 172.14±14.25③196.15±32.21①154.48±12.08②③
2.4 血清Smad4、TK1、VEGF 水平及三者联合预测PHC 预后不良的ROC曲线 根据AUC选取Smad4、TK1、VEGF 的最佳诊断截点,ROC曲线分析显示,Smad4、TK1、VEGF 联合的AUC为0.865高 于 单 一 指 标Smad4 的0.791、TK1 的0.796 和VEGF 的0.773 (Z=8.885、9.325、8.020,P<0.05),见图2,表4。
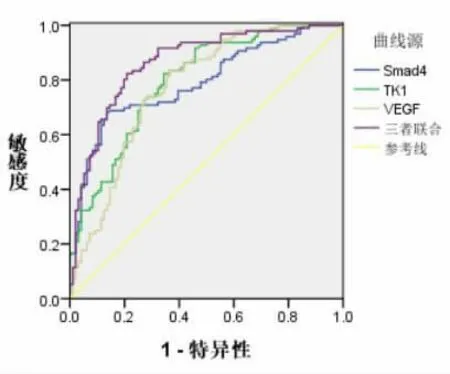
图2 Smad4、TK1、VEGF 及联合预测PHC 预后不良的ROC 曲线

表4 Smad4、TK1、VEGF 及联合预测PHC 预后不良结果分析
2.5 PHC 预后不良单因素分析 预后不良组的年龄、性别、巴塞罗那肝癌临床分期(BCLC)分期、肝功能Child Pugh 分级、 血小板计数与预后良好组比较,差异无统计学意义(P>0.05);预后不良组肿瘤最大直径、肝硬化、脉管癌栓、TNM 分期、腹腔淋巴结转移、肿瘤数目与预后良好组比较,差异有统计学意义(P<0.05),见表5。

表5 预后不良组- 预后良好组一般情况比较[n(%)]
2.6 PHC 预后不良多因素Logisitic回归分析 是否出现术后预后不良作为因变量, 以上述有统计学意义项(Smad4、TK1、VEGF、肿瘤最大直径、肝硬化、脉管癌栓、TNM 分期、腹腔淋巴结转移、肿瘤数目) 作为自变量, 对上述因素进行赋值,Smad4≤22.06 ng/mL=0,>22.06 ng/mL=1;TK1≤8.85 pmol/L=0,>8.85 pmol/L=1;VEG ≤192.74 pg/mL=0,>192.74 pg/mL=1; 肿 瘤 最 大 直 径≤5 cm=0,>5 cm=1,合并肝硬化无=0,有=1,脉管癌栓无=0,有=1,TNM 分期Ⅰ-Ⅱ期=0,Ⅲ-Ⅳ期=1;腹腔淋巴结转移无=0,有=1,肿瘤数目单个=0,多个=1 并将其纳入Logisitic回归模型中,发现Smad4>22.06 ng/mL、TK1>8.85 pmol/L、VEGF>192.74 pg/mL、 合并肝硬化、TNM Ⅲ-Ⅳ期是PHC 患者预后不良的独立危险因素,见表6。
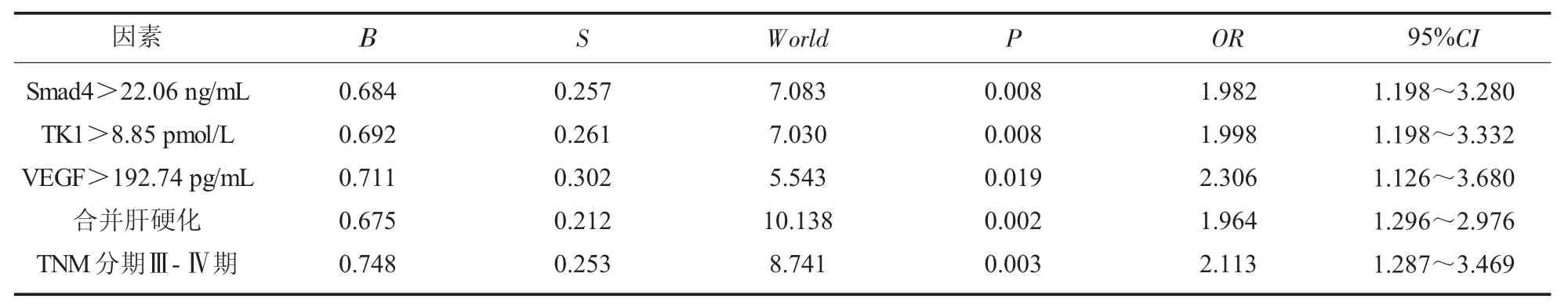
表6 PHC 预后不良多因素分析
2.7 病例组不同血清Smad4、TK1、VEGF 表达状态患者生存分析 分别以血清Smad4、TK1、VEGF 表达水平22.06 ng/mL、8.85 pmol/L、192.74 pg/mL 作为截点值,将大于截点值纳入高表达,小于等于截点值纳入低表达,结果显示Smad4 高表达、TK1 高表达、VEGF 高表达者1 年无进展生存率分别为41.38%(12/29)、57.78%(26/45)、58.33%(28/48)低于低表达者89.55% (60/67)、90.20% (46/51)、91.67%(44/48)(P<0.05);Smad4 高表达、TK1 高表达、VEGF 高表达者1 年总生存率分别为62.07%(18/29)、73.33%(33/45)、72.92%(35/48)低于低表达 者97.01%(65/67)、96.08%(49/51)、95.83%(46/48)(P<0.05)。 见图3。

图3 病例组不同血清Smad4、TK1、VEGF 表达状态患者生存分析
3 讨论
PHC 包括肝细胞癌、 肝内胆管癌和肝细胞胆管细胞混合癌, 其中肝细胞癌占85%~90%。 PHC的发展是一个多基因突变、 多信号通路的癌变过程,大多遵循从慢性肝炎、肝硬化、肝硬化增生结节、不典型增生结节、早早期肝癌、早期肝癌、进展期肝癌这一过程, 这是一个多步骤从分子到临床的演变过程[7-9]。 目前,针对PHC 的治疗,早期患者以手术切除和射频消融等根治性治疗为主要手段, 中晚期患者使用局部治疗联合系统治疗的方式,以有效延长患者的生存时间[10-12]。 随着医学的高速发展, 手术切除方法的切除率和整体治疗效果逐渐提高, 但是仍存在患者由于诊断延误等原因导致预后效果不理想, 因此早期诊断PHC 和预测其预后不良的发生对于提高患者的临床疗效具有重要的意义。
Smad4 是转化生长因子(TGF)-β 通路至关重要的转录调节因子,介导TGF-β 的生物学作用,当TGF-β 与其受体结合后利用Smad4 影响机体细胞内信号通路的转导,从而参与肿瘤的发生、发展,Smad4 水平的增大会促进肝癌的浸润和转移。现阶段,临床关于Smad4 与癌症的相关研究较多,韩翔[13]发现,Smad4 在淋巴结转移者中的表达明显上调,其可以通过介导信号通路促进肿瘤转移。金向宇[14]等也发现, 在肝癌患者中Smad4 表达水平明显高于健康人群,Smad4 可以参与肝癌的发展过程,与肝癌的预后有着密切的关系。 本研究同样发现,PHC 患者Smad4 呈高水平表达, 经手术后水平显著下降,其中预后良好者下降更为明显,原因可能为Smad4 降低可能导致TGF-β 超家族信号途径的抑制作用消失,从而在肿瘤发生、进展中起重要作用。 上述研究提示,Smad4 在肝癌的形成中发挥着促癌作用。
TK1 是一种细胞周期依赖酶, 主要参与细胞DNA 增殖过程。健康人细胞中的TK1 水平较低,细胞增殖过程正常,而TK1 水平的升高,可以为细胞DNA 增殖创造良好的条件, 且恶性肿瘤细胞有无限增殖的特点, 从而造成肿瘤细胞DNA 合成旺盛,促进肿瘤的发生、增殖[15-16]。目前对于TK1 如何参与肿瘤DNA 增殖的过程没有定论,但相关研究表明,其在肝癌患者体内的水平较高,且与术后的预后不良情况有关,具有预测价值[17]。 在本研究结果中,病例组TK1 水平与正常人相比明显偏高,表明肝癌组织中TK1 水平高于正常肝组织, 另外,PHC 预后不良者的TK1 水平要高于预后良好者,说明伴随TK1 的升高预后不良的概率会增大。
除了血清Smad4 和TK1 外, 有研究证实VEGF 可以作为评估患者病情发展及预后的参考指标[18]。 VEGF 是一种促血管内皮增殖的重要因子,可以与多种血管生成因子相互作用, 促进新血管的生成和血管内皮的增大,为肿瘤生长提供基础,直接影响肿瘤细胞的分化迁移,VEGF 水平的增高可以促进肿瘤细胞的增殖[19]。 本研究结果提示,血清VEGF 水平可以用于肝癌病情评估,推测VEGF通过加速心血管生成促进肿瘤的增殖, 与PHC 的发展和预后相关,随着VEGF 水平升高,患者预后越差,此结果与既往杨锦锋等[20]研究结果一致。
为了进一步探讨Smad4、TK1、VEGF 与PHC发生及预后的关系, 本研究通过ROC曲线进行分析, 结果发现,Smad4、TK1、VEGF 联合检测诊断PHC 的AUC高于三者单一检测, 且Smad4、TK1、VEGF 联合预测预后不良的准确性优于单一检测的准确性,表明Smad4、TK1、VEGF 联合对PHC 患者的早期诊断和预后评估具有临床应用价值,目前尚无文献有类似报道。 考虑到PHC 的预后可能与患者的临床特征有关, 本研究根据预后情况进一步Logistic回归分析,结果显示,除了合并传统肝硬化、TNM Ⅲ-Ⅳ期因素外,Smad4>22.06 ng/mL、TK1>8.85 pmol/L、VEGF>192.74 pg/mL 也是影响PHC 预后的独立危险因素, 由此可见,PHC 预后情况与血清Smad4、TK1、VEGF 水平有关, 进一步比较血清Smad4、TK1、VEGF 水平高表达与低表达患者生存情况, 结果显示高表达患者无进展生存率与总生存率均低于低表达患者, 说明临床可以通过对Smad4、TK1、VEGF 的检测和识别进行早期的临床干预,改善患者的预后情况。 王征夏等[21]研究发现, 肝硬化、TNM 分期与PHC 患者发生不良预后有关,本研究结果与其一致,关于合并肝硬化、TNM Ⅲ-Ⅳ期因素为PHC 预后不良的危险因素的研究已有较多,在此不再过多描述。
综上所述,PHC 患者伴随Smad4、TK1、VEGF水平上升, 且预后不良者上升更加明显, 三者与PHC 的发生、预后密切相关,可以作为临床预测患者预后的重要血清学指标。
