心通口服液治疗急性心肌梗死的代谢组学研究
2023-12-20陶舒悦梁万徽张云静
陶舒悦,梁万徽,汪 杰,张云静,3,方 玲,彭 灿,3,5,6
(1.安徽中医药大学药学院,安徽 合肥 230012;2.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012;3.中药复方安徽省重点实验室,安徽 合肥 230012;4.安徽医科大学第一附属医院药剂科,安徽 合肥 230012;5.安徽省中医药研究院中药资源保护与开发研究所,安徽 合肥 230012;6.省部共建安徽道地中药材品质提升协同创新中心,安徽 合肥 230012)
急性心肌梗死(acute myocardial infarction,AMI)是由于冠状动脉粥样硬化导致血管堵塞,从而引起的以心肌细胞缺血低氧为主要特征的一类心血管疾病[1-2]。研究[3]表明,AMI是全球死亡、残疾和痛苦的一大原因,给人类带来极大的健康危害和社会经济负担。现代医学主要采用药物干预和手术治疗的方法,使阻塞的冠状动脉血管恢复供血[4],但这也对患者造成再灌注损伤和微循环障碍等新的问题[5-6]。因此,在当前全球心血管类疾病危害依旧居高不下的情况下,人们迫切需要发现新的治疗方法。
中医药作为中华民族的瑰宝,对治疗AMI具有作用多靶点和整体性治疗的优势,更符合心血管疾病长期用药的特点。中医认为AMI属于“胸痹”“心痛”的范畴,主要治则为活血化瘀、理气止痛[7]。心通口服液是一种传统中药复方制剂,由黄芪、党参、麦冬、何首乌、丹参、当归、葛根等多种中药组成。临床应用发现,心通口服液具有活血化瘀、化痰通络的作用,能够明显改善患者心功能,起到保护心脏的作用[8]。然而,由于心通口服液化学成分多且复杂,目前对于其治疗AMI的作用机制并不明确。
代谢组学作为一个从具象到整体的研究手段,能够敏锐聚焦到小分子化合物的代谢产物变化,从而分析机体的整个调节机制,这与中医的整体观、系统观不谋而合,目前在中医药领域中的应用也很成熟[9-10]。因此,本研究利用代谢组学手段,筛选得到心通口服液治疗AMI的差异代谢物,预测发挥治疗作用的关键成分以及可能的代谢通路,探索其治疗机制,为后续研究提供思路。
1 材料
1.1 药品与试剂 乙腈(质谱纯,批号 F0RQRRQS)、甲醇(质谱纯,批号 T3R8RRXS):安耐吉化学;心通口服液(批号 317210032):鲁南厚普制药有限公司;0.5%~1%伊红乙醇溶液(批号 0496202201)、苏木精染液(批号 0648202110):凯基生物;羧甲基纤维素钠(批号 20210601):天津市大茂化学试剂。
1.2 实验仪器与软件 Vanquish UPLC超高效液相色谱仪、Orbitrap Exploris 120四极杆/静电场轨道阱高分辨质谱仪、Compound Discoverer 3.1化合物分析鉴定软件、H3-18KR高速冷冻离心机:美国Thermo Fisher Scientific Corporation;East Laboratory Epic C18(1.8 μm,120 A,100 mm×2.1 mm)色谱柱:北京东方朗锐科技有限公司;MetaboAnalyst 5.0(https://www.metaboanalyst.ca);AB135-S型十万分之一电子天平:赛多利斯科学仪器(北京)有限公司;Cascada超纯水仪:美国PALL公司;Vortex4涡旋仪:德国IKA;MPA200生物信号分析系统:成都泰盟软件有限公司。
1.3 实验动物 SPF级雄性Wistar健康大鼠40只,体质量200~220 g,由济南朋悦实验动物繁育有限公司提供,实验动物生产许可证号:SCXK(鲁)2019-0003,动物自由饮食,适应性饲养1周,并保证饲养环境12 h明暗循环,在确保动物状态良好时进行分组给药实验。动物实验方案由安徽中医药大学伦理委员会审定,符合国家实验动物福利伦理的相关规定,审批号为AHUCM-rats-2021105。
2 方法
2.1 AMI大鼠模型的复制 采用冠状动脉结扎法复制AMI大鼠模型。正常大鼠适应性饲养7 d后,使用20%的乌拉坦溶液腹腔注射麻醉大鼠。将大鼠仰卧固定于手术板上,剃除大鼠胸口的毛后使用碘伏和75%乙醇进行无菌操作,然后剪开大鼠胸口皮肤,于左侧第4、5肋间的切口撕开心包,使心脏暴露,用手轻压大鼠胸廓挤出心脏。用6-0号带线缝合针(心脏用)立即结扎冠状动脉左前降支。结扎完成后迅速将心脏送回胸腔,同时把胸腔中存在的血液和气体挤出,可避免血液在胸腔中凝固,影响肺功能,以保证胸腔的负压状态。最后迅速关闭胸腔,使用4-0号非吸收性缝合线缝合大鼠皮肤。缝合后使用碘伏对伤口再次进行无菌操作。实行假手术的大鼠只开胸不结扎[11]。模型复制后6 h,采用MPA200生物信号分析系统对每只大鼠进行心电图测定,观察心电图ST段是否抬高,以评价模型复制是否成功。
2.2 分组、给药和样品采集 从40只实验大鼠中选取8只进行假手术操作,剩下的32只进行AMI模型复制,随后将模型复制成功的16只大鼠分为模型组(n=8)和治疗组(n=8),将经过假手术操作的大鼠作为假手术对照组(n=8)。心通口服液的临床剂量为60 mL,以成年人60 kg体质量为参照,按照体表面积法计算得到大鼠给药剂量为6.3 mL/kg。假手术对照组、模型组大鼠连续14 d给予0.5%羧甲基纤维素钠溶液,治疗组连续14 d给予6.3 mL/kg心通口服液原液。20%乌拉坦腹腔注射麻醉后,用不含肝素钠的一次性真空采血管腹主动脉取血,静置1 h后,3 000 r/min 离心15 min,取上清液于-80 ℃储存备用;取血后立即留取心脏样品,放入4%多聚甲醛溶液固定。
2.3 样品前处理 精密吸取血清样品120 μL,加入300 μL乙腈,涡旋混匀5 min,12 000 r/min、4 ℃高速离心10 min,取上清液,37 ℃ 氮气流下吹干,加入140 μL复溶液V(水)∶V(甲醇)=1∶3,涡旋混匀10 min,用注射器吸取处理好的溶液经0.22 μm有机滤膜过滤,滤液装入进样小瓶中,用于色谱质谱分析。将所有样品各取10 μL混合作为质控(quality control,QC)样品。
2.4 病理组织评价 取部分4%多聚甲醛溶液固定和石蜡包埋后的心脏左心室心肌进行苏木精—伊红(hematoxylin-eosin,HE)染色,将染色后的切片置于显微镜下观察,拍照。
2.5 样品测定
2.5.1 色谱条件 所有样品均使用同一根色谱柱。柱温保持在40 ℃,样品室温度保持在6 ℃。流动相由A相[纯水(含0.1%甲酸,0.1%甲酸铵)]、B相(甲醇)组成。梯度洗脱程序:0~1.0 min,98% A;1.0~10.0 min,98%→5% A;10.0~16.0 min,5% A;16.0~16.1 min,5%→98% A;16.1~20 min,98% A。流速为0.2 mL/min,进样容积为2 μL。
2.5.2 质谱条件 离子源:ESI源;喷雾电压:3 800/3 200 V(+/-);离子化模式:ESI+、ESI-;鞘气:40 arb;辅助气:10 arb;毛细管温度:360 ℃;扫面范围:100~1 500m/z;分辨率:17 500 FWHW。所使用的各种气路均为氮气。
2.6 数据分析 将原始图谱数据导入Compound Discoverer 3.1软件,对代谢物进行初步鉴定,将结果导出为CSV格式,利用在线网站MetaboAnalyst 5.0构建主成分分析(principal component analysis,PCA),通过SIMCA 14.0构建正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)以及999次置换检验模型,鉴别并筛选出潜在的差异代谢物。将差异代谢物导入在线网站 MetaboAnalyst 5.0可以得到相关代谢通路。
3 结果
3.1 病理学评价 各组大鼠心脏组织病理切片如图1所示,假手术对照组心肌细胞排列整齐紧密,并无病理性损伤。相较于假手术对照组,模型组心脏受损严重,出现不同程度的间质水肿、心肌纤维破坏、细胞核固缩等损伤,治疗组能够明显看到梗死面积减少,心肌细胞受损较模型组有所逆转。
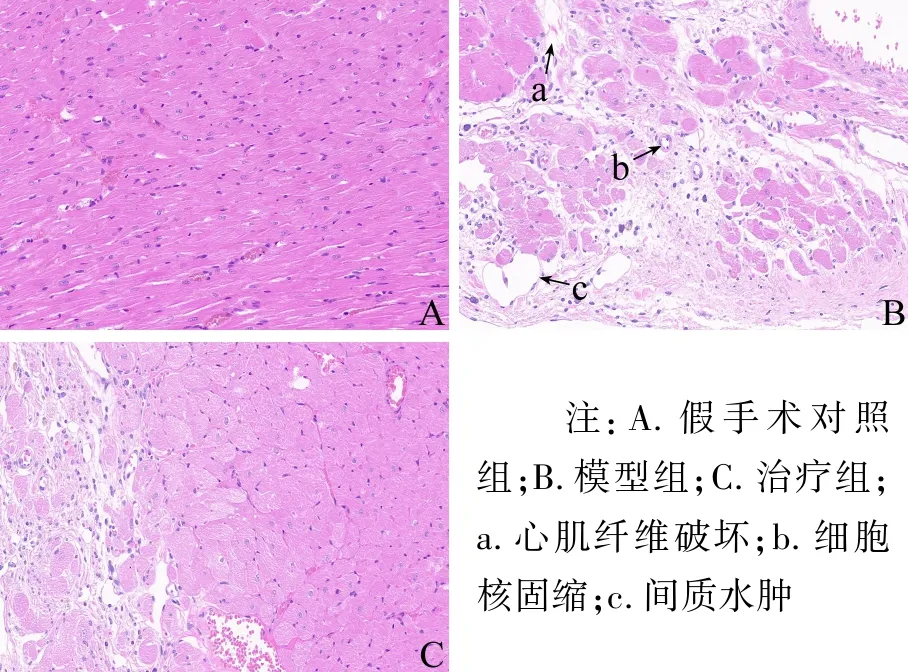
图1 各组大鼠心肌组织切片(HE染色,10×20倍)
3.2 PCA PCA图可以很好地反映组间的分离趋势。图2为样品正负离子PCA图,由图可以得出假手术对照组与模型组有明显分离趋势,说明构建AMI模型成功;模型组与治疗组之间区分明显,说明在心通口服液的作用下AMI大鼠的代谢轮廓发生了异常。图中QC样本聚集程度较高,说明检测过程中仪器稳定,采集的数据质量较好。

注:A.假手术对照组;B.模型组;C.治疗组;D.QC
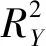
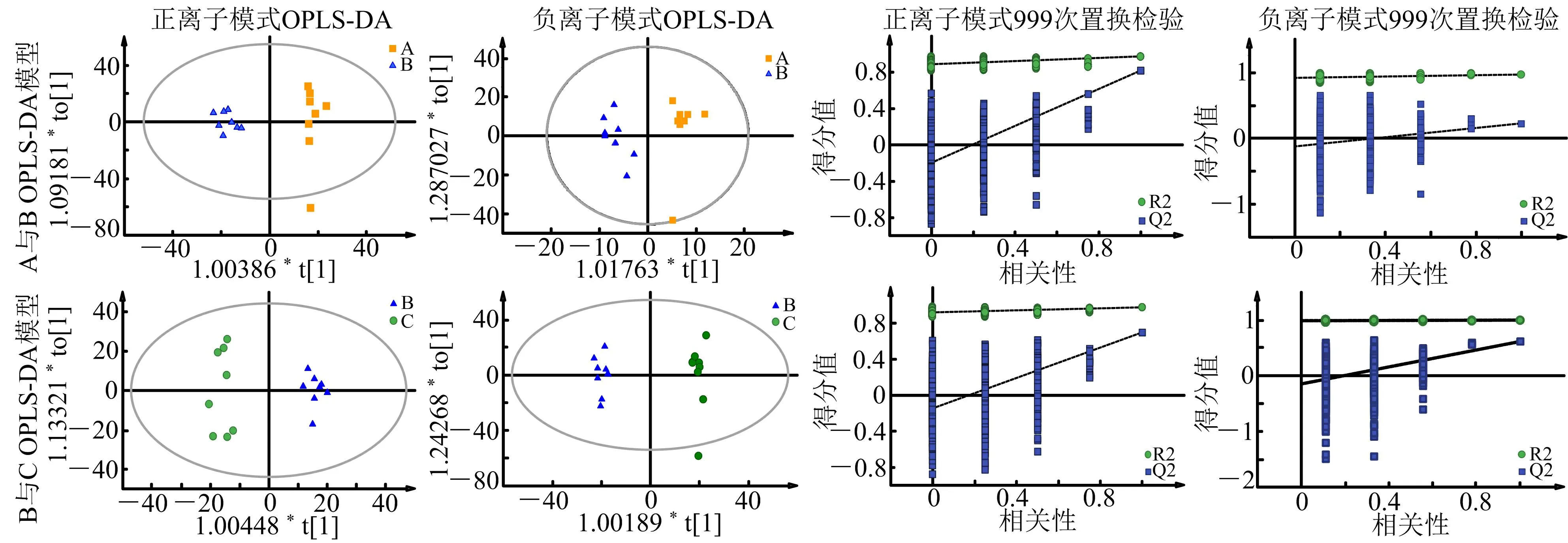
注:A.假手术对照组;B.模型组;C.治疗组
3.4 差异代谢物筛选 通过构建假手术对照组与模型组,以及模型组与治疗组之间的OPLS-DA模型,设置变量投影重要性>1,结合独立样本t检验结果,对P<0.05的样本认为差异有统计学意义,搜索相关数据库及文献,确定两组模型的差异代谢物,最终取两组差异代谢物的交集作为心通口服液治疗AMI的差异代谢物,共有16个。其中模型组与假手术对照组相比,具有上调作用的代谢物有11个,具有下调作用的代谢物有5个;治疗组与模型组相比,具有上调作用的代谢物有4个,具有下调作用的代谢物有12个。见表1。

表1 差异代谢物鉴定结果
3.5 代谢通路分析 差异代谢物参与的代谢通路包括不饱和脂肪酸的生物合成,甘氨酸、丝氨酸和苏氨酸代谢,甘油磷脂代谢,亚油酸代谢,α-亚麻酸代谢,类固醇激素生物合成,花生四烯酸代谢,脂肪酸伸长,脂肪酸降解,嘧啶代谢,脂肪酸生物合成,见表2。以代谢通路富集分析数据为基础作代谢通路图(见图4),其中横坐标为影响值,纵坐标为-lg(P),气泡大小代表该通路的富集程度,由图4可知,差异代谢物对甘油磷脂代谢和甘氨酸、丝氨酸和苏氨酸代谢通路影响较大,且这些通路富集程度较高。

表2 代谢通路鉴定结果

图4 代谢通路富集气泡图
4 讨论
本研究采用超高效液相色谱—四极杆/静电场轨道阱高分辨质谱代谢组学的方法,探讨心通口服液治疗AMI的治疗机制。研究结果确定了心通口服液治疗AMI的生物标志物,包括硬脂酸、棕榈酸、胆碱、磷脂酰胆碱等16个代谢物,主要涉及不饱和脂肪酸的生物合成,甘氨酸、丝氨酸和苏氨酸代谢,甘油磷脂代谢,亚油酸代谢等代谢通路,下面将对一些关键代谢物及代谢通路进行讨论。
4.1 脂质代谢 脂肪酸作为心肌组织的主要能量提供单位,其主要的代谢途径为β-氧化,主要在线粒体中进行,在低氧的情况下,脂肪酸的β-氧化减少,从而导致脂肪酸的积累[11-12]。与模型组比较,治疗组血清硬脂酸、棕榈酸等脂肪酸下调,因此可认为心通口服液通过增加脂肪酸的β-氧化从而减轻心肌缺血低氧[13-15]。硬脂酸、棕榈酸为饱和脂肪酸,在体内分布较广,在供能的同时也参与不饱和脂肪酸的生成,如亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、磷脂[16]。
亚油酸和α-亚麻酸为体内必需脂肪酸[17],亚油酸具有软化血管的作用,AMI大鼠由于体内血瘀、动脉粥样硬化等情况,机体会增加亚油酸的生成,从而起到疏通血管、抗血栓的作用[18]。亚油酸在体内可以转化为α-亚麻酸,进而通过脂肪酸延长生成花生四烯酸[19],花生四烯酸代谢可以生成白三烯B4和前列腺素E2,具有抗炎的作用,对血管弹性、血小板活化等具有一定的调节作用[20-21]。本研究结果显示,治疗组亚油酸、α-亚麻酸相对于模型组都有一定的回调,说明心通口服液可以通过调节亚油酸代谢、α-亚麻酸代谢以及花生四烯酸代谢达到治疗AMI的作用。
二十碳五烯酸是α-亚麻酸的代谢产物,可以调节体内胆固醇及三酰甘油含量,二者通过降血脂、降低血管内血液黏度达到抗血栓,预防动脉粥样硬化的作用[22]。磷脂酰胆碱是甘油磷脂的一种,主要参与细胞膜的组成,是心血管疾病的危险因素之一,可以在体内分解产生溶血磷脂酰胆碱,可参与调节体内神经传递、炎症反应等生物过程[23]。
4.2 氨基酸代谢 研究结果表明:心通口服液通过调控胆碱和甜菜碱参与甘氨酸、丝氨酸和苏氨酸代谢,甜菜碱可由胆碱氧化生成,具有抗氧化和抗炎作用[24];胆碱可通过氧化和脱甲基生成甘氨酸,与炎症反应有关[25]。体内甘氨酸、丝氨酸和苏氨酸为生糖氨基酸,可通过乙酰辅酶A进入三羧酸循环,代谢可产生一碳单位,如胆碱。丝氨酸和苏氨酸可以和甘氨酸相互转化,苏氨酸具有保护细胞膜、促进脂肪酸氧化的作用[26]。甘氨酸是抗氧化物谷胱甘肽的组成之一,同时抑制炎症因子白细胞介素-6的生成[27]。而丝氨酸与免疫应答反应有关[28]。因此,心通口服液可通过参与调控炎症反应和抗氧化作用经甘氨酸、丝氨酸和苏氨酸代谢通路对心脏起到保护作用。
综上,本实验利用代谢组学的研究方法,探究了心通口服液治疗AMI的相关特征代谢物以及代谢通路。结果表明,心通口服液对脂肪酸代谢,花生四烯酸代谢,甘氨酸、丝氨酸和苏氨酸代谢等代谢通路具有明显的调节作用,表明其治疗的关键在于脂质代谢和氨基酸代谢,为后续药理机制的深入研究提供了一定方向。
