灵芝酸治疗阿尔茨海默病作用机制的网络药理学研究
2023-12-20覃云鹏
覃云鹏,邵 楠,叶 树,宋 航,蔡 标,3,4
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽中医药大学中西医结合学院,安徽 合肥 230012;3.安徽省中医药科学院中西医结合研究所,安徽 合肥 230012;4.新安医学教育部重点实验室,安徽 合肥 230012)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,是老年人痴呆最常见的类型[1]。AD患病人数及发病率的逐渐增多给家庭和社会带来了巨大的健康问题和经济负担。AD患者的初期临床症状主要表现为记忆障碍,随着疾病进展出现认知和行为功能障碍。β-淀粉样蛋白(amyloid β-protein,Aβ)积聚形成的老年斑、Tau蛋白过度磷酸化形成的神经元纤维缠结被认为是促进AD发生的两个重要病理特征[2]。此外,AD发病机制可能与胆碱能系统失衡、神经炎症、胃肠道菌群失调和氧化应激等有关[3]。由于AD发病机制复杂,目前尚无有效治疗AD的方法。临床治疗以缓解症状为主,不能达到治愈的效果,而且可能会出现不良反应。
灵芝是著名的“药食同源”菌类。灵芝酸属于三萜类化合物,是灵芝子实体中重要的生物活性成分[4]。研究证实,灵芝酸可以缓解神经炎症、抗抑郁[5]、减少海马神经元凋亡、缓解大脑生理衰退和治疗AD[6]。由于灵芝的种类繁多,成分复杂,对于研究整体药物往往不具有说服力与代表性,且针对灵芝酸的药理学作用,特别是在神经退行性疾病方面的机制目前尚不清晰。因此,探索灵芝酸治疗AD的机制具有重要意义。
本研究利用网络药理学相关的研究手段,收集灵芝酸与AD的共同靶点及相关信号通路,并通过细胞实验进一步验证结果的准确性,为灵芝酸治疗AD提供理论基础。
1 材料
PC12细胞株(大鼠肾上腺髓质嗜铬瘤分化细胞株):中国科学院上海细胞库;DMEM培养基、胎牛血清:以色列Biological Industries公司;Aβ25-35:美国Sigma公司;灵芝酸A:北京Solarbio公司;细胞计数试剂盒(cell count kit-8,CCK-8):美国GLPBIO公司;RIPA裂解液:上海Beyotime公司;GAPDH兔抗大鼠抗体:成都Zen BioScience公司;磷酸化丝氨酸/苏氨酸激酶(phosphorylated serine/threonine kinase,p-AKT)兔抗大鼠抗体:美国Cell Signaling Technology公司;磷酸化磷脂酰肌醇3激酶(phosphorylated phosphoinositide 3-kinase,p-PI3K)兔抗大鼠抗体:英国Abcam公司;山羊抗兔IgG二抗(HRP标记):美国Abbkine公司。
2 方法
2.1 药物成分分析及靶点收集 在Pubchem数据库(https:// pubchem.ncbi.nlm.nih.gov/)中输入灵芝酸的英文全称“Ganoderic acid”,得到不同化学结构的灵芝酸,收集灵芝酸中主要成分的相关信息,并将其结构导入Swiss target prediction平台(http://www.swisstargetprediction.ch/)进行靶点预测,取预测得分大于0的靶标,去除重复校正后作为药物靶点。
2.2 疾病靶点收集 在Disgenet数据库(https://www.disgenet.org)、Drugbank数据库(https://go.drugbank.com/)和Genecards数据库(http://Genecards.org)中,以“Alzheimer’s disease”为关键词进行检索,获得疾病相关作用靶点。最后将3个数据库得到的靶点综合统计,去掉其中重复的靶点,提高准确性。
2.3 构建“活性成分—疾病—潜在作用靶点”网络 通过Venny 2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html),将灵芝酸的活性成分所对应的靶点基因和AD相关的靶点基因进行匹配,绘制韦恩图。采用Cytoscape 3.7.2软件(http://www.cytoscape.org)构建“活性成分—疾病—潜在作用靶点”关系网络,使用Network Analyzer功能对灵芝酸类化合物的主要活性成分进行分析,探究灵芝酸与AD相互作用基因的影响。节点连接度(Degree)反映该成分与作用靶点的关联个数,即该成分的重要性。
2.4 蛋白质相互作用(protein-protein interactions,PPI)网络的构建以及核心靶点的筛选 将灵芝酸治疗AD的潜在作用靶点导入STRING数据库(http//stringdb.org/),设置蛋白种类为“Homo sapiens”,结果收集阈值高于0.4的PPI,获取靶点相互作用的网络关系数据,以便进行进一步的研究。随后利用Cytoscape软件将数据可视化,建立PPI网络图,根据关联程度调整节点的大小和颜色的深浅情况。根据Degree值的大小将靶点进行排序,选取分值大于平均分的基因作为核心靶点,最后将排名前30的靶点使用R 3.6.0软件绘制条形图。
2.5 靶点的生物功能及通路富集分析 基于R 3.6.0软件,使用Bioconducter生物信息软件包,对灵芝酸治疗AD的交集基因进行基因本体(gene ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路分析(选取条件为P<0.05,Q<0.05)。以研究灵芝酸治疗AD靶点的主要生物进程、分子功能、细胞组分等,将结果进行图表可视化。
2.6 PC12细胞的培养和处理 将PC12细胞置于含10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基中,并在含5% CO2的37 ℃培养箱中培养。采用含30 μmol/L Aβ25-35的培养基干预24 h建立AD细胞模型[7]。
2.7 CCK-8法筛选灵芝酸A的最佳浓度 根据成分筛选结果,灵芝酸为排名前三的核心成分之一。此外,相较其他成分而言,有关灵芝酸神经保护作用的报道更多聚焦于灵芝酸A[8]。因此,本研究选用灵芝酸A进行细胞实验。将1×105/mL PC12细胞接种于96孔板中,每孔100 μL,待细胞贴壁后进行试验。分为7组:正常组,不同浓度(5、10、20、50、100、200 μmol/L)的灵芝酸A组。每组重复6次。处理24 h后,弃去旧培养基,每孔中加入100 μL含10 μL CCK-8试剂的培养基,在细胞培养箱中孵育2 h后,最后使用酶标仪测量450 nm处的吸光度,根据细胞存活率选取安全用药浓度。然后将PC12细胞分为以下5组:对照组,模型组,灵芝酸A低剂量(10 μmol/L)、中剂量(20 μmol/L)、高剂量(50 μmol/L)组。每组重复6次。采用CCK-8法检测细胞存活率,选取最佳用药浓度。
2.8 倒置显微镜观察细胞形态 取具有良好生长状态的PC12细胞,计数后稀释至合适的密度接种于6孔板中,待细胞贴壁后,分为对照组、模型组、灵芝酸A组,对照组加入新鲜培养基,其他组加入含30 μmol/L Aβ25-35的DMEM以建立AD细胞模型。灵芝酸A组加入含最佳浓度灵芝酸A的DMEM。培养24 h后,置于倒置显微镜下,选择合适的放大倍数,观察细胞的形态和结构变化。
2.9 Western blot法检测PC12细胞p-AKT和p-PI3K蛋白表达水平 将PC12细胞分为对照组、模型组、灵芝酸A组,根据最佳用药浓度进行相应的药物处理。药物干预结束后,加入细胞裂解液,通过吹打或超声充分裂解细胞,然后离心收集细胞上清液,最后加入蛋白上样缓冲液煮沸后得到蛋白样品。将每组蛋白样品按顺序加至SDS-PAGE凝胶孔中电泳,电泳结束后置于转膜仪中转膜。转膜结束后用TBST洗涤,然后孵育对应的一抗抗体,并于4 ℃环境下孵育过夜。第2天,使用TBST洗涤后,加入预先配置好的二抗溶液,室温孵育1 h。二抗孵育完成后,将洗涤后的蛋白条带置于自动成像仪内检测。使用Image J软件对结果进行灰度值定量分析。
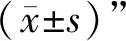
3 结果
3.1 灵芝酸与AD靶点收集 通过Pubchem数据库检索“Ganoderic acid”,共获得176种化合物。其中,7种灵芝酸目前处于不同临床试验阶段,具有良好的疾病治疗和预防前景[9],分别为灵芝酸 A、灵芝酸C2、灵芝酸D、灵芝酸DM、灵芝酸F、灵芝酸X、灵芝酸Y。随后这将7种灵芝酸化合物导入Swiss Target Prediction数据库,取预测得分大于0的靶标作为药物靶点,去除重复后获得247个靶点。这表明灵芝酸具有多成分、多靶点的特征。通过检索Disgenet数据库、Drugbank数据库和Genecards数据库,去除重复后得到AD靶点1 020个。将灵芝酸活性成分作用靶点与AD靶点相匹配,得到灵芝酸与AD的关键靶点56个。见图1。结果提示,灵芝酸可能通过共同作用靶点的协同作用发挥治疗AD的功能。
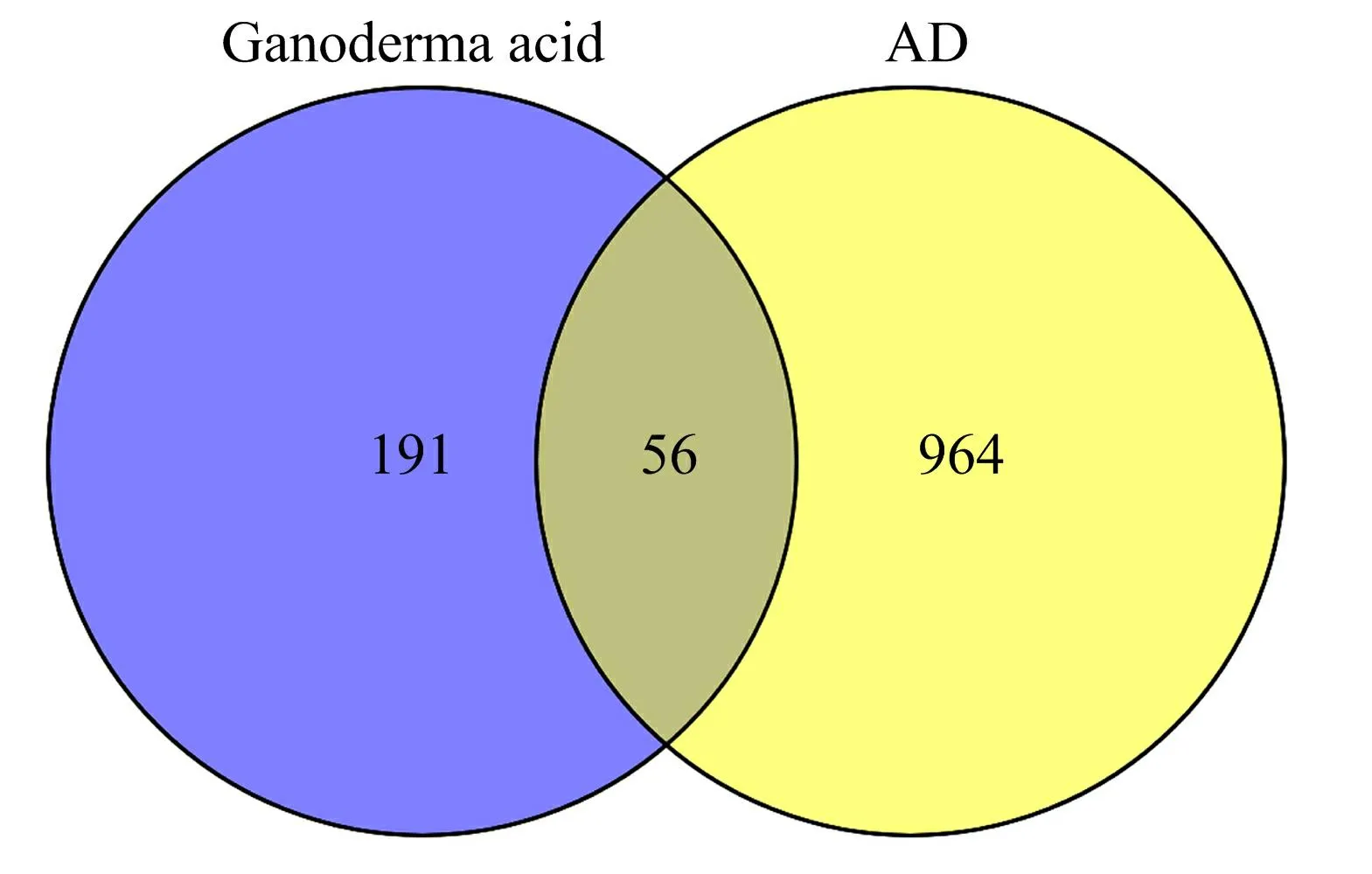
图1 灵芝酸类化合物AD靶点韦恩图
3.2 活性成分—疾病—关键作用靶点网络构建与分析 将活性成分和潜在作用靶点导入Cytoscape软件进行网络构建,得到“灵芝酸活性化合物—AD—潜在作用靶点”网络。见图2。图中紫色代表灵芝酸类化合物中7种活性成分,红色代表疾病,绿色代表56个共同靶点。使用Network Analyzer对网络图进行拓扑分析,通过Degree值筛选核心成分。见表1。结果表明,灵芝酸D、灵芝酸A、灵芝酸C2为Degree值排名前3的活性成分,说明这些活性成分可能在灵芝酸治疗AD中起着关键作用。
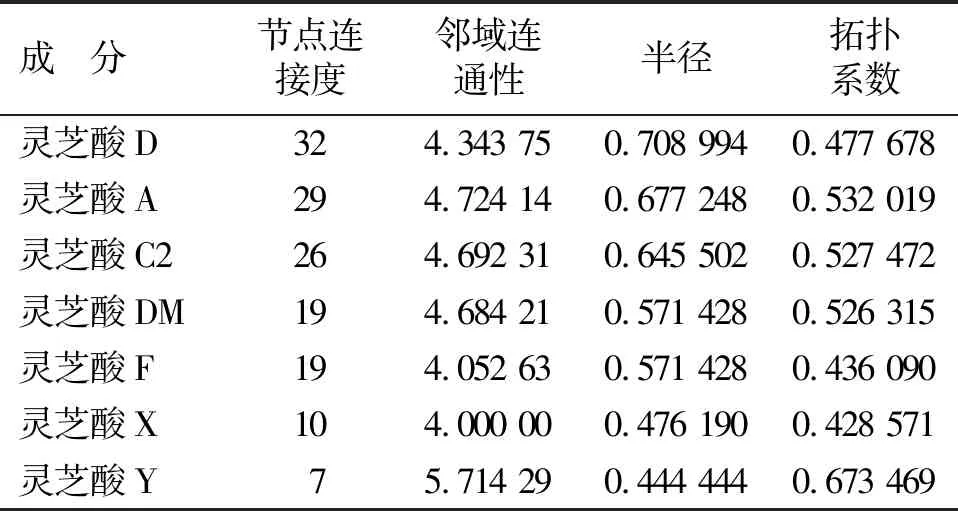
表1 灵芝酸的核心成分在网络中的拓扑分析
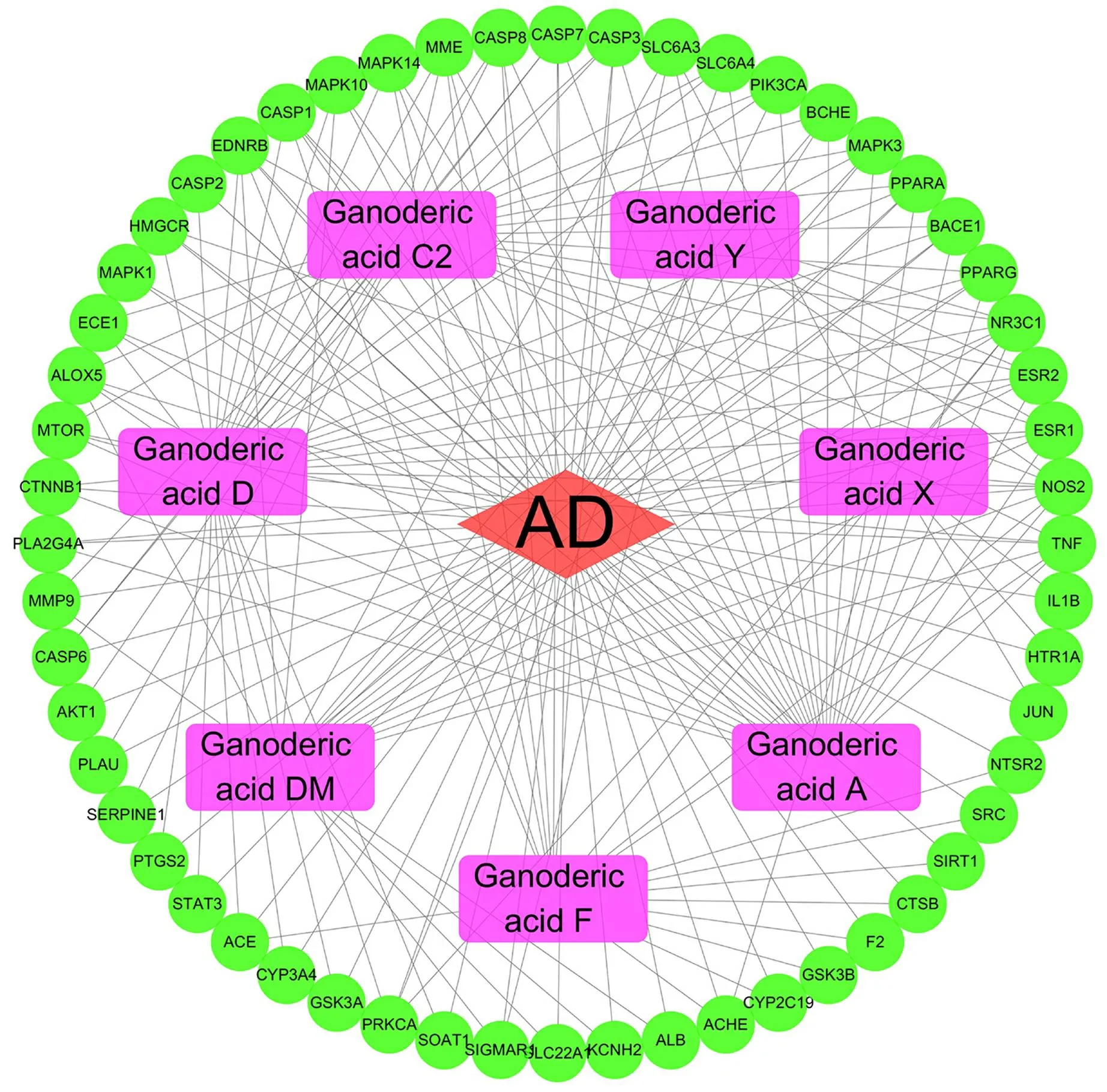
图2 成分—靶点—疾病相互作用的网络图
3.3 PPI网络以及核心靶点分析 将灵芝酸与AD的56个共同靶点基因输入至STRING数据库,得到蛋白相互作用信息,随后导入Cytocape软件绘制PPI网络。见图3A。其中蛋白之间的相互关联越多,则它的节点越大,颜色越深。将PPI网络导入Cystoscap中,通过Network Analyzer工具进行拓扑分析,通过Degree值排序,选取分值大于平均分的基因作为核心靶点,将前30个靶点使用R 3.6.0绘制条形图。见图3B。其中排名前10的靶点依次为AKT1、ALB、MAPK3、CASP3、TNF、MAPK1、PTGS2、JUN、SRC、STAT3。

注:A.PPI网络;B.基于PPI拓扑分析的核心靶点排序(排名前30)
3.4 GO富集分析 通过GO富集分析可以大致了解基因富集在哪些生物学功能、途径或细胞定位,为后续研究奠定基础。本研究GO富集分析结果显示:共有1 648个GO条目(P<0.05,Q<0.05),包含1 513个生物学进程(biological process,BP)条目,35个细胞组成(cellular component,CC)条目,100个分子功能(molecular function,MF)条目,并展示各部分富集基因数排名前20的通路可视化条形图。其中,条形的长度代表基因的数量,颜色的深浅代表显著性水平。见图4。在GO富集的BP分析中,基因主要富集在对脂多糖的反应(response to lipopolysaccharide)、衰老(aging)、调节神经元死亡(regulation of neuron death)等。通过CC分析,可以了解到,灵芝酸治疗AD的靶点大多集中膜筏(membrane raft)、膜微区(membrane microdomain)和膜区(membrane region)等。在MF分析中可以看出,靶点主要涉及内肽酶活性(endopeptidase activity)、磷酸酶结合(phosphatase binding)和蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)等。

注:A.生物学进程;B.细胞组成;C.分子功能
3.5 KEGG通路富集分析 根据KEGG通路富集分析结果,共得到154条KEGG信号通路。以Count值排序,展示富集基因数排名前20的通路可视化气泡图。见图5。其中,气泡颜色的深浅代表显著性水平。结果显示,灵芝酸治疗AD主要涉及的通路如下:神经变性(pathways of neurodegeneration),17个基因;人巨细胞病毒感染(human cytomegalovirus infection),16个基因;卡波西氏肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection),15个基因;癌症中蛋白聚糖(proteoglycans in cancer),15个基因;TNF信号通路(TNF signaling pathway),14个基因;乙型肝炎(hepatitis B),14个基因;糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications),13个基因;细胞凋亡(apoptosis),13个基因;C型凝集素受体信号通路(C-type lectin receptor signaling pathway),13个基因;恰加斯病(Chagas disease),13个基因。表明灵芝酸的活性成分靶点分布于不同的通路,灵芝酸可能通过多个通路对AD发挥作用。

图5 灵芝酸与AD交集靶点的KEGG通路图
3.6 灵芝酸A安全浓度和最佳用药浓度的筛选 与对照组比较,当灵芝酸A浓度为5、10、20、50 μmol/L时,细胞存活率没有明显改变,而当灵芝酸A浓度为100、200 μmol/L时,细胞存活率明显下降(P<0.05),表明对海马神经元造成了损伤。见图6a。因此,后期实验选择10、20、50 μmol/L作为灵芝酸A低、中、高剂量组的用药浓度。结果表明,与对照组比较,模型组细胞存活率显著下降(P<0.05);与模型组比较,灵芝酸A 10 μmol/L组细胞存活率没有明显改变,灵芝酸A 20、50 μmol/L组细胞存活率明显升高(P<0.05),见图6b。结果表明,灵芝酸A可以抑制AD细胞模型中的细胞死亡,其中以高剂量组效果最好。因此,选用50 μmol/L作为后续实验灵芝酸A组的用药剂量。

注:A.对照组;B.灵芝酸A 5 μmol/L组;C.灵芝酸A 10 μmol/L组;D.灵芝酸A 20 μmol/L组;E.灵芝酸A 50 μmol/L组;F.灵芝酸A 100 μmol/L组;G.灵芝酸A 200 μmol/L组;H.模型组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.7 灵芝酸A对AD细胞模型形态的影响 对照组细胞形态规则,贴壁生长,呈梭形或多边形,交织成网状。与对照组比较,模型组细胞数目明显减少,形态明显损伤,出现不同程度的变圆、皱缩、脱落,细胞间隙增大。与模型组比较,灵芝酸A组细胞数目增多,整体形态趋于正常,单一部分细胞减少。结果证实,灵芝酸A对AD细胞模型中的细胞损伤具有保护作用。见图7。

图7 倒置显微镜下的各组细胞形态(10×20倍)
3.8 灵芝酸A对AD细胞模型中PI3K/AKT信号通路蛋白表达水平的影响 根据PPI网络分析,灵芝酸A治疗AD的核心靶点为AKT1。AKT1是AKT的3种亚型之一[10]。AKT被上游的PI3K激活,对KEGG分析中关键的AD途径发挥重要作用[11]。故本研究选取PI3K/AKT信号通路进行细胞实验,进一步探讨灵芝酸A对AD的作用机制。结果显示,与对照组比较,模型组p-AKT、p-PI3K蛋白表达水平显著升高(P<0.05);与模型组比较,灵芝酸A组p-AKT、p-PI3K蛋白表达水平显著下降(P<0.05)。见图8。结果表明,灵芝酸A可明显减少AD细胞模型PI3K/AKT信号通路相关蛋白的表达水平。
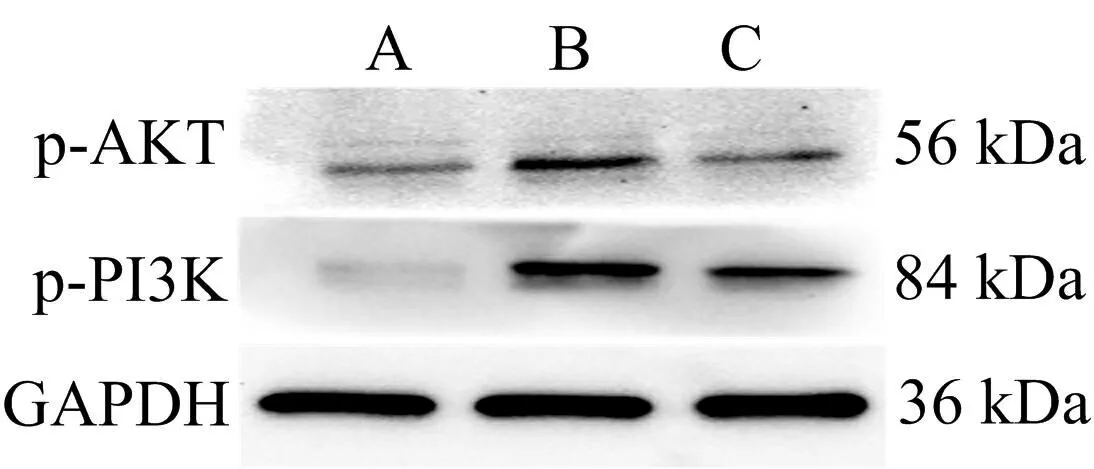
注:A.对照组;B.模型组;C.灵芝酸A组;与对照组比较,*P<0.05,与模型组比较,#P<0.05
4 讨论
AD是由众多因素引起的复杂的疾病,也是痴呆常见的类型之一。AD的发病人群主要集中在老年人,且随着年龄的增加,发病的风险会越来越大。AD患者常有不同程度的语言、记忆和行为障碍。然而,目前临床上并无有效治疗AD的方法,大多数药物仅能缓解AD患者最明显的症状。灵芝酸是灵芝三萜类次级代谢物,具有抑癌、抗炎、抗衰老[12]等多种药理活性。近年来,灵芝酸在中枢神经系统中的神经保护作用与机制备受关注。已有研究[13]证明,灵芝的活性提取物可以延缓AD的进展。本研究借助网络药理学分析手段对灵芝酸和AD的共同靶点及涉及的相关通路,并结合实验验证进行综合分析,为后续药理实验的开展奠定基础。
本研究所选取的灵芝酸化合物共7种,其治疗AD的核心化合物为灵芝酸D、灵芝酸A和灵芝酸C2。据报道,灵芝酸A通过激活Axl诱导的自噬促进Aβ清除[6],改善AD小鼠模型中的认知功能障碍。灵芝酸C2可以促进神经营养因子的产生[14],从而治疗神经退行性疾病。灵芝酸D可以通过PERK/NRF2信号通路抵抗氧化应激所诱导的衰老[15]。此外,灵芝酸DM、灵芝酸F在神经系统中均具有保护作用[16-17]。然而,对灵芝酸X和灵芝酸Y的研究尚未涉及神经疾病领域,这是未来研究的方向。
通过交集实验和PPI网络分析共获得了56个的共同靶点,其中AKT1、ALB、MAPK3、CASP3、TNF和MAPK1等是该网络的关键靶点。在这些靶点中,AKT的所有亚型从胚胎期就在中枢神经系统中大量表达,促进神经发生、神经元存活、神经分化和神经保护[18]。激活PI3K/AKT信号通路可能是增强神经元存活率并阻断AD发生的关键途径[19]。此外,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子也在AD病理生理中发挥重要作用[20]。而PI3K/AKT通路的刺激可以限制TNF-α的基因表达和活性[21],从而缓解神经炎症。此外,靶点Caspase-3的活化可以对AKT进行剪切,抑制PI3K/AKT信号通路传导,诱导神经细胞凋亡,进而影响认知功能[22]。综上,灵芝酸可以通过多成分、多靶点形成相互作用网络,减轻神经炎症,减少神经元凋亡,治疗AD。
体外实验发现,灵芝酸A治疗AD的最佳用药浓度为50 μmol/L。倒置显微镜下发现,灵芝酸A可以挽救AD细胞模型的形态损伤。灵芝酸A治疗AD的具体作用机制有待进一步探讨。研究[23]表明,异常的PI3K/AKT信号通路可以导致Tau蛋白的过度磷酸化,引发AD。因此,本研究通过结合PPI网络分析结果,验证灵芝酸A通过PI3K/AKT信号通路对AD的影响。结果表明,p-PI3K和p-AKT的异常增加是导致AD发生的重要原因。而通过灵芝酸A的治疗,p-PI3K和p-AKT表达水平显著降低。这一现象可能是由于PI3K/AKT信号通路的异常激活导致AD中神经元发生自噬抑制所引起的[24]。
本研究通过对交集靶点进行GO富集分析,从功能、参与的生物途径和细胞中的定位对基因产物进行了简单注释。结果表明,灵芝酸治疗AD的靶点分布在细胞的多种组分上,生物进程主要包括组织或细胞在生长、发育和死亡过程中的各类代谢反应,在分子功能上主要体现为各种活性物质的结合反应。GO富集结果显示,灵芝酸治疗AD的靶点主要集中在细胞组分方面,这提示灵芝酸可能通过参与不同细胞反应过程达到治疗AD的作用。KEGG通路富集结果显示,灵芝酸治疗AD的核心通路主要涉及AD、人巨细胞病毒感染、C型凝集素受体信号通路和细胞凋亡等。其中,巨细胞病毒慢性感染最近被证明是认知能力下降和AD及相关痴呆的危险因素[25]。树突状细胞相关C型凝集素-1受体与AD的神经炎症有关[26]。晚期糖基化终产物及其受体RAGE增加活性氧并参与AD的发病机制[27]。这些有关感染、炎症的因素,均可引起Aβ沉积、Tau过度磷酸化等反应,导致神经元凋亡[28]。
综上所述,本研究通过网络药理学方法筛选了灵芝酸的几种活性成分,并分析了其与AD的共同靶点及调控的分子机制。通过体外实验进一步验证其核心靶点AKT1及PI3K/AKT信号通路在AD发病机制中的作用。本研究结合相关文献揭示了灵芝酸可能通过减轻神经炎症反应、抑制细胞凋亡和修复自噬障碍等多种途径来治疗AD,表现出多靶点、多通路的特点。然而,由于数据库信息的不全面、缺乏体内实验等因素,使得预测结果具有一定的局限性。但本研究仍可以为相关实验的进一步探究提供思路和方向。
