可注射藻蓝蛋白纳米复合水凝胶的制备及其对伤口愈合效果研究
2023-12-19龙金华滕丽晶
龙金华, 廖 影, 滕丽晶, 曾 柱
(1. 贵州医科大学附属肿瘤医院 头颈肿瘤科, 贵州 贵阳, 550004;2. 贵州医科大学 生物与工程学院/基础医学院, 贵州 贵阳, 550025)
全层皮肤损伤一直是临床治疗中的一个复杂问题,水凝胶支架的应用可为细胞的募集和细胞外基质的沉积提供人工基质,以加速创面愈合。然而,传统的水凝胶没有可注射性和自愈性,不能完全覆盖形状不规则的创面。因此,开发一种可注射的多功能水凝胶敷料对促进创面愈合具有重要意义。为实现这一目标,本研究采用纳米黏土分散液弱碱性含氧环境预聚合多巴胺单体形成聚多巴胺(LP)聚集体,并将其与藻蓝蛋白(CPC)混合,通过氢键、离子键以及席夫碱等可逆键形成可注射纳米复合水凝胶。该水凝胶的形成过程可有效防止多巴胺的过度氧化,同时通过引入CPC进一步改善聚多巴胺/纳米黏土聚集体的流变性能,形成生理条件下稳定的可注射水凝胶。形成的可注射水凝胶能够通过较小的针头注射到损伤部位,有效促进伤口愈合。
1 材料与方法
1.1 主要试剂和仪器
纳米黏土(BYK, 德国)、盐酸多巴胺(阿拉丁生化科技股份有限公司,中国)、C-藻蓝蛋白(麦克林,中国)、新西兰大白兔抗凝兔血(百奥莱博,中国)、冷冻干燥机(FD5系列,金西盟国际集团公司), MCR 流变仪(MCR 302, Anton Paar)、激光共聚焦(Ti2, NIKON)和扫描电子显微镜(Q25, FEI, 美国)。
1.2 方法
1.2.1 可注射CPC/LP纳米复合水凝胶的制备: 制备LP纳米片,称预定量(60、90、120、150 mg)的纳米黏土加入6 mL去离子水室温磁力搅拌2 h后,称3 mg的盐酸多巴胺加入,室温避光磁力搅拌5 h后,高速离心分散液(10 000转/min, 5 min), 冻干后获得LP纳米片[1]。称预定量(60、90、120、150 mg)的LP纳米片加入6 mL去离子水室温磁力搅拌2 h分散均匀后,称30 mg CPC加入,继续室温搅拌3 h后获得CPC/LP纳米复合水凝胶。根据质量百分浓度将纳米复合水凝胶命名为CPCx/LPy, x代表CPC的质量浓度, y代表LP的质量浓度。因此,可将上述配比分别命名为CPC 0.5/LP1, CPC 0.5/LP2和CPC 0.5/LP3。
1.2.2 可注射CPC/LP纳米复合水凝胶的微结构表征: 将制备得到的CPC/LP纳米复合水凝胶注射到盖玻片上,利用CPC的荧光特性,采用激光共聚焦表征其原位湿态微结构。用液氮快速淬冷制备好的纳米复合水凝胶,冷冻干燥后喷金,采用扫描(SEM)采集纳米复合水凝胶的截面微结构图片。
1.2.3 可注射CPC/LP纳米复合水凝胶的流变性能表征: 采用Anton Paar流变仪表征其储能模量G′和损耗模量G″。G′代表弹性部分,即形变能力中储存的部分; G″代表黏性部分,即形变能力中损失的部分。G″
应变扫描分析: 选用PP50不锈钢圆板(50 mm直径)测试可注射水凝胶,测试间隙设置为0.5 mm。应变扫描用于获取超分子凝胶在37 ℃条件下的线性区。其测试程序为振幅应变范围0.1%~1 000.0%, 角频率为10 rad/s, 测试温度为37 ℃, 法向应力FN为0 N。
频率扫描分析: 应变扫描用于获取超分子凝胶在37 ℃条件下的线性区,选取测试振幅应变为0.1%角频率的范围0.1~10.0 rad/s, 测试温度为37 ℃, 法向应力FN为0 N。
动态应变扫描分析: 基于上述可注射水凝胶的应变扫描可获取可注射水凝胶的破坏应变。通过设定交替变化的振幅应变(大应变破坏凝胶结构,小应变观察凝胶结构恢复情况)来评估其自修复的性能。其测试程序如下: 保持角频率为10 rad/s, 交替应变分别为1%和1 000%, 测试温度为37 ℃, 法向应力FN为0 N。施加1 000%大应变50 s破坏凝胶的结构; 通过施加1%的小应变150 s来让凝胶结构恢复。循环测试3次。
剪切变稀分析: 使用所制作的可注射水凝胶进行测量,采用Anton Paar流变仪表征其黏度,选用CP-25-1圆板测定稳定凝胶态的黏度随剪切速率的变化定量评估其剪切变稀可注射性。测试程序如下: 剪切速率变化范围为0.01~100.00 rad/s, 测试温度维持37 ℃。
1.2.4 可注射CPC/LP纳米复合水凝胶的血液相容性表征: 采用离心新西兰大白兔抗凝兔血获取红细胞(RBCs), 利用RBCs与不同浓度可注射水凝胶共孵育的方式评价可注射水凝胶的血液相容性[3]。取2 mL的柠檬酸钠抗凝兔血置于15 mL离心管中, 3 000转/min离心15 min, 离心后用磷酸盐缓冲液(PBS)(pH值7.4)洗涤3次,去除上清液,提取离心管底部沉淀的RBCs备用。称取不同质量的可注射水凝胶(0.5、1.0、2.0、5.0 mg)加入1.5 mL的抗凝管中,取0.8 mL的PBS缓冲液和0.2 mL分离好的RBCs加入; 取0.2 mL的RBCs加入0.8 mL去离子水作为阳性对照组,取0.2 mL的RBCs加入0.8 mL的PBS缓冲液作为阴性对照组,用枪头轻轻吹打均匀后置于37 ℃培养箱孵育5 min, 取出后1 000转/min离心10 min, 取0.1 mL的上清液置于96孔板,采用酶标仪读取540 nm处的吸光度值,通过下述公式计算可注射水凝胶的溶血率:
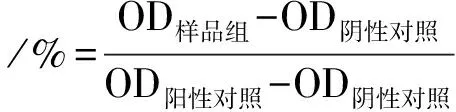
OD样品组、OD阴性对照、OD阳性对照分别代表样品组、阴性对照组、阳性对照组的吸收值。
1.2.5 可注射CPC/LP纳米复合水凝胶的体外细胞相容性表征: 将小鼠皮肤成纤维细胞(L929)以2 500个/cm2接种在24孔板,加入含10%胎牛血清(FBS)和1%青霉素/链霉素的完全培养基(DMEM)培养1 d让细胞铺展黏附。随后,吸走孔板里面的培养基,加入水凝胶浸提液(4、8、10 mg/mL)的完全培养基继续培养细胞,培养24 h后,用CCK8试剂盒测定450 nm处的吸光度,通过下述公式计算细胞活性:
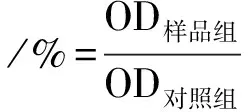
OD样品组、OD对照组分别代表样品组和对照组的吸收值。
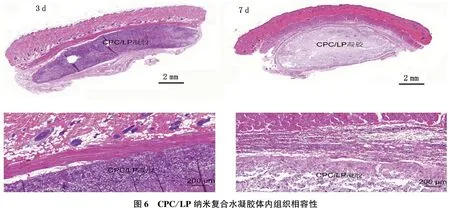
1.2.6 可注射CPC/LP纳米复合水凝胶的组织相容性表征: 通过在SD大鼠皮下注射的方式探究可注射CPC/LP纳米复合水凝胶的组织相容性[4]。动物实验根据贵州医科大学实验室动物护理和使用指导方针进行,并经贵州医科大学实验动物伦理委员会批准。随机选取雄性SD大鼠9只,采用戊巴比妥钠麻醉后剔除皮肤毛发,将配制好的无菌凝胶溶液使用1 mL注射器缓慢注射100 μL到SD大鼠皮下,分别在3 d和7 d后,随机选择3只小鼠麻醉后灌注处死并取出水凝胶周围肌肉组织,石蜡包埋,通过苏木精-伊红染色(HE染色)评价其组织相容性。
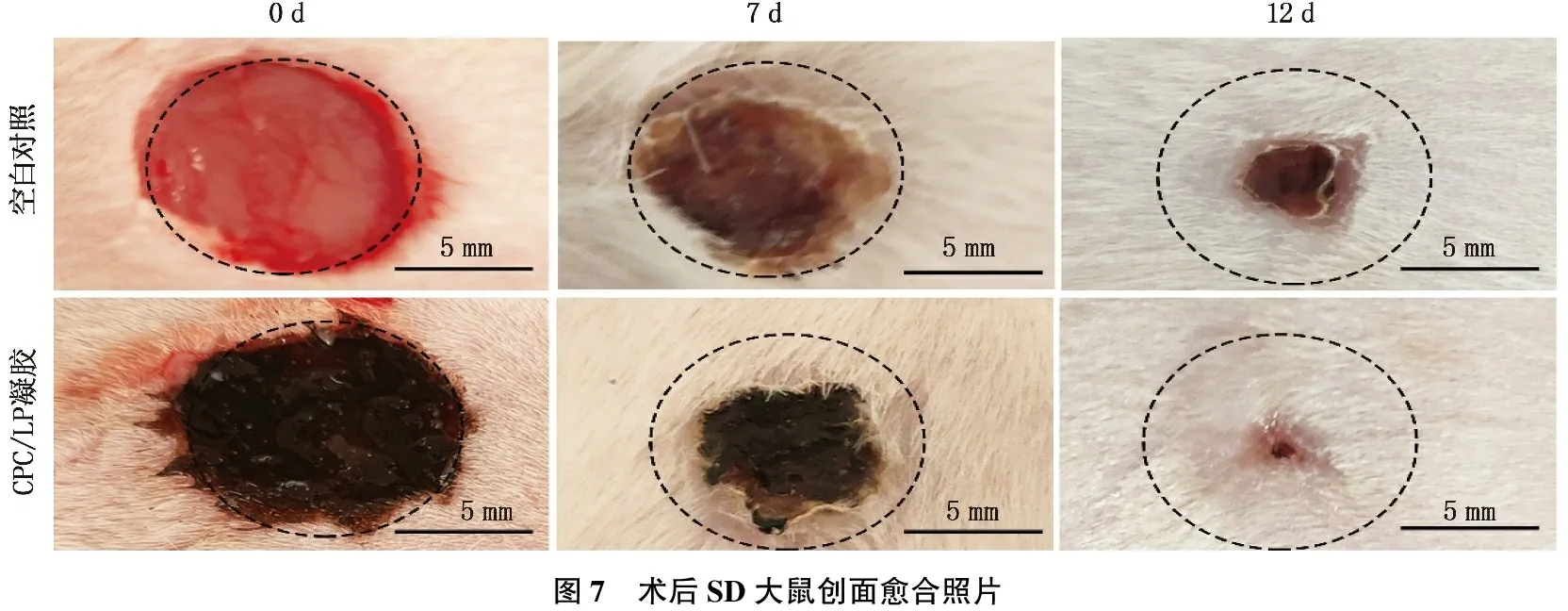
1.2.7 可注射CPC/LP纳米复合水凝胶体内创面愈合的效果验证: 构建SD大鼠背部皮肤伤口缺损模型探究可注射水凝胶对皮肤组织伤口愈合的效果[5]。将6周龄的SD大鼠随机分为2组,一组作为实验组,一组作为空白对照组。用戊巴比妥钠麻醉后剔除皮肤毛发,再用10 mm直径全层皮肤取样器制造伤口,通过1 mL注射器将水凝胶样品注射在伤口区域,并用医用敷贴和胶带包扎伤口。未处理的伤口作为对照组。分别在7 d和12 d时观察并拍摄伤口愈合图像,经过标准麻醉过程后收集SD大鼠背部皮肤标本,浸泡在多聚甲醛(4%)中固定48 h, 石蜡切片后进行HE染色和Masson染色以评估组织修复效果, Masson染色操作步骤严格按照Masson染色试剂盒说明书进行。
1.3 统计学分析
所有实验至少平行测试3次(n≥3), 数据以平均值±标准偏差的形式描述,样品的统计学差异采用T检测分析,P<0.05 表明差异有统计学意义。
2 结 果
2.1 可注射CPC/LP纳米复合水凝胶的制备
CPC/LP纳米复合水凝胶的制备包括2个步骤。首先,多巴胺(DA)被插入到黏土纳米片层中,氧化作用被限制在有限的纳米片层之间,进而形成含有游离邻苯二酚基团的PDA功能化的Laponite(LP)纳米片。多巴胺加入纳米黏土分散液后,反应液颜色逐渐由浅粉色变为褐色,表明在Laponite形成的弱碱性微环境中, DA逐渐聚合形成PDA(图1A)。在成功制备LP纳米片的基础上,将冻干的LP纳米片制备成不同质量浓度的分散液,通过在分散液中加入CPC, 搅拌分散均匀后可制备CPC/LP纳米复合水凝胶。维持CPC质量浓度为0.5%时,随着LP质量浓度从1.0%增大到3.0%, 凝胶化性能逐渐变好(图1B)。
2.2 可注射CPC/LP纳米复合水凝胶的微结构
维持CPC质量百分数为0.5%时,当LP纳米片质量百分数为1.0%时, CPC/LP自组装纳米复合微结构比较稀疏,随着LP质量百分数从2.0%增大到3.0%, 自组装微结构逐渐变得密实。CPC0.5/LP3纳米复合水凝胶具有典型的水凝胶海绵孔结构(图2)。
2.3 可注射CPC/LP纳米复合水凝胶的流变性能
基于上述对CPC/LP纳米复合水凝胶凝胶化性能和原位微结构的研究,后续选择CPC 0.5/LP3作为研究对象,对其流变性能进行系统研究。如图3A所示,当测试间隙设置为 0.5 mm, 角频率为 10 rad/s, 测试温度为 37 ℃, 法向应力设置为0 N时,当应变小于4%时, G′大于G″, 表明CPC/LP呈稳定的凝胶态。随着应变继续增大, G′逐渐减小, G″逐渐增大,当应变为20%时, G′= G″, 为纳米复合水凝胶网络被破坏的临界点。随着应变逐渐增大, G′

A: LP纳米片形成过程图片; B: LP含量对CPC/LP纳米复合水凝胶凝胶化性能的影响。图1 可注射CPC/LP纳米复合水凝胶照片
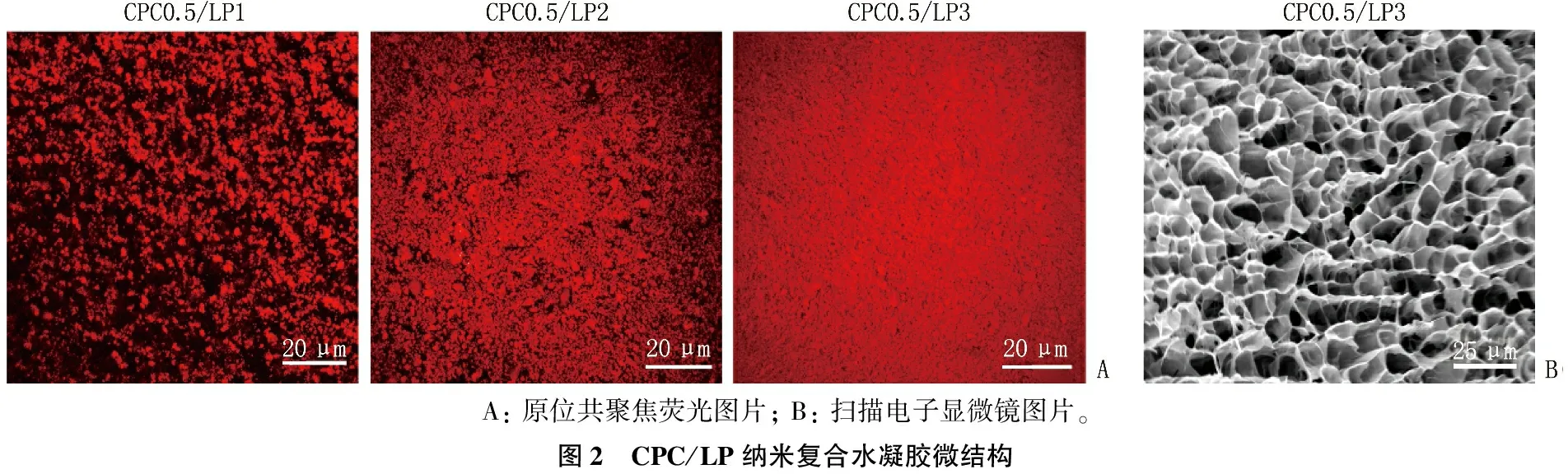
A: 原位共聚焦荧光图片; B: 扫描电子显微镜图片。图2 CPC/LP纳米复合水凝胶微结构
2.4 可注射CPC/LP纳米复合水凝胶的血液相容性
本研究主要通过将不同质量浓度的CPC/LP纳米复合水凝胶与红细胞进行共孵育的方式评价其体外血液相容性。如图4所示,去离子水作为阳性对照, PBS(pH值7.4)作为阴性对照。当CPC/LP纳米复合水凝胶质量浓度为0.5 mg/mL时,溶血率为(1.7±0.3)%, 随着浓度增大到2.0 mg/mL, 溶血率为(3.4±0.2)%。溶血比低于5.0%, 符合国家标准,表明CPC/LP纳米复合水凝胶具有良好的血液相容性。
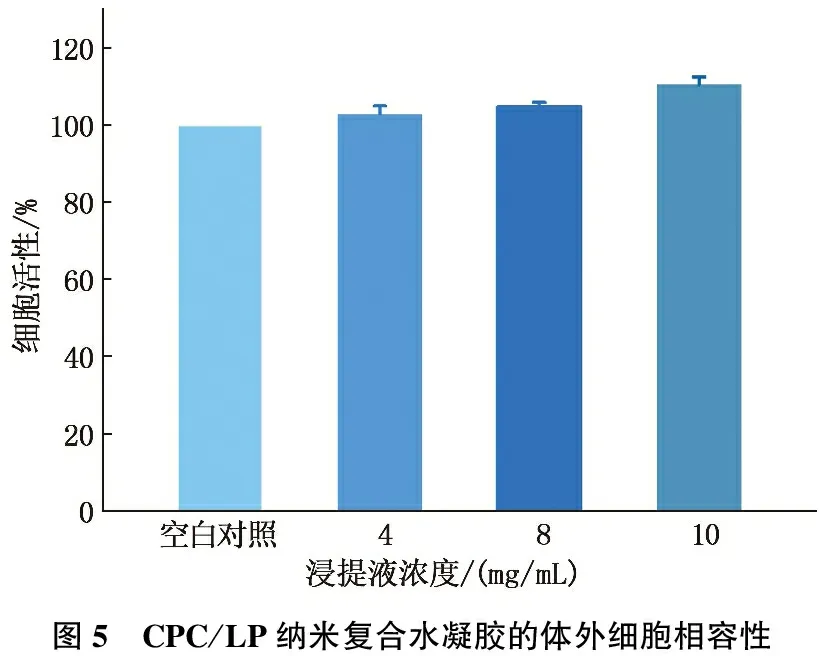
2.5 可注射CPC/LP纳米复合水凝胶的细胞相容性
以小鼠皮肤成纤维细胞 L929为细胞模型,通过浸提液与L929细胞共培养的方式评价其细胞毒性。如图5所示,通过将不同浓度的水凝胶浸提液与L929细胞共培养24 h后,测定培养液在450 nm的吸光度值,得到不同浓度可注射水凝胶的细胞毒性柱状图。从图中可以看出,即使浸提液的浓度高达10 mg/mL, 其细胞活性与空白对照组相当,由此可知L929细胞活性并未受水凝胶浸提液影响,表明构建的可注射水凝胶具有良好的细胞相容性。

A: 应变扫描曲线; B: 频率扫描曲线; C: 动态应变扫描曲线; D: 剪切速率-黏度曲线; E: 可任意塑形图片。图3 CPC/LP纳米复合水凝胶的流变性能

2.6 可注射CPC/LP纳米复合水凝胶的组织相容性
从注射3 d后邻近组织的HE染色可以看出,凝胶部位有炎症细胞浸润。而注射7 d后,邻近组织部位的炎症细胞明显减少,且有巨噬细胞的出现。这是由于植入的可注射凝胶产生的炎症反应会激活免疫细胞(巨噬细胞)分泌炎性因子,进而募集更多的免疫细胞到植入位置开始清除凝胶,表明制备的可注射水凝胶具有良好的组织生物相容性(图6)。
2.7 可注射CPC/LP纳米复合水凝胶促创面愈合效果评价
空白对照组和CPC/LP水凝胶组在0、7、12 d在创面愈合过程中的代表性图片见图6, 术后7 d, CPC/LP水凝胶组创面闭合明显。术后12 d, 各组创面缺损继续缩小,而CPC/LP水凝胶组缺损的创面已经完全被新生的上皮组织覆盖,缺损创面几乎得到完全修复,表明制备的可注射水凝胶能够有效促进SD大鼠的创面闭合(图7)。
为进一步观察CPC/LP纳米复合水凝胶的创面愈合效果,取第7、12天的创面组织进行HE染色和Masson染色。术后12 d, 相比空白对照组, CPC/LP水凝胶处理组的毛囊和附属结构较多,在Masson染色中,由于胶原纤维被染成蓝色,而肌肉纤维和细胞质被染成红色, CPC/LP纳米复合水凝胶组呈现有更多的胶原蛋白沉积,表明CPC/LP水凝胶组能够有效促进创面闭合(图8)。
3 讨 论
伤口愈合一直是临床研究重点探讨的问题之一,水凝胶材料的应用为细胞的募集和细胞外基质的沉积提供了人工基质,以加速创面愈合[6]。然而,传统的水凝胶没有可注射性和自愈性,不能完全覆盖形状不规则的创面。可注射水凝胶由于其独特的剪切变稀性能以及可任意塑形性已成为生物材料领域的研究热点[7-8]。席夫碱和狄尔斯-阿尔德等化学反应,以及氢键相互作用、静电相互作用和疏水相互作用等超分子相互作用均可用于可注射水凝胶的制备[9]。
DA水凝胶由于具有组织黏附性、生物相容性、抗氧化活性等生物学特性和自愈合性能,被广泛用于生物医学领域[10-11]。研究表明, DA 在碱性有氧潮湿的环境中可以氧化自聚合形成PDA。然而, DA水凝胶的形成通常需要添加氢氧化钠、高碘酸钠等强氧化剂诱导DA在水凝胶网络中聚合形成PDA, 强氧化剂的加入很容易导致PDA的过度氧化[12]。纳米黏土又称硅酸镁锂,其结构式为Na0.7Si8Mg5.5Li0.3O20(OH)4, 是一种表面带负电荷、边缘带正电荷的具有片层结构的纳米材料,其直径约为25 nm, 厚度约为1 nm。本研究利用纳米黏土的层状结构容易被DA小分子插层,同时纳米黏土分散液弱碱性含氧环境可直接将DA聚合形成PDA, 反应过程中不需要引入任何其他强氧化剂[1, 13]。
CPC是蓝藻的活性色素之一,通常从丝状蓝藻螺旋藻中分离得到,根据光谱特性的不同,可将CPC分为R-藻蛋白(R-PC)、别藻蓝蛋白(A-PC)和含有氰基的藻蓝蛋白(C-PC)三类[14]。C-PC是由α、β亚基组成的寡聚蛋白, C-PC的α亚基上含有1个藻青素发色团, β亚基上含有2个藻青素发色团, α亚基、β亚基的分子量分别为18 kDa和20 kDa[15]。研究[16]表明, C-PC具有促进创面愈合、抗氧化以及抗肿瘤等生物活性。因此,本研究将CPC引入LP纳米片体系中, LP纳米片表面部分残留的儿茶酚基团可与CPC形成物理交联的纳米复合水凝胶。研究表明,LP纳米片的质量浓度会影响纳米复合水凝胶的凝胶化性能,当LP含量为3%, CPC含量为0.5%时,凝胶化性能逐渐变好,即能够形成稳定的凝胶; 基于对CPC/LP可注射纳米复合水凝胶凝胶化性能的研究,继续对其流变性能进行研究,应变扫描和频率扫描结果表明CPC/LP纳米复合水凝胶具有自修复性能; 随着剪切速率的增大, CPC/LP纳米复合水凝胶的黏度逐渐减小,表明其具有剪切变稀性能,因此制备的纳米复合水凝胶可任意塑形,很容易从注射器针头挤出; 通过将不同质量浓度的CPC/LP纳米复合水凝胶与红细胞进行共孵育的方式评价其体外血液相容性,证实了CPC/LP纳米复合水凝胶具有良好的血液相容性,采用浸提液与L929细胞共培养的方式证明纳米复合水凝胶具有良好的细胞相容性,且能够有效促进创面的闭合。
综上所述,本研究采用纳米黏土分散液弱碱性含氧环境预聚合多巴胺单体形成LP聚集体,并将其与多功能CPC混合,通过氢键、离子键以及席夫碱等可逆键形成可注射纳米复合水凝胶。形成的纳米复合水凝胶具有良好的可注射性能、自愈合性能以及生物相容性。此外,可注射水凝胶能够通过较小的针头注射到损伤部位,可有效促进创面的闭合。
