肥厚型心肌病关键基因的鉴定及铁死亡机制
2023-12-19巴文强李梦媛
巴文强,李 艳,李梦媛
(1.吉安市中心人民医院药剂科,江西 吉安 343000;2.吉安市第三人民医院心理科,江西 吉安 343000;3.南京医科大学第二附属医院药学部,江苏 南京 210011)
肥厚型心肌病(HCM)是以心肌肥厚为主要特点,严重患者可能会并发房颤、心力衰竭及心源性猝死等。HCM的病因多种多样,最常见的是肌节蛋白基因突变[1-2]。然而,其相关致病基因未完全阐明,且缺乏有效的治疗方法。因此,鉴定HCM发生发展过程中的关键基因可能有助于揭示其致病机制和发现特异性治疗靶点,对其诊断和治疗具有重要意义。此外,铁死亡是一种非凋亡形式的细胞死亡,已被证实与多种类型心肌病的发生发展有关,但其对于HCM的确切作用仍未明确[3]。因此,本研究旨在通过生物信息学方法,识别HCM的关键基因,探索其发病机制与铁死亡机制,为该病的诊断和治疗提供新思路。
1 资料与方法
1.1数据收集:以“hypertrophic cardiomyopathy”为关键词在GEO(http://www.ncbi.nlm.nih.gov/geo)数据库中检索HCM样本的基因表达芯片。纳入标准:①数据样本来自人类心脏组织;②数据样本应包括HCM患者和健康对照;③HCM组和对照组数据样本数均大于3例。排除标准:患者参加过药物或其他治疗的临床试验。经过筛选,最终在507个相关数据集中选择下载GSE36961和GSE32453数据集。其中GSE36961数据集,平台号为GPL15389 Illumina HumanHT-12 V3.0 expression beadchip,包含HCM组患者106例,对照组39例;GSE32453数据集,平台号为GPL6104 Illumina humanRef-8 v2.0 expression beadchip,包含HCM组患者8例,对照组5例。
1.2差异表达基因(DEGs)的筛选:GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/)是一个基于GEOquery和Limma R包的交互式网络工具,可以比较GEO系列中的两组或多组样本,以识别在不同实验条件下表达差异的基因。利用GEO2R筛选DEGs,筛选参数标准为P<0.05,|Log2(Fold change)|>0.6。利用Venny 2.1在线工具(http://bioinfogp.cnb.csic.es/tools/venny/)获得GSE36961和GSE32453数据集的共同DEGs。
1.3富集分析:将共同DEGs上传至Metascape数据库(https://metascape.org/)进行基因本体(GO)和京都基因与基因组百科全书(KEGG)通路富集分析。基中GO富集包括生物过程(BP)、细胞组成(CC)及分子功能(MF)。物种设定为“Homo sapiens”,P<0.05。富集结果通过微生信网站(http://www.bioinformatics.com.cn/)进行可视化。
1.4蛋白质-蛋白质相互作用(PPI)网络的构建:将共同DEGs上传至STRING11.5平台(https://string-db.org/),设定置信度大于0.9,选择物种为“Homo sapiens”,获得PPI数据。将数据导入Cytoscape 3.7.2软件进行可视化处理,使用CytoHubba插件的Degree、DMNC、MCC、MNC、Radiality算法筛选关键基因。
1.5验证关键基因在HCM中的表达:使用GSE1145数据集(平台号为GPL570 [HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array,包含HCM组患者5例,对照组11例)验证关键基因在HCM中的表达水平,两组数据比较采用t检验,P<0.05为差异有统计学意义。
1.6受试者工作特征(ROC)曲线分析:绘制关键基因的ROC曲线,比较关键基因在HCM中的诊断效能。ROC曲线的曲线下面积(AUC)在0.5~1。AUC越接近于1,说明诊断效果越好。其中,AUC在0.9以上有较高的准确性,在0.7~0.9区间有一定准确性,在0.5~0.7区间有较低准确性[4]。
1.7铁死亡调控基因获取及其与HCM共同DEGs综合分析:以“ferroptosis”为关键词,在Genecards(https://www.genecards.org/)和FerrDb(http://www.zhounan.org/ferrdb/current/)数据库中查询与铁死亡相关的基因。其中FerrDb数据库下载铁死亡过程的标记基因、驱动基因和抑制基因。利用Venny 2.1在线工具将铁死亡相关基因与HCM共同DEGs进行映射,得到铁死亡调控HCM的基因。将这些基因上传至Metascape数据库进行KEGG通路富集分析,并用STRING11.5平台构建PPI网络。
2 结果
2.1DEGs筛选:利用GEO2R工具筛选DEGs,GSE36961数据集中共鉴定出600个DEGs,其中上调基因228个,下调基因372个,见图1(A);GSE32453数据集中共鉴定出987个DEGs,其中上调基因518个,下调基因469个,见图1(B)。
2.2共同DEGs的获取:将GSE36961和GSE32453数据集鉴定出的DEGs上传至Venny 2.1网站,得到共同DEGs。其中得到共同上调基因67个及共同下调基因69个,共计136个共同DEGs。见图2。
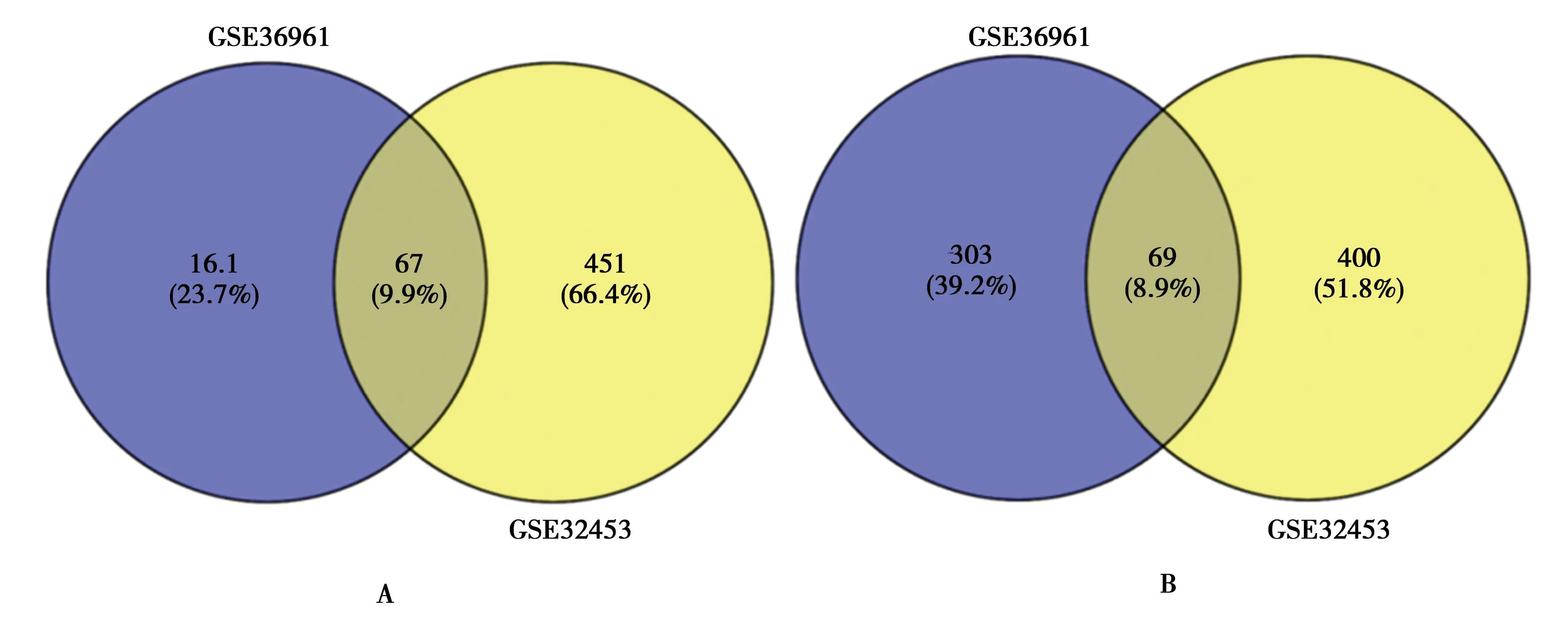
注:A:上调基因;B:下调基因
2.3富集分析:GO富集分析结果见图3(A)。其中BP主要涉及系统过程的调节、细胞丝裂原活化蛋白激酶级联调控、肌肉肥大等,CC主要是肌动蛋白细胞骨架、黏着斑、肌小节等,MF富集最多为G蛋白偶联受体结合、钙离子结合、磷脂酰肌醇3-激酶结合等。KEGG富集分析结果见图3(B),得到的生物学信号主要为流体剪切应力和动脉粥样硬化、脂质与动脉粥样硬化和糖尿病并发症中的晚期糖基化终产物及其受体信号通路等。
2.4PPI网络的构建及关键基因筛选:运用STRING11.5数据库构建PPI网络,使用Cytoscape 3.7.2进行可视化。PPI网络及CytoHubba插件5种算法的可视化见图4。将5种算法得到的前10位基因的交集作为关键基因,最终得到4个关键基因:Fos原癌基因(FOS)、趋化因子配体2(CCL2)、CCAAT增强子结合蛋白Delta(CEBPD)和Pim-1原癌基因(PIM1)见图5。

图4 PPI网络图

图5 5种算法前10位基因交集韦恩图
2.5验证关键基因在HCM中的表达:提取4个关键基因在GSE1145数据集HCM组和对照组中的表达量并进行可视化分析,见图6,其中CCL2、CEBPD和PIM1在HCM中表达下调且具有统计学意义(均P<0.05),而FOS在HCM中的表达与对照相比较差异无统计学意义(P=0.27)。
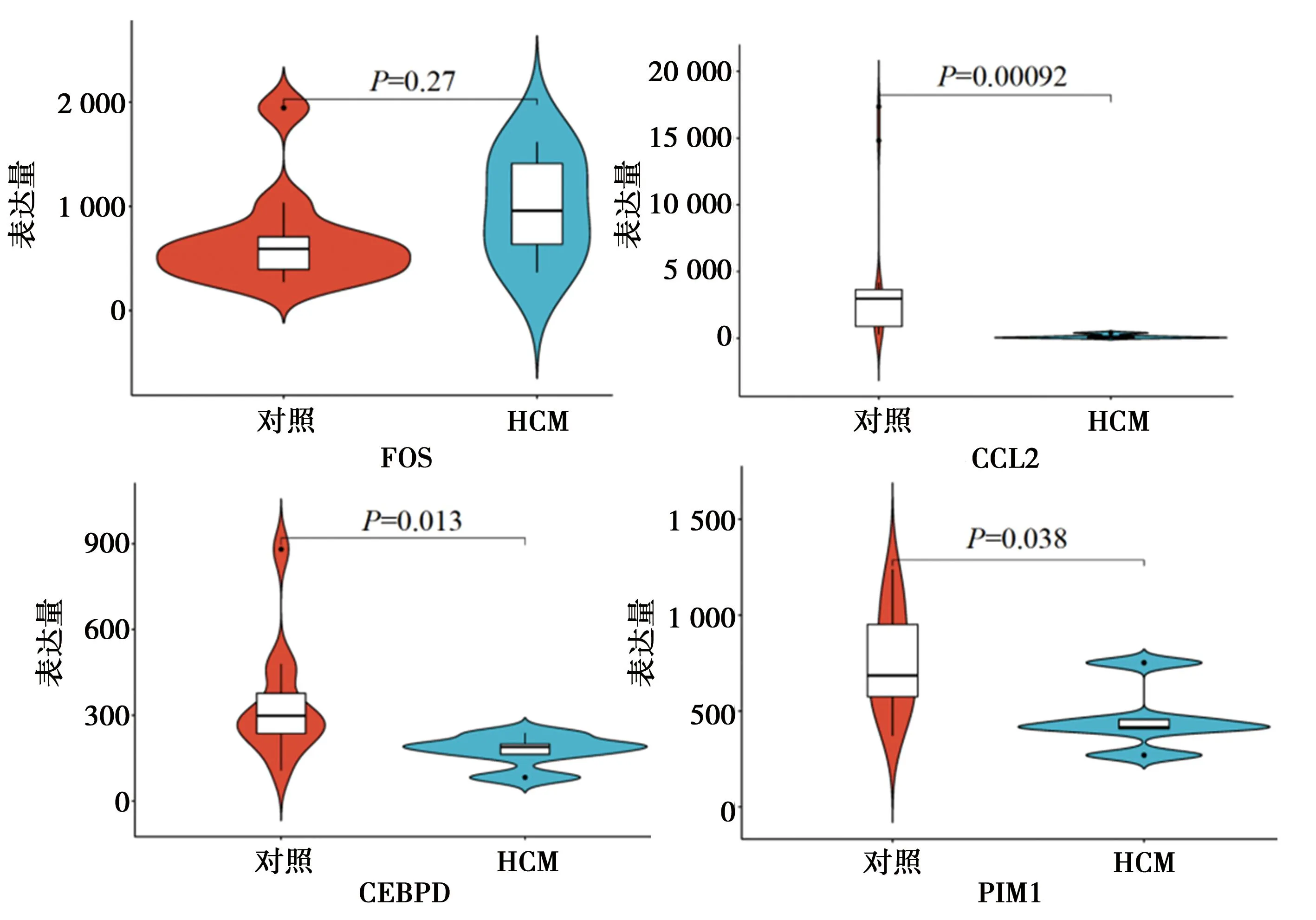
图6 4个关键基因在对照和HCM中的表达差异小提琴图
2.6ROC曲线分析:用ROC曲线的AUC值比较4个关键基因在HCM中的诊断效能,结果见图7。CCL2对HCM的诊断有较高的准确性(AUC为0.982),CEBPD和PIM1对HCM的诊断有一定的准确性(AUC在0.7~0.9区间)。

图7 4个关键基因的ROC曲线
2.7铁死亡调控基因获取及其与HCM共同DEGs综合分析:在FerrDb和Genecards数据库中查询得到铁死亡相关基因共959个,将这959个基因与上述136个共同DEGs进行映射,得到10个与HCM相关的铁死亡调控基因(图8)。对这10个基因绘制PPI网络(图9)并进行KEGG通路富集分析,共得到流体剪切应力和动脉粥样硬化、铁死亡等6条信号通路(图10)。
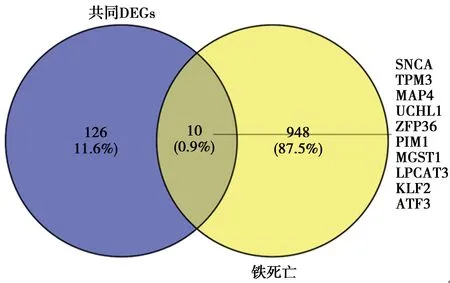
图8 铁死亡调控基因与共同DEGs的韦恩图
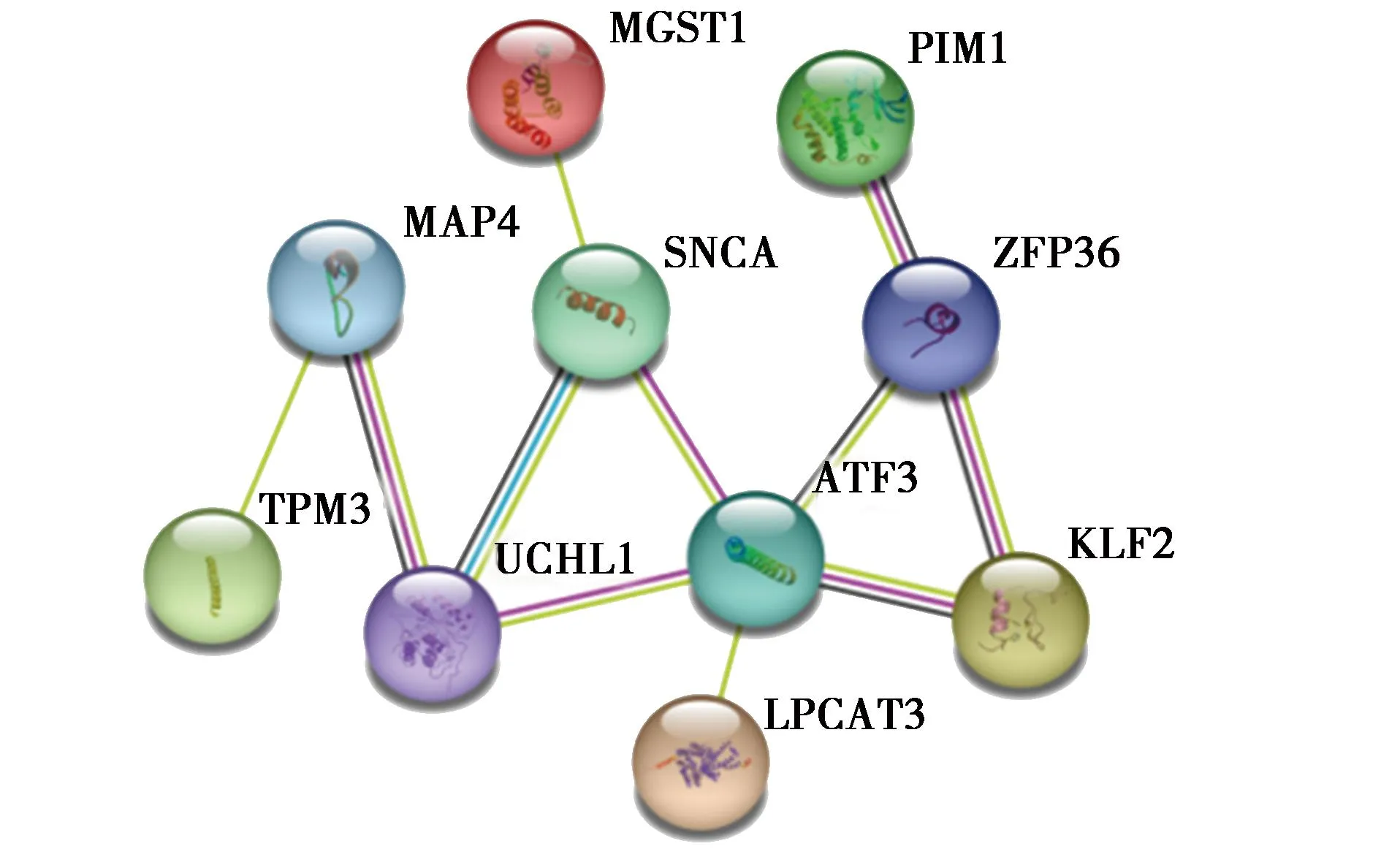
图9 PPI网络图
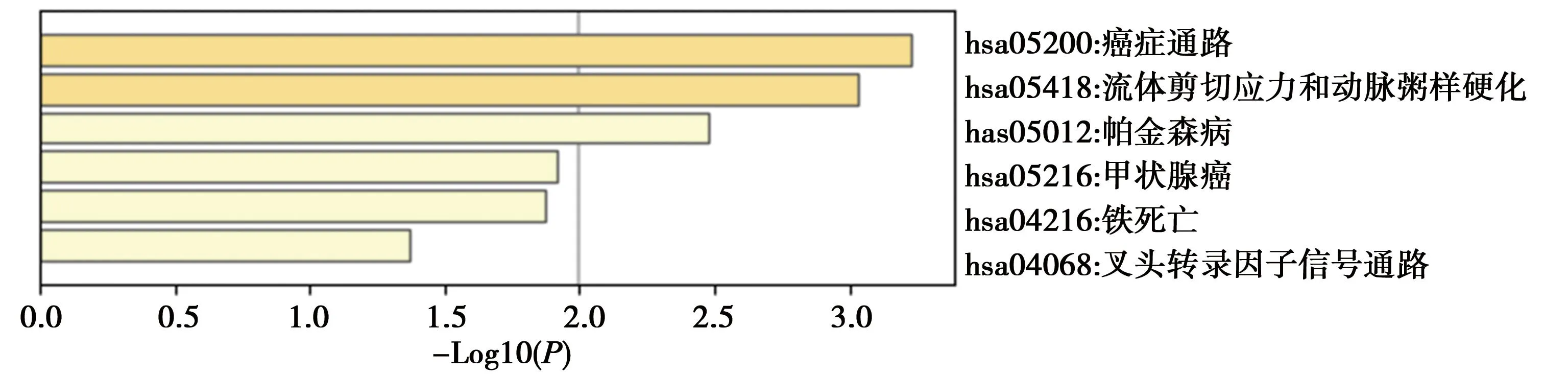
图10 HCM相关铁死亡调控基因的KEGG富集分析
3 讨论
HCM是一种常染色体显性遗传病,是目前国内外引起青少年及运动员猝死的主要原因。HCM在全球普通人群中的患病率至少为0.2%,中国成年人HCM患病率为80/10万[1,5],值得引起重视。引起HCM的病因多种多样,过往研究证实有超过29个基因的1 500余种突变可导致HCM,其中40%~60%是由编码肌小节结构蛋白的基因突变所致[1-2]。然而,HCM的具体发病机制还有待进一步确定。
利用生物信息学方法鉴定疾病突变的关键基因和探究发病机制是目前研究的热点。本研究通过GEO数据库下载与HCM相关的GSE36961和GSE32453数据集,筛选得到136个共同DEGs,KEGG富集分析显示主要信号通路为:流体剪切应力和动脉粥样硬化、脂质与动脉粥样硬化和糖尿病并发症中的晚期糖基化终产物及其受体信号通路等,PPI网络共鉴定出4个关键基因:FOS、CCL2、CEBPD、PIM1,基中CCL2、CEBPD、PIM1基因表达量在GSE1145数据集中得到了验证。
CCL2又称MCP-1,其主要功能是特异性趋化单核/巨噬细胞、T淋巴细胞,可引起心肌的纤维化及血管壁平滑肌细胞增殖,其通过趋化作用和对整合素的活化促进炎性反应细胞的迁移,参与机体炎性反应的发生和维持[6-7]。在心脏损伤和肥厚性重构的过程中,心肌炎性反应的发生会诱导心肌病理性肥大和心肌纤维化,最终导致心肌细胞死亡的不良结局[8]。MCP-1作为促炎性因子,还会损伤血管内皮细胞,降低一氧化氮活性,发生血管痉挛;同时发挥趋化作用,诱导循环和组织中的巨噬细胞在受损血管中浸润,分泌细胞因子,促进平滑肌细胞增殖和迁移,加快血管斑块的形成[9]。本研究发现CCL2在HCM中表达下调,且对HCM有较高的诊断效能,因此认为CCL2可能是HCM发病机制中的关键基因。
CEBPD是一种无内含子基因,编码属于CEBP家族的269个氨基酸的蛋白质,一种被认为参与细胞分化、代谢和免疫应答反应的转录因子。过往研究表明,CEBPD在炎性反应刺激反应中起着关键作用[10],而心肌病理性肥大的发生与炎性反应信号因子的释放和免疫细胞的激活有关[11]。本研究发现CEBPD在HCM患者的心肌组织中表达下调,且对HCM有一定的诊断效能,因此认为CEBPD可能是HCM发展过程中的关键基因。
HCM患者与正常患者相比血流动力学会发生显著变化,这导致层流切应力也会相应的改变。有研究发现,层流切应力会显著上调PIM1的表达,而PIM1对6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶3(PFKFB3)存在负调控作用,同时PFKFB3作为内皮细胞糖酵解途径的关键酶,因此认为PIM1可能通过PFKFB3信号分子在层流切应力调节内皮细胞糖酵解中发挥重要作用[12]。既往研究表明,在心肌病理性肥大的发展过程中,心肌细胞减少了葡萄糖的氧化,增加了糖酵解和其他形式的代谢[13],这种细胞代谢方式的转变直接诱导或促进了心肌病理性肥大的发生[14]。而线粒体功能障碍是这一过程公认的潜在机制[15-16]。同时,PIM1在维持心肌细胞线粒体稳态中也起着关键作用[17]。结合本研究发现PIM1在HCM患者的心肌组织中表达下调,且对HCM有一定的诊断效能,因此认为PIM1可能是HCM发展过程中的关键基因。
本研究进一步分析了HCM可能的铁死亡机制,得到活化转录因子 3(ATF3)、溶血磷脂酰胆碱酰基转移酶3(LPCAT3)和PIM1等10个与HCM相关的铁死亡调控基因,对这10个基因进行KEGG通路富集分析,共得到流体剪切应力和动脉粥样硬化、铁死亡等信号通路。ATF3是ATF/CREB转录因子家族中的一员,是一个已知的氧化应激反应基因。研究发现,ATF3通过负调控MEK-ERK1/2和JNK通路在心肌肥厚的发生发展过程中发挥关键作用[18]。跨膜蛋白转运载体家族7成员11(SLC7A11)是铁死亡通路中的关键基因,通过参与还原型谷胱甘肽合成、脂质过氧化物的氧化还原调控铁死亡[19]。内源性谷胱甘肽的生物合成依赖于谷氨酸/胱氨酸反向转运体(system Xc-)系统,其由SLC7A11和单通道跨膜调控蛋白家族3成员2(SLC3A2)组成,system Xc-系统可通过1∶1交换谷氨酸和胱氨酸来调节铁死亡[20]。研究表明,ATF3可抑制system Xc-系统,并通过抑制SLC7A11的表达使细胞更易发生铁死亡[21]。多不饱和脂肪酸易受脂质过氧化影响,是发生铁死亡的必要条件。LPCAT3参与细胞膜中多不饱和脂肪酸的生物合成和重塑,在氧化应激状态下,细胞可激活LPCAT3诱导脂质过氧化反应。当多不饱和脂肪酸被催化生成脂质过氧化物,会进一步破坏细胞形态及功能,如细胞膜缺陷及线粒体收缩功能障碍,最终诱发铁死亡[22]。
铁死亡是近年来发现的一种铁依赖的、非凋亡形式的调节性细胞死亡,其在心肌病的发生发展中扮演着重要角色。目前对于心肌病状态下铁代谢紊乱及铁死亡的探索和认识仍处于起步阶段。本研究筛选出了10个铁死亡相关基因及信号通路,然而这些铁死亡基因的确切机制和相关信号通路仍不明确,在后续研究中应对铁死亡基因在HCM发展过程中的生物学功能进行细胞学实验验证。
