原花青素脂质体的制备及其理化性质研究
2023-12-18田艳杰石爱民强1刘红芝1蕾1
田艳杰, 石爱民, 刘 哲, 王 强1,, 刘红芝1,, 代 蕾1,
(青岛农业大学食品科学与工程学院1,青岛 266109)
(中国农业科学院农产品加工研究所;农业农村部农产品加工综合性重点实验室2,北京 100193)
(青岛特种食品研究院3,青岛 266109)
原花青素又称缩合单宁,是由黄烷-3-醇单体缩合形成不同聚合度的黄酮类化合物,广泛存在于葡萄籽、蓝莓、花生红衣等植物中,具有抗氧化、抗菌抗炎、抗心血管疾病,抗肿瘤等多种生物活性[1-5]。由于其含有多个酚羟基,研究表明其抗氧化比VC和VE更有效[6],因此常被用做天然的抗氧化剂,应用于食品、药品、化妆品等多方面。但原花青素容易受到光、热、pH等因素的影响,导致其生物利用度比较低,进而影响了其生物活性的发挥,因此研究人员开始利用纳米颗粒[7]、乳液[8]、微胶囊[9,10]、脂质体[11]等进行包埋,以提高原花青素稳定性进而提高其生物利用度。
脂质体是一种由磷脂双分子层结构组成的球形囊泡,具有疏水尾部和亲水头部,可以同时运载亲水性物质和亲脂性物质。脂质体可将亲水分子封装在内部水性内腔中,其粒径在几十纳米到几微米之间,具有生物相容性好、生物利用度高、提高药物稳定性、促进吸收等优点,因此广泛应用于食品、化妆品等行业[12-14]。徐素吟等[15]通过优化脂质体包埋红曲色素,包埋率最高为(49±2.6)%,研究发现包埋后的红曲色素稳定性显著提高;Lee等[16]采用开发了花青素脂质体制剂,对比发现通过脂质体可以增强花青素的皮肤渗透性且可以保持较高的抗氧化活性。脂质体对不稳定的色素具有一定的保护作用且效果较为明显,因此被广泛研究。
目前研究的原花青素脂质体过程中多使用乙醚等有机试剂或添加合成小分子乳化剂,会对人体产生一定危害。本研究优点在于没有使用乙醚和乳化剂制备原花青素脂质体,通过脂质体增加原花青素的稳定性,进而提高其生物利用度。通过对原花青素脂质体制备工艺参数进行优化,以包封率为研究指标,得到最优制备参数,通过粒径、透射电子显微镜(TEM)和傅里叶红外光谱等对脂质体结构及理化性质进行表征,为原花青素脂质体的制备和应用提供依据。
1 材料与方法
1.1 材料与仪器
主要材料:原花青素(纯度>95%)、卵磷脂(磷脂酰胆碱>90%)、胆固醇(纯度>95%)。无水乙醇(分析纯)。
1.2 仪器与设备
EYELA型旋转蒸发仪,KQ-500DE型超声波清洗机,3K-15型高速冷冻离心机,UV-2550型紫外可见分光光度计,Mastersizer-3000 型马尔文粒度仪,JEM-1400型透射电子显微镜。
1.3 实验方法
1.3.1 原花青素脂质体的制备
参考王蕾等[17]略作修改制备原花青素脂质体。称取卵磷脂和胆固醇,加入无水乙醇,待两者溶解,加入一定质量浓度的原花青素溶液,超声,得到均一的乳液,40 ℃去除乙醇,胶态后加入一定量的pH为7的PBS缓冲溶液,蒸发得到水性悬浮液,得到原花青素脂质体粗悬液。超声处理2 min,即得到分散较好的原花青素脂质体。
1.3.2 原花青素脂质体包封率测定
标准曲线的绘制。用PBS缓冲溶液配置1 mg/mL的原花青素,然后进行稀释成梯度浓度的标准溶液,于紫外分光光度计280 nm处测吸光度绘制标准曲线。以不同浓度的原花青素标准溶液为横坐标,以吸光度值A为纵坐标绘制标准曲线,得到浓度(x)与吸光度(y)标准曲线为y=0.014 5x+0.010 8(R2=0.999),表明原花青素质量浓度在20~80 μg/mL线性关系良好。
包封率测定。参考王利媛等[18]方法采用超速离心法测定原花青素脂质体包封率,将原花青素脂质体于4 ℃下,经 12 000 r/min 的高速离心30 min后,取上清液测定脂质体的包封率(W游离)。计算公式如下:
包封率=(W总-W游离)/W总×100%
式中:W总为原花青素脂质体中添加原花青素的总含量;W游离为原花青素脂质体中未包埋的游离原花青素含量。
1.3.3 原花青素脂质体单因素实验
根据1.3.1方法制备原花青素脂质体,考察胆固醇/卵磷脂、原花青素质量浓度(mg/mL)、水相/有机相对包封率的影响。
1.3.3.1 卵磷脂与胆固醇的质量比对质体包封率的影响
固定原花青素质量浓度、有机相/水相为一定值,将卵磷脂与胆固醇的质量比值设定为1∶2、1∶3、1∶4、1∶5、1∶6制备原花青素脂质体,测定不同胆固醇/卵磷脂下的脂质体的包封率。
1.3.3.2 原花青素质量浓度对脂质体包封率的影响
固定胆固醇/卵磷脂、有机相/水相为一定值,将原花青素质量浓度设定为0.25、0.5、1、1.5、2 mg/mL制备原花青素脂质体,测定不同原花青素质量浓度下的脂质体的包封率。
1.3.3.3 水相与有机相的体积比对脂质体包封率的影响
固定胆固醇与卵磷脂的质量比、原花青素质量浓度为一定值,将水相比有机相的体积比设定为1∶2、1∶3、1∶4、1∶5、1∶6制备原花青素脂质体,测定不同水相与有机相的体积比下脂质体的包封率。
1.3.4 原花青素脂质体响应面优化实验
以包封率为响应值,在单因素实验的基础上,基于Box-Behnken响应曲面设计实验方案以卵磷脂与胆固醇的质量比(A)、原花青素质量浓度(B)、有机相与水相的体积比(C)为自变量,以原花青素的包封率为指标,进行三因素三水平下的优化,以确定原花青素脂质体的最佳制备工艺参数,具体如表1所示。

表1 原花青素脂质体响应面试验设计因素与水平
1.3.5 原花青素脂质体理化性质
1.3.5.1 微观结构及粒径
TEM观察:取一滴原花青素脂质体于蜡板上,以铜网带膜的一面蘸取少量,滤纸吸取多余液滴,自然晾干后,体积分数为2%的磷钨酸染色 3 min,重复染色 3 次后,采用透射电镜观察并拍照。
粒径:参考郑景霞等[19]方法研究将原花青素脂质体稀释10倍后,采用马尔文粒度仪测定其粒径分布。测试角度 173°,测试温度为(25±0.1)℃,测试次数为3次。
1.3.5.2 FTIR
参考宋恭帅等[20]方法红外光谱测定采用溴化钾(KBr)压片法,称取适量原花青素、空白脂质体、原花青素脂质体冻干粉与溴化钾粉末混合,在400~4 000 cm-1范围内进行红外扫描。
1.4 数据分析
实验重复3次,使用SPSS 21.0和Design-Expert 8.0.6软件进行数据分析,数据以平均值±标准差表示,使用Origin 2021软件作图。
2 结果与分析
2.1 原花青素脂质体单因素实验
2.1.1 胆固醇/卵磷脂对脂质体包封率的影响
胆固醇的含量会影响原花青素脂质体的包封率,这是由于胆固醇具有调节膜流动性以及稳定性的作用。随着胆固醇/卵磷脂比值的增大,原花青素脂质体包封率逐渐增大,在m胆固醇∶m卵磷脂为1∶4时包封率达到最大,此时包封率为(80.33±1.16)%;比值继续增大时,包封率逐渐下降。大豆卵磷脂含量较低时,双分子层膜不易形成或形成不牢固,不利于原花青素的包封;而卵磷脂含量较高时,脂质体流动性较强且稳定性差,使脂质体容易重新聚集,导致原花青素的泄漏[21]。
2.1.2 原花青素质量浓度对脂质体包封率的影响
考察原花青素质量浓度对脂质体包封率的影响,结果如图1a所示。包封率随原花青素浓度的增加呈现先增加后降低的趋势,在质量浓度为1.5 mg/mL时包封率达到最大,为(89.55±0.62)%。分析原因可能是脂质体的内部囊泡空间是有一定限度的,当原花青素质量浓度较高时超过脂质体的包埋限度,出现原花青素过量现象,导致其包封率的减小[22]。
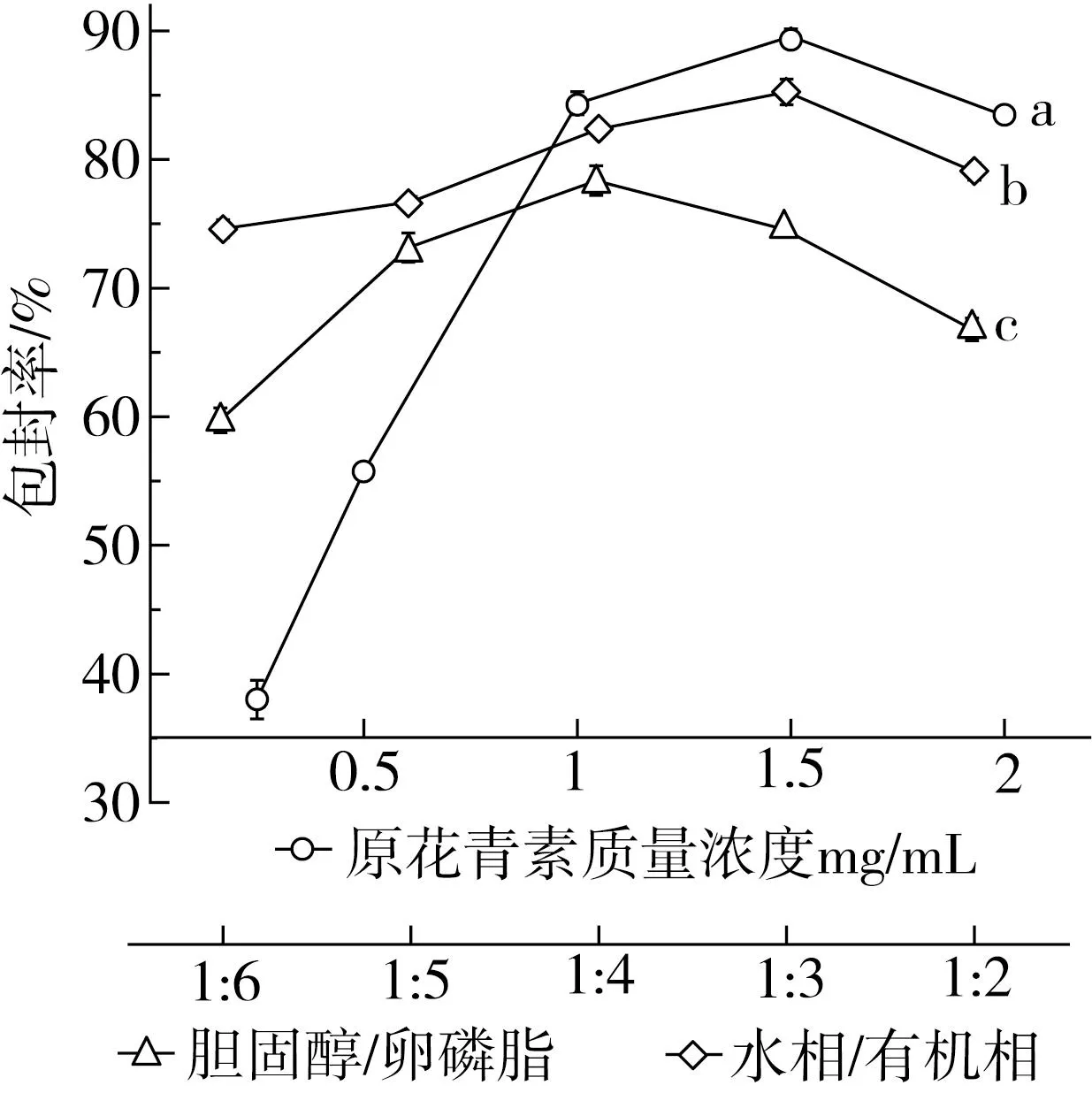
图1 各因素对原花青素脂质体包封率的影响
2.1.3 水相/有机相对脂质体包封率的影响
考察了水相/有机相对脂质体包封率的影响,结果如图1b所示。包封率随水相/有机相体积比值的变化呈现先增加后减小的趋势,当水相与有机相体积比值为1∶3时,包封率出现最大值。分析原因可能是当水相较高时,不能将膜材溶解完全,无法形成稳定的乳液,容易使原花青素泄漏;水相较低时,不利于脂质体双分子层膜结构的形成,导致原花青素包埋量降低[23]。
2.2 原花青素脂质体响应面优化实验分析
基于单因素实验进行Box-Behnken实验,研究卵磷脂与胆固醇的质量比、原花青素质量浓度、有机相与水相的体积比两两交互作用对原花青素脂质体包封率的影响,以确定最佳制备工艺参数(见表2)。
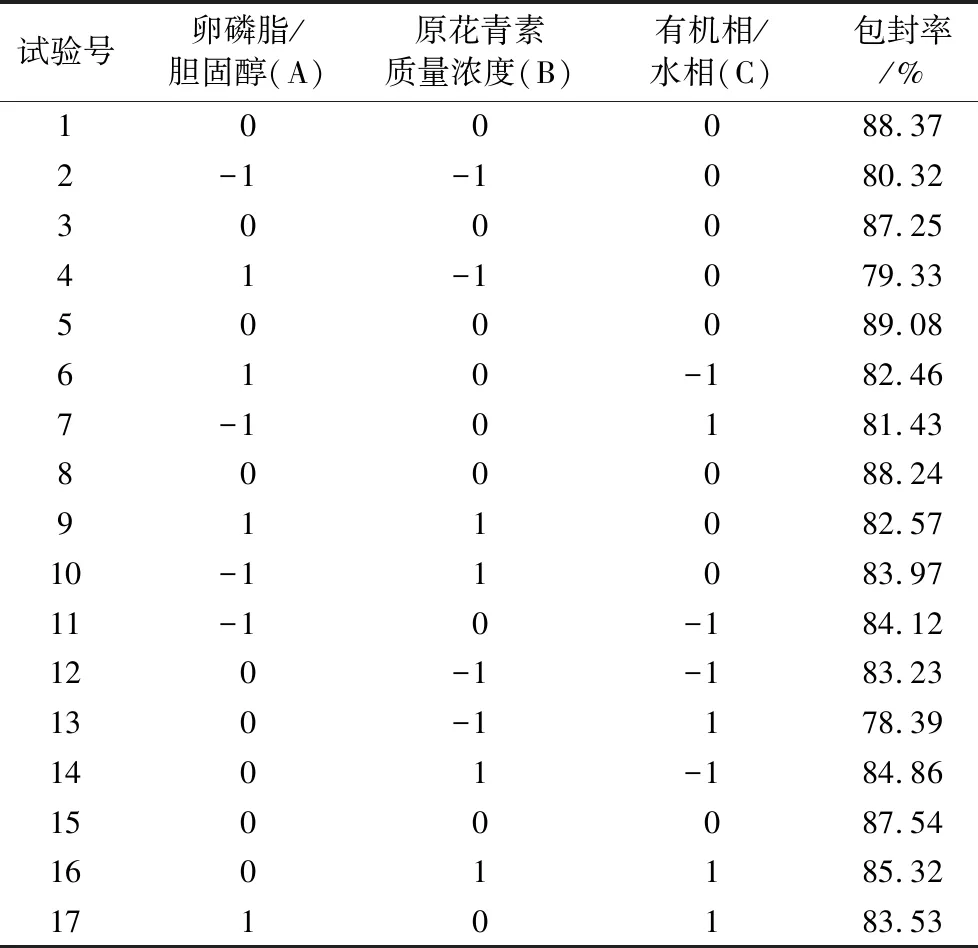
表2 三因素三水平Box-Behnken设计实验与结果
采用Design-expert软件对数据进行多元回归拟合,包封率(y)对A因素(x1)、B因素(x2)、C因素(x3)的二次多元回归方程为:y=88.10+1.93x2-0.75x3+0.94x1x3+1.32x2x3-3.31x12- 3.24x22-1.90x32。由方差分析可知,包封率与3个因素之间的线性关系明显,拟合模型F值为28.79,该模型回归显著(P=0.000 1<0.01),表明模型极显著;矢拟项检验F值为1.47,矢拟项不显著(P=0.349 5>0.05);该模型R2=0.973 7,说明模型能够解释97.37%,响应值Rd=0.939 9,表明该模型拟合效果良好,自变量与包封率之间线性关系显著,可用于包封率的理论预测。模型变量中原花青素质量浓度(因素B)对包封率的影响表现为极显著(P<0.01),有机相与水相体积比表现为显著(P<0.05),3个因素对包封率的影响大小为:原花青素的浓度(因素B)>有机相/水相(因素C)>卵磷脂/胆固醇(因素A)。
根据二次回归方程拟合结果,固定一个因素水平分析其他两个因素的交互作用[24]。交互作用的强弱可以用等高线的形状来判断,等高线为圆形时说明两种因素交互作用不显著,为椭圆形时交互作用显著。结合表3方差分析,卵磷脂/胆固醇与原花青素质量浓度交互作用对包封率的影响不显著,卵磷脂/胆固醇与有机相/水相,原花青素质量浓度与有机相/水相的交互作用对包封率的影响显著,其中原花青素的浓度与有机相/水相的交互作用对包封率的影响更大。

表3 包封率的回归模型方差分析
验证实验:通过Design-expert软件进行分析得到最佳工艺条件:卵磷脂与胆固醇的质量比为3.94、原花青素质量浓度为1.64 mg/mL、水相与有机相体积比2.88。在最优工艺条件下制得的原花青素脂质体包封率为(89.18±0.40)%,包封率较高,与理论值88.412%较为接近,表明模型的预测效果良好,适用于原花青素脂质体制备工艺参数的优化。
2.3 原花青素脂质体的表征
2.3.1 微观结构
原花青素脂质体肉眼观察为粉色悬浮液,形态均一。透射电子显微镜观察结果如图2所示,原花青素脂质体呈圆形或椭圆形微球体,表面较为圆整,颗粒之间的尺寸接近,大小较为均匀。透射电镜下观察可以观察到原花青素脂质体具有磷脂双分子层结构,原花青素在透射电镜中呈深黑色,可见原花青素嵌插或包封在纳米脂质体双分子层膜中,这与陈琼玲[25]的研究一致。如图3所示,采用马尔文粒度仪测得原花青素脂质体平均粒径为(190.14±8.23)nm,多分散性指数PDI结果显示,PDI为0.45±0.05,透射电子显微镜显示脂质体粒径与马尔文粒度仪测量结果一致。
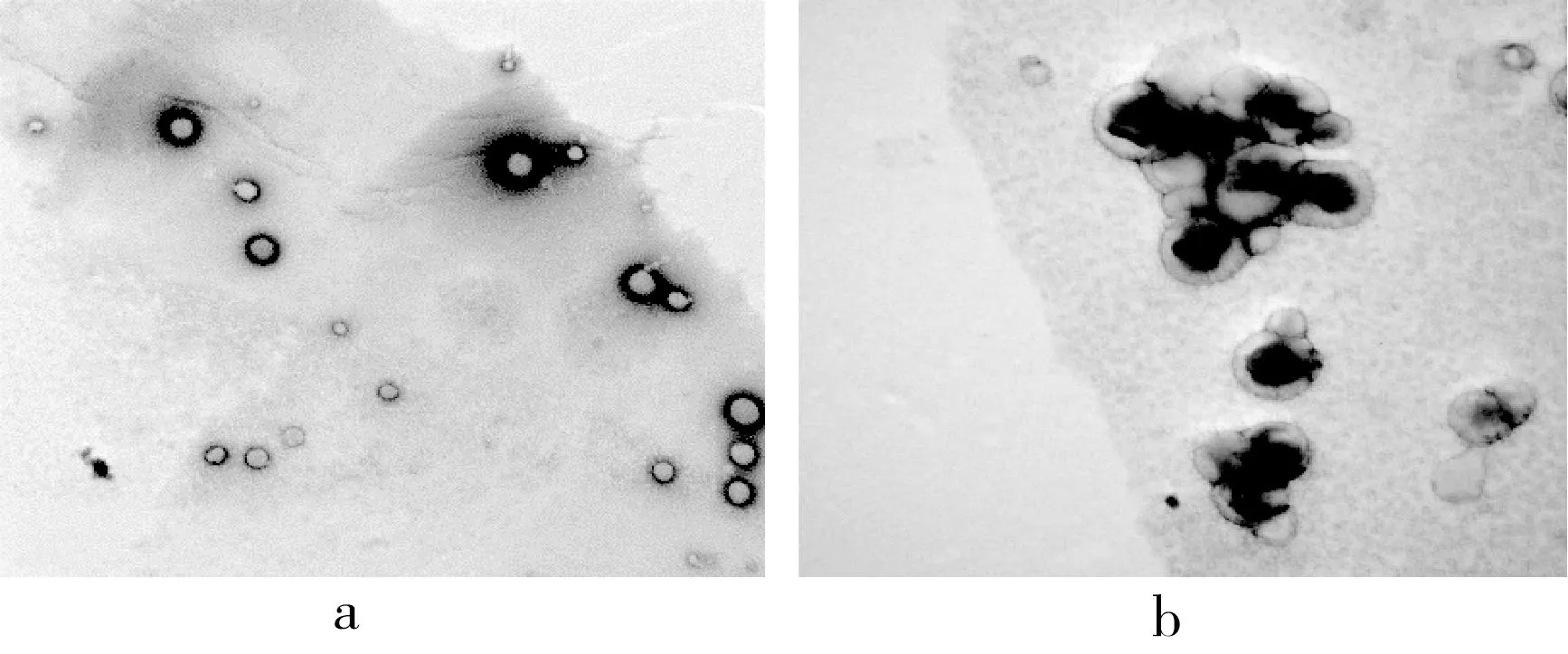
图2 原花青素脂质体及透射电镜图

图3 原花青素脂质体粒径
2.3.2 FTIR
采用傅里叶变换红外色谱测定原花青素、空白脂质体和原花青素脂质体的结构,通过分析和对比样品之间的变化,进一步确定脂质体对原花青素的包埋作用。原花青素、空白脂质体和原花青素脂质体的 FTIR 图谱如图4所示,原花青素在1 610、1 518、1 442、1 365、1 205、1 143、1 111、1 064 cm-1处显示吸收带,这些吸收带分别是CC 伸缩振动(芳香环)、C—H 伸缩振动(烷烃)、—C—O 伸缩振动(醇类)、C—O—C伸缩振动(醚)。在原花青素脂质体的图谱中,包埋前后发发现原花青素的一些吸收峰消失,分析原因可能是脂质体与原花青素之间通过氢键、范德华力等相互作用导致特征峰消失,而特征峰减弱以及位移表明脂质体对原花青素的包埋作用,以至于原花青素的某些特征峰消失[26]。

图4 原花青素脂质体红外光谱图
3 结论
原花青素具有多种生物活性,但存在稳定性差,生物利用度低等缺点,因此通过脂质体进行包埋,提高其生物利用度。以包封率为评价指标进行工艺参数的优化,当卵磷脂与胆固醇的比为3.94、原花青素质量浓度为1.64 mg/mL、水相与有机相体积比为2.88时,此时原花青素脂质体的包封率为(89.18±0.40)%,具有较高的包封率;通过透射电镜观察脂质体成球形,粒径在(190.14±8.23)nm,FTIR结果显示脂质体成功将原花青素包埋,为原花青素在食品领域的开发和利用提供参考。
