超声调控蛋白酶活性及对豌豆蛋白酶解的影响
2023-12-18孙晓洋陈复生张丽芬
陈 妍, 孙晓洋, 陈复生, 张丽芬
(河南工业大学粮油食品学院1,郑州 450001)
(河南牧业经济学院食品与生物工程学院2,郑州 450046)
豌豆是世界上重要的豆科植物之一,富含淀粉和蛋白质。作为豌豆的副产品,豌豆蛋白具有良好的氨基酸平衡性和丰富的赖氨酸,是一种宝贵的蛋白质来源。近年来,由于食品行业和消费者对低致敏性、植物性食品和环境可持续性的认识不断提高[1],豌豆蛋白的开发利用得到极大发展。豌豆蛋白在食品中的应用取决于其溶解性、乳化性和起泡性等功能特性[2],但由于其品种和生产方法的差异性以及加工过程中热、机械和酸碱等因素均可降低豌豆蛋白功能特性和营养价值,导致其在食品工业中应用程度较低。因此,对豌豆蛋白进行改性处理可改善其利用性能[3]。
蛋白质改性是改善其功能特性和营养价值的有效途径[4]。物理和酶法因条件温和、操作简单、环境友好、副反应少等优点,且酶法改性反应专一性强,成为了研究者们常用的蛋白质改性手段[5]。研究表明,豌豆蛋白是生产生物活性肽的良好来源,通过酶法改性可以从中得到具有促进健康的生物活性肽,例如抗高血压肽、抗糖尿病肽以及抗氧化肽等,同时其水解产物还具备了与大豆蛋白相似的功能特性,如乳化性、起泡性等,具有极高的商用价值[6]。
碱性蛋白酶因在碱性pH下具有较强活性和稳定性而备受关注,研究表明通过碱性蛋白酶水解蛋白质可以得到具有高营养价值、血管紧张素转换酶抑制活性和抗氧化性的水解产物[7,8]。但是,传统酶解工艺存在反应缓慢、酶利用率低、底物转化率低,以及搅拌不均匀等问题,从而导致底物与酶接触时间短、酶活性降低、蛋白质聚集和结构不规则等[9]。针对这些问题,寻求能够提高酶活性、稳定性以及酶解效率的方法成为了研究焦点。超声波因具有效率高、操作简单、经济可行性等优点,作为一种非热物理技术在食品工业中的应用也越来越受到重视。利用超声波的空化效应可以将固体颗粒分散成较小尺寸颗粒,并且低强度的超声作用可以使酶的活性增强,为提高酶解过程的整体效率提供了可能。例如研究者利用超声波提高了碱性蛋白酶的α-螺旋结构和表面色氨酸含量,使得其结构发生有利改变继而促使其酶活力增强[10]。同时有研究表明,短时间低频超声可提高纤维素酶活性,最大程度地提高了乙醇生产率[11]。超声能够在不改变酶结构完整性的情况下,使酶分子发生有利的构象变化,进而促进酶与底物之间的相互作用[12]。利用超声调控酶制剂构象以及酶催化环境进而可以定向酶解蛋白质从而得到理想的目标产物。因此,物理和酶法进行联合使用可以有效地提高传质速度从而加快酶解反应的进行[13]。
研究将超声和酶法联合酶解豌豆蛋白制备其酶解产物以改善蛋白的功能特性。首先探讨了超声对碱性蛋白酶酶活的影响机制,在此基础上,明确了超声调控酶法对豌豆蛋白酶解产物的乳化特性和抗氧化活性的影响规律,结合综合评价获得超声调控酶法制备豌豆蛋白酶解产物的最优工艺参数,并建立超声调控酶法制备豌豆蛋白酶解产物技术。
1 材料与方法
1.1 材料与试剂
豌豆蛋白;氢氧化钠、盐酸、十二水合磷酸二氢钠、十二水合磷酸氢二钠、十二烷基硫酸钠(SDS)、无水乙醇、2,2-联苯基-1-苦基肼基(DPPH)、水合茚三酮、氧化亚锡、三氯乙酸:分析纯;碱性蛋白酶(200 000 U/g)、干酪素、甘氨酸:生物制剂;大豆油:食品级。
1.2 仪器及设备
K1100全自动凯式定氮仪,SCIENTZ-ⅡD超声波细胞粉碎机,DC-2006节能型智能恒温槽,TDL-5-A离心机,LGJ-25 C冷冻干燥机,GL-10 000 C低温冷冻高速离心机,FM 200高剪切分散乳化机,722S可见光分光光度计,TU-1901紫外可见光分光光度计,MOS 450圆二色谱仪,MY17040001荧光分光光度计。
1.3 实验方法
1.3.1 豌豆蛋白基本成分测定
水分含量测定:采用恒重法,按照国家标准GB 5009.3—2016;
脂肪含量测定:采用索氏抽提法,按照国家标准GB 5009.6—2016;
蛋白质含量测定:采用凯氏定氮法,按照国家标准GB 5009.5—2016;
灰分的测定:按照国家标准GB 5009.4—2016。
1.3.2 碱性蛋白酶的超声处理
将碱性蛋白酶(10 mg)用磷酸盐缓冲溶液(pH 8.0)溶解后过滤,使用探头式超声仪进行超声处理,超声脉冲时间设置为开2 s,关2 s。
采用单因素实验设计,考察不同超声参量对碱性蛋白酶的活性影响。单因素实验设计如下:固定超声时间15 min、超声温度45 ℃,设置超声功率密度为1.36、2.04、2.71、3.39、4.07 W/cm3;固定超声功率密度1.36 W/cm3、超声温度45 ℃,超声时间设置为5、10、15、20、25、30 min;固定超声功率密度1.36 W/cm3、超声时间15 min,设置超声温度为30、35、40、45、50 ℃。
1.3.3 酶活测定
参照GB/T 23527—2009测定蛋白酶活力。将干酪素溶液作为碱性蛋白酶水解底物。用紫外可见分光光度计在275 nm处测量吸光度,用于计算反应所释放的酪氨酸浓度。制作酪氨酸标准曲线,定义蛋白酶活力单位为对应每毫升酶液每分钟水解酪蛋白产生1 μg酪氨酸。酪氨酸标准曲线见式(1):
y=0.007 6x,R2=0.999 8
(1)
1.3.4 动力学参数测定
将碱性蛋白酶于超声功率密度1.36 W/cm3,超声时间15 min,超声温度45 ℃下进行超声处理用于后续动力学参数测定。干酪素溶液作为水解底物,酶活测定方法与1.3.3一致。将酶解反应温度分别控制为30、35、40、45、50 ℃。
根据Kadkhodaee等[14]的方法研究超声处理对碱性蛋白酶动力学参数的影响。酶促水解采用一级反应动力学模型描述,其一级化学反应力学模型见式(2):
ln(C/C0)=-Kt
(2)
反应t时间时酪蛋白的浓度C与酪氨酸的生成量成正比,即后续用酪氨酸生成量的变化来反映水解过程。酪氨酸的生成量为反应完全后酪氨酸的生成量(V∞)减去已经产生的酪氨酸(Vt),即式(3)为:
ln(V∞-Vt)=-Kt+lnV∞
(3)
式中:Vt为在时间t min时酪氨酸的质量浓度/μg/mL;V∞为酪蛋白彻底水解的酪氨酸的质量浓度/μg/mL。
1.3.5 圆二色谱测定
选择在超声功率密度1.36 W/cm3,超声时间15 min,超声温度45 ℃条件下得到的碱性蛋白酶进行圆二色谱测定。参照Yu等[15]的方法,在室温下进行碱性蛋白酶的圆二色谱(CD)扫描。在波长范围(190~250 nm)内,以扫描速度50 nm/min进行扫描。并利用软件分析α-螺旋、β-折叠、β-转角、无规则卷曲含量。用于溶解碱性蛋白酶的磷酸盐缓冲溶液作为样品的空白溶液。
1.3.6 荧光光谱测定
选择在超声功率密度1.36 W/cm3,超声时间15 min,超声温度45 ℃条件下得到的碱性蛋白酶进行荧光光谱测定。参照Yu等[15]的方法,在室温下,于278 nm(激发波长,狭缝=5 nm),300~500 nm(发射波长,狭缝=5 nm)下测量未处理和超声处理样品的荧光发射光谱扫描。用于溶解碱性蛋白酶的磷酸盐缓冲溶液作为样品的空白溶液。
1.3.7 豌豆蛋白的酶解
1.3.7.1 超声调控酶法制备豌豆蛋白酶解产物
将5.00 g豌豆蛋白溶于100 mL 35 mmol/L磷酸盐缓冲溶液中(pH 8.0),加入碱性蛋白酶10 mg后,迅速转移在设定的超声体系下进行水解,超声设置开2 s、关2 s,水解结束后于90 ℃下进行高温灭活15 min。灭酶后将溶液于4 ℃,10 000 r/min下离心30 min,冷冻干燥后于4 ℃储存进行后续性质测定。
在超声调控酶解过程中,采用单因素实验设计,考察不同超声参量对豌豆蛋白酶解产物的乳化特性和抗氧化活性影响。单因素实验设计如下,固定超声时间15 min、超声温度45 ℃,设置超声功率密度为0.68、1.36、2.04、2.71、3.39、4.07 W/cm3;固定超声功率密度2.71 W/cm3、超声温度45 ℃,超声时间设置为5、10、15、20、25、30 min;固定超声功率密度2.71W/cm3,超声时间25 min,设置超声温度为30、35、40、45、50 ℃。
1.3.7.2 水解度的测定
采用茚三酮法进行水解度的测定,参照赵新淮等[16]的方法并进行修改。
配制质量浓度为0.02 g/mL茚三酮溶液备用,并制定甘氨酸标准曲线。甘氨酸标准曲线见式(4):
y=0.004 2x-0.238 9,R2=0.990 6
(4)
样品水解度测定:取水解液1 mL、磷酸盐缓冲液(pH 8.0)1 mL、茚三酮溶液1 mL加入到比色管中,沸水浴加热15 min,冷却后定容至25 mL,于570 nm下测吸光度,以蒸馏水作为空白对照。
水解度计算见式(5):
DH=ρPPH×VPPH×DPPH-ρPP×VPP×DPPm×N×106
(5)
式中:ρPPH和ρPP分别为豌豆蛋白酶解产物(PPH)和豌豆蛋白溶液中游离氨基质量浓度/μg/mL;VPPH和VPP分别为水解液和PP溶液体积/mL;DPPH和DPP分别为水解液和PP溶液稀释倍数;m为原料质量/g;N为原料中氮的质量分数/%。
1.3.7.3 乳化特性测定
参照Dong等[17]的方法并进行修改。将质量浓度10 mg/mL PPH以水相∶油相=3∶1(体积比)比例溶液混合后在13 000 r/min转速下均质2 min。均质结束立即从底部吸取50 μL乳液用10 mL质量浓度1 mg/mL的SDS溶液稀释,混匀后于500 nm测量吸光度。乳液放置30 min后,再次从底部吸取50 μL乳液用10 mL质量浓度1 mg/mL的SDS溶液稀释,混匀后于500 nm测量吸光度。乳化活性(EAI)和乳化稳定性(ESI)的计算如式(6)或式(7):
EAI=2×2.303×A0×NC×φ×10 000×L
(6)
ESI=A0ΔA×Δt
(7)
式中:A0是均质后立即稀释的乳液的吸光度;N是稀释倍数;C是蛋白质质量浓度/g/mL;φ是乳液的油体积分数/%;L为比色皿厚度/cm;ΔA是0 min和30 min的吸光度变化(A0-A30);Δt是时间间隔/min。
1.3.7.4 抗氧化性的测定
参照Evangelho等[18]的方法并进行修改。样品质量浓度设置为5 mg/mL,配制浓度为0.1×10-3mol/L DPPH·溶液,将5 mL样品与5 mL DPPH·溶液混合摇匀,室温下避光反应15 min后于5 000r/min离心15 min。通过测量在517 nm处的吸光度来确定DPPH自由基的减少。
根据式(8)计算样品清除DPPH自由基的能力:
DPPH·清除率=(1-AS8AC8)×100%
(8)
式中:AS是样品的吸光度;AC是对照的吸光度。
1.3.8 数据处理
数据以平均值±标准偏差(SD)表示。利用SPSS26.0和Microsoft Excel 2016对实验数据进行处理分析,并采用ANOVA方差分析进行显著性检验(P<0.05)。
2 结果与分析
2.1 豌豆蛋白的主要成分分析
豌豆蛋白中的水分、蛋白质、脂肪、灰分的质量分数分别为(6.74±0.02)%、(81.23±0.04)%、(0.03±0.01)%、(6.59±0.07)%。
2.2 超声对碱性蛋白酶的酶活影响研究
如图1所示,碱性蛋白酶的酶活随着超声功率密度的增加先增大后减小,在超声功率密度为1.36 W/cm3时,碱性蛋白酶的酶活力达到最高。超声的空化现象是碱性蛋白酶活力随强度变化的原因。超声波可以破坏氢键或范德华力等弱相互作用,从而引起酶的构象变化[19]。低强度超声使体系中存在稳定的空化效应,稳定空化气泡的振荡所产生的力改变了酶的空间构象,使得酶分子暴露更多的活性位点,增强了其与底物的接触,从而提高了酶的活性[20]。

图1 超声对碱性蛋白酶酶活影响
由图1可知,碱性蛋白酶的活性在超声时间为15 min时达到最大,之后随着时间的增加,活性出现减弱的趋势。导致酶失活的机制可能是随着超声时间的增加加剧了空化作用,超声分解水分子获得的自由基以及超声引起的剪切力均会引起酶分子构象的改变和破坏[21-23];此外,由于超声空化作用引起的空化气泡使蛋白质分子暴露在水-空气界面上,扰乱了酶分子周围的氢键、疏水相互作用等,从而使得酶分子构象发生改变[24]。
经过超声处理后,碱性蛋白酶的活性显示在45 ℃时为最适温度。液体体系中的超声波的影响机制主要分为空化和加热2种形式[25]。本实验采用了温控循环水浴消除了超声处理过程中带来的加热效应。可以看出,超声处理能够在合适的温度范围内刺激酶活力,且不影响酶的最佳反应温度。温度的进一步增加会干扰酶的活性以及稳定性,继而出现了酶活力降低的现象。
2.3 超声对碱性蛋白酶酶促速率常数的影响研究
速率常数是化学反应动力学的重要参数,由温度、介质和催化剂决定。图2a和图2b分别表示未处理和超声处理的碱性蛋白酶的ln(V∞-Vt)随时间(t)的变化图,在考察的温度范围内,经过不同处理方式的碱性蛋白酶催化蛋白水解均符合一级反应动力学,相关系数≥0.95。从表1中可以看出,随着温度的升高,碱性蛋白酶酶促反应速率常数逐渐增加,主要由于较高温度下底物与酶之间碰撞的频率增加。由图2和表1可知,与对照组相比,超声处理后碱性蛋白酶的速率常数增加,可能是由于超声波产生的空化效应产生的压力、剪切力以及温度等改变了酶分子的结构,导致其更多的活性位点暴露,从而使得酶分子与底物更容易结合,表现出更高的反应能力[10]。

表1 超声对碱性蛋白酶酶促反应速率常数(K)的影响
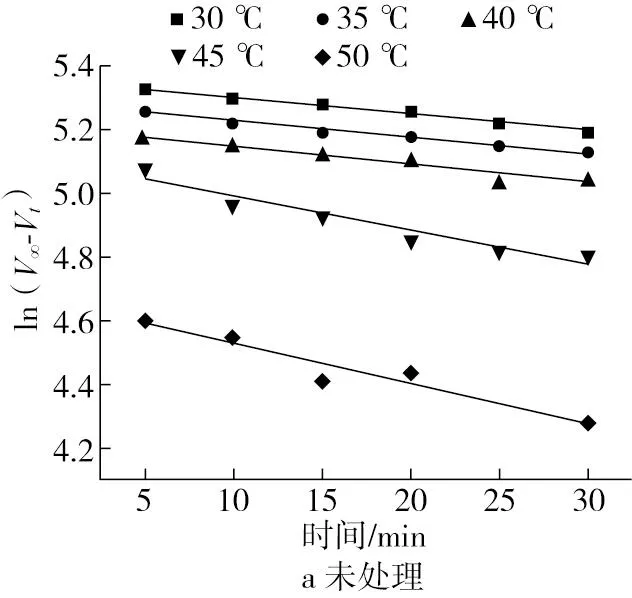
图2 超声对碱性蛋白酶酶促一级反应动力学影响
2.4 超声对碱性蛋白酶结构的影响研究
超声是一种周期性的压力波动,可以动态干扰和控制酶的特性[26]。研究表明,超声波能够扰乱酶的分子结构,从而影响其活性[27]。碱性蛋白酶的活性区域主要在α和β结构域[28],因此,二级结构是影响其活性的关键因素。
超声对碱性蛋白酶二级结构的影响如图3a所示。CD光谱在190~200 nm呈现正带,这是α-螺旋与β-折叠结构所形成的重合峰。碱性蛋白酶多数β-折叠结构的CD光谱在210~220 nm区域显示负带,在190~200 nm区域显示正带,222 nm和208 nm左右的波谷也显示了α-螺旋结构的存在,以及β-折叠结构也在210~220 nm区域出现负峰谱带,205~225 nm区间的谱图是α-螺旋和β-折叠叠加的结果[29]。综合表2中的β-折叠结构的含量百分比可得,超声对碱性蛋白酶β-折叠结构无显著影响。超声后碱性蛋白酶β-转角和α-螺旋结构的相对含量增加,表明经超声处理后碱性蛋白酶的结构变得更加规律,更具有灵活性,酶活性增加且稳定性增强。

表2 超声处理对碱性蛋白酶的二级结构质量分数影响

图3 超声对碱性蛋白酶的结构影响
酶的固有荧光与其芳香族氨基酸残基有关,主要以色氨酸(Trp)为主[30]。超声对碱性蛋白酶荧光光谱特性的影响如图3b所示,超声处理前后碱性蛋白酶的峰值位点没有显著变化,但是峰值强度显著增加。荧光强度的增加,表明超声可以诱导蛋白质的分子去折叠,破坏蛋白质分子的疏水相互作用,更多的Trp残基暴露在外部,从而提高碱性蛋白酶的荧光强度[10]。
2.5 超声调控酶法制备豌豆蛋白酶解产物的工艺研究
2.5.1 超声对豌豆蛋白水解度的影响研究
图4为超声对豌豆蛋白水解度的影响。超声可显著提高PP的水解度。在超声功率密度为1.36W/cm3时,水解度达到最高为16.78%。之后随着超声功率密度的增加,水解度趋于平衡。随着超声时间的增加,PP的水解度增加,持续稳定的空化效应不会对酶结构造成破坏,并且可以有效地改善传质速度。此外随着超声时间的增加,PP固体颗粒的尺寸变小,结构更加松散,与酶结合的位点更多。超声温度为45 ℃时PP水解度达到最大,与超声对酶的影响温度一致。温度的进一步增加并结合超声产生的空化效应,使得局部产生高温,削弱了酶的活力,从而使得水解度降低。

图4 超声对PP水解度的影响
超声加快了酶促反应传质速率。Suslick[31]报道超声的化学效应不是来自与物质的直接相互作用,而是来自空化现象。在空化过程中产生的自由基会加速化学反应,且空化效应形成的局部湍流和液体微循环可增强非均质系统中的传输过程和消除传质阻力[27]。超声的空化效应使得PP在溶液中充分分散,并由于空化效应产生的机械效应将PP分散成更小的颗粒,破坏了蛋白的高级结构和亚单位组成,释放出更多的亲水基团使得蛋白质溶解度增加,并且较为松散的蛋白会暴露出更多的酶结合位点,与酶接触面积增加从而使得水解度增大[32]。同时,超声对酶的活性也有一定影响,低强度短时间的超声处理使酶的二级和三级结构发生有利变化,酶的活性位点暴露更多,也可以增加PP的水解程度。
2.5.2 超声对豌豆蛋白酶解产物乳化特性的影响研究
图5为超声对豌豆蛋白酶解产物的乳化特性的影响。随着超声功率密度、时间和温度的增加,豌豆蛋白酶解产物的乳化活性逐渐增加后趋于稳定。乳化稳定性随超声时间和温度的变化没有显著变化。超声调控酶解制备的豌豆蛋白酶解产物的乳化活性随着超声功率密度的增加显著提升,结合超声对水解度的影响,可能是由于高强度超声使可溶性的多肽团聚体增加,而可溶性团聚体可增强蛋白与水之间的相互作用,使蛋白在油-水界面能够迅速扩散和吸收,蛋白在油水界面的吸附能力显著增强,使豌豆蛋白酶解产物具有更高的乳化活性[33]。此外,超声处理促进了PP分子结构形态从紧密的球形结构转变为松散的球形结构。结合酶水解,超声和酶共同作用打破了蛋白质聚合物中的共价键和肽键,使得蛋白质大分子解聚以及裂解,从而增加蛋白分子的流动性,更有利于它们在油-水界面的吸附和展开[34]。具有较高溶解度和较小分子量的水解产物可以在界面上迅速扩散和吸附,然而,小分子肽由于电荷排斥而不能在界面上展开和重新定向,因此,对乳液稳定性的影响并不显著[35]。
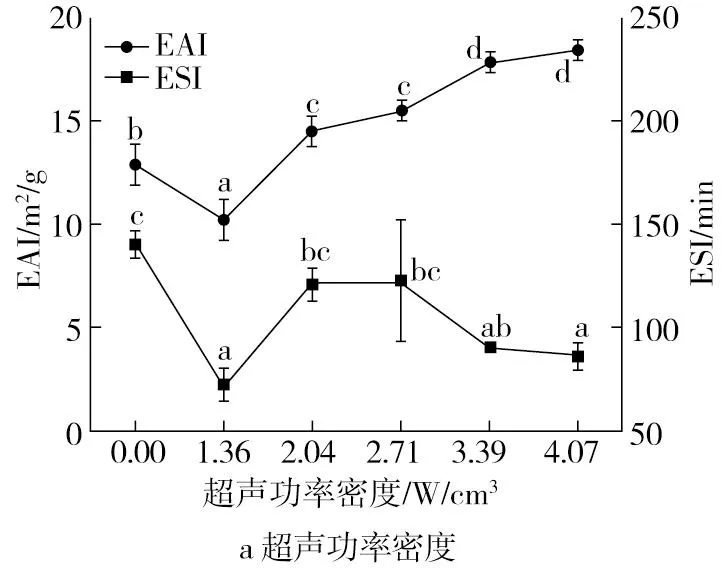
图5 超声对豌豆蛋白酶解产物的乳化特性的影响
2.5.3 超声对豌豆蛋白酶解产物抗氧化活性的影响研究
图6为超声对豌豆蛋白酶解产物的抗氧化活性的影响。图6显示经过超声处理后豌豆蛋白酶解产物的抗氧化能力显著增强,并在超声功率密度为1.36 W/cm3时达到最大,与未经处理的豌豆蛋白酶解产物的抗氧化能力相比提高了32.81%。酶促反应的水解程度对产物抗氧化性能具有影响,较小分子量肽具有较好的抗氧化性,并且酶解和超声共同作用使得蛋白中的疏水性基团暴露,与超声辅助双酶法从牛骨中提取抗氧化肽具有相同的结果[36]。超声时间和温度对豌豆蛋白酶解产物的抗氧化性无显著影响(图6)。酶解产物的抗氧化活性与其分子量分布、氨基酸组成以及疏水性有关。随着超声时间和温度的增加,超声提供了稳定的空化效应,酶解获得的多肽结构可能没有发生显著变化。

图6 超声对豌豆蛋白酶解产物的抗氧化活性的影响
3 超声调控酶解豌豆蛋白机制
超声调控酶解体系中,超声既可以作用于酶分子,同时也对底物产生一定的影响。超声能够使得酶分子的颗粒尺寸减小,增加催化剂表面积,降低传质限制;并且在超声作用下,碱性蛋白酶的构象发生改变导致更多的活性位点暴露,使其易于与豌豆蛋白结合从而更好地裂解多肽链。此外,在超声酶解体系下,豌豆蛋白同时也受到超声的空化作用所影响,超声产生的机械效应破坏了蛋白质分子之间的相互作用力,使得蛋白质团聚体解聚,从而增加了酶与蛋白质分子的接触面积[37]。同时蛋白质分子在空化作用下构象发生改变,从紧密的球型结构变得更加松散,结构展开,更多的官能团暴露[38],使其易于与酶分子结合,加快酶解速率。超声诱导蛋白质的展开,增加了敏感肽键的暴露[9],不仅促进了蛋白质水解,同时也提高了酶解蛋白质产生生物活性肽的效率。超声调控酶解可以有效地调控酶解的程度和酶的作用部位,同时可使酶解产物的疏水链段暴露,增强豌豆蛋白酶解产物的抗氧化活性以及界面性质。因此,探究超声调控酶解反应可为超声在未来食品行业中的应用提供参考。
4 结论
超声能够在合适的范围内提高碱性蛋白酶的酶活力。与对照组相比,超声功率密度1.36 W/cm3、时间15 min、温度45 ℃时,碱性蛋白酶的酶活力提高了22.09%。根据酶促反应动力学结果可知,在30~50 ℃范围内,超声均能显著提高碱性蛋白酶的酶促反应速率常数,提高碱性蛋白酶的酶促反应能力。圆二色谱和荧光光谱分析结果显示,超声使碱性蛋白酶的结构更加规律且更具有灵活性,同时暴露出更多的色氨酸基团。
在碱性蛋白酶的合适超声参考范围内进行超声调控酶解豌豆蛋白,利用熵值法综合评价超声调控酶解豌豆蛋白产物的乳化特性和抗氧化活性,结果表明,超声功率密度2.71 W/cm3、时间25 min和温度45 ℃为最佳酶解条件;与对照组相比,超声调控酶解豌豆蛋白产物具有较好的乳化活性和抗氧化活性;超声对酶解过程具有积极作用。超声可以增强酶活性并促进酶解反应,同时可提高酶解产物的功能特性,研究结果为超声在食品行业中的应用提供了参考。
