非洲猪瘟病毒、猪圆环病毒2型和猪圆环病毒3型三重PCR检测方法的建立
2023-12-18俄广晓孙少辉闫才杰马妮妮戴银娣杨秋实张少南张振东
俄广晓,孙少辉,邓 金,万 进,闫才杰,韩 峰,马妮妮,戴银娣,杨秋实,张少南,王 聪,张振东
(1. 江苏科技大学生物技术学院,江苏镇江 212018;2. 中牧实业股份有限公司,北京 100070;3. 中国农业大学动物医学院,农业农村部动物流行病学重点实验室,北京 100193;4. 中牧南京动物药业有限公司,江苏南京 210012)
非洲猪瘟病毒(African swine fever virus,ASFV)属于非洲猪瘟病毒科非洲猪瘟病毒属,是唯一通过节肢动物媒介传播的DNA病毒[1]。病毒粒子直径为175~215 nm,呈正二十面体对称结构,具有囊膜。猪感染后表现为高烧、呼吸困难以及各组织器官广泛性出血等临床症状,发病率和病死率最高可达100%[2]。目前仍无有效药物和疫苗可对其进行治疗和预防。
猪圆环病毒(porcine circovirus,PCV)是一种碱基数少、呈圆环状、无包膜的单链DNA病毒,是目前已知最小的动物病毒之一。目前已经确定了4种PCV(PCV1~4),猪感染后可出现体重增长缓慢、消瘦、呼吸困难、腹泻以及先天性震颤和繁殖障碍等一系列临床症状[3-4],其中PCV2和PCV3感染最为常见。PCV单独感染时并不容易导致猪出现严重的临床症状,但与其他病原的混合感染以及对感染猪产生免疫抑制所造成的继发性感染,一直是养猪业面临的难题。自2018年我国发生非洲猪瘟疫情以来,实验室检测被广泛普及与应用,是监督、复核与验证群体免疫和生物安全水平是否合格及猪群健康管理的有效工具,给我国猪病诊断与防控带来了巨大帮助。本研究基于ASFV、PCV2、PCV3 3种DNA病毒,建立了一种可同时检测3种病原的三重PCR方法,为上述病毒感染的临床诊断、流行病学调查及科学防控提供了技术支撑。
1 材料与方法
1.1 病原核酸及质粒
PCV2、PCV3、猪细小病毒(porcine parvovirus,PPV)、伪狂犬病病毒(pseudorabies virus,PRV)等病毒核酸,均由江苏科技大学生物技术学院实验室保存;ASFVVP72基因部分序列,由南京金斯瑞生物科技股份有限公司合成。
1.2 主要试剂
Simply P病毒DNA/RNA提取试剂盒,购自杭州博日科技有限公司;MagZol Reagent一步法RNA抽提试剂,购自Magen生物科技有限公司;2×TaqMaster Mix(Dye Plus)和HiScript III 1st Strand cDNA Synthesis Kit,均购自南京诺唯赞生物科技有限公司;胶回收试剂盒,购自江苏康为世纪生物科技有限公司;pMD19-T载体,购自TaKaRa公司;TOP 10感受态细胞,由江苏科技大学生物技术学院实验室制备并保存。

图1 退火温度优化结果

图2 引物浓度优化结果

图3 循环数优化结果

图4 特异性试验结果
1.3 引物设计与合成
根据GeneBank上登陆的ASFV、PCV2及PCV3相关基因序列,利用Primer Premier 6.0软件设计特异性扩增引物(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 ASFV、PCV2和PCV3扩增引物信息
1.4 重组质粒标准品制备
根据Simply P病毒DNA/RNA提取试剂盒使用说明书,分别提取PCV2和PCV3基因组DNA;以提取的DNA为模板,分别使用设计的引物对靶序列进行扩增;PCR产物回收纯化后,通过酶切等手段连接至pMD19-T载体。以合成的ASFVVP72基因部分序列为模板,使用设计的引物进行扩增,随后同样连接至pMD19-T载体。将3种连接产物转化至TOP 10感受态细胞,涂布平板后随即对阳性克隆菌筛选并扩大培养,提取目标质粒进行扩增、测序鉴定。在成功构建重组质粒标准品后,根据拷贝数计算公式可得出3种重组质粒标准品原始拷贝数,再分别稀释至1×1010copies/μL,随即分别进行10倍倍比稀释,取1×108~1×101copies/μL的阳性质粒进行后续试验。
1.5 三重PCR反应条件优化
以3种重组质粒标准品为模板,用设计好的3对高特异性引物在同一反应体系中进行三重PCR扩增,反应体系见表2。

表2 三重PCR反应体系
对退火温度(温度分别设定为51、53、55、57、59和61 ℃)、上下游引物浓度(终浓度分别取0.125、0.250、0.375、0.500、0.625和0.750 pmol/μL)以及循环数(分别设定为25、30、35和40个循环)进行优化。其他反应条件:95 ℃预变性3 min;95 ℃变性15 s,退火20 s,72 ℃延伸1 min,扩增相应循环数;72 ℃延伸5 min。
1.6 特异性试验
分别以ASFVVP72基因部分序列以及PCV2、PCV3、PRV、PPV基因组DNA为模板,以ddH2O为阴性对照,对建立的三重PCR方法进行特异性试验。
1.7 敏感性试验
根据质粒拷贝数计算公式(质粒质量浓度×9.12×1020/质粒碱基数),分别计算3种重组质粒标准品的拷贝数。将重组质粒标准品等比例混合,以10倍倍比稀释至1×108~1×100copies/μL的梯度区间,按上述已优化的三重PCR方法进行敏感性试验。
1.8 重复性试验
随机选取同一拷贝数浓度的3种重组质粒标准品,将其等比例混合,确定终浓度为1×105copies/μL,连续进行多次重复性检测,对所建立的三重PCR方法进行重复性试验。
2 结果与分析
2.1 重组质粒标准品构建
使用设计的上下游引物分别扩增出目的片段,并将其克隆至pMD19-T载体,测序后发现扩增序列与所选区域基因序列完全一致,表明3种重组质粒标准品成功构建。使用微量紫外分光光度计,测得3种阳性质粒质量浓度分别为174.23、214.67、153.89 ng/μL。
2.2 退火温度优化
退火温度优化结果(图1)显示:6个退火温度均可扩增得到清晰的、符合目的片段大小的条带;除在51 ℃时可扩增出1条小于100 bp的杂带外,其他退火温度下均未见明显杂带;在61℃时,扩增所得的3条目的条带相比于其他退火温度亮度更高,提示在该温度下扩增所得的产物浓度最大,因此选取61 ℃作为最佳退火温度。
2.3 引物浓度优化
在20 μL的三重PCR反应体系中,固定退火温度为61 ℃,对引物浓度进行优化。结果(图2)显示,所有待测浓度的引物均可扩增出单一的目的条带,且未见明显杂带;当引物浓度为0.375 pmol/μL时,对ASFV、PCV2和PCV3扩增出的条带亮度最高,因此引物最佳终浓度确定为0.375 pmol/μL。
2.4 循环数优化
在退火温度61 ℃和引物终浓度0.375 pmol/μL的基础上,建立20 μL的三重PCR反应体系,对扩增循环数进行优化。结果(图3)显示,当循环数为35或40时,扩增所得条带最为清晰明亮,且无杂带产生,可对3种扩增片段进行有效区分。由于扩增循环数为35时,整体所需的反应时间更短,因此确定最佳循环数为35。
2.5 特异性试验
采用建立的三重PCR方法对ASFV、PCV2、PCV3、PRV和PPV基因组DNA进行检测,验证该方法的特异性。结果(图4)显示,ASFV、PCV2和PCV3 DNA混合样品及单一样品均可扩增出与目的片段大小符合的单一条带,而PRV与PPV DNA样品均未出现相应条带。结果表明,所建立的三重PCR方法与PPV和PRV不产生交叉反应,具有良好的特异性。
2.6 敏感性试验
分别将ASFV、PCV2和PCV3重组质粒进行10倍倍比稀释,使其终浓度梯度为1×108~1×100copies/μL,然后进行单重PCR检测。结果(图5-A、B、C)显示,ASFV、PCV2和PCV3重组质粒的检出下限均为1×104copies/μL。将3种重组质粒等比例混合后,以10倍倍比稀释至终浓度梯度为1×108~1×100copies/μL,进行三重PCR扩增。结果显示(图5-D),3者混合后的检出下限为1×104copies/μL。
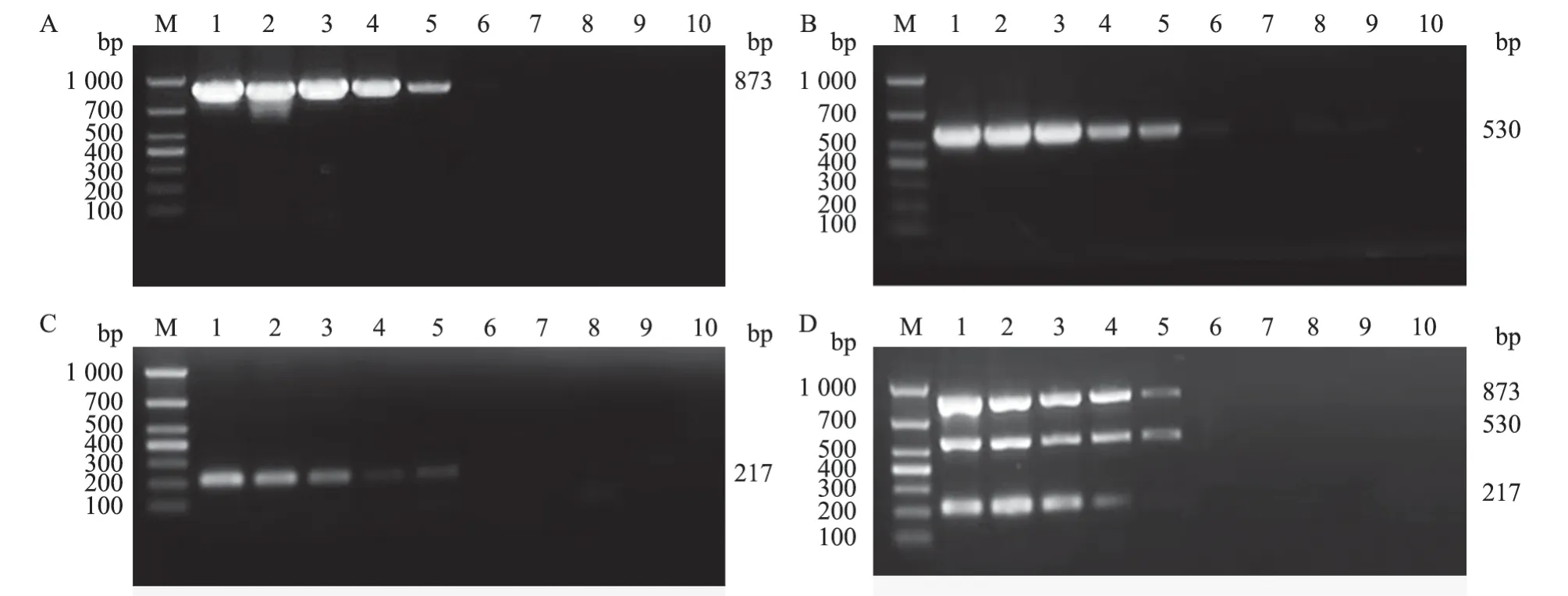
图5 敏感性试验结果
2.7 重复性试验
将终浓度均为1×107copies/μL的3种重组质粒混合后作为模板,其他反应条件不变,进行三重PCR扩增检测。结果(图6)显示,5次重复试验结果一致,均能扩增出与目的片段大小相同的单一条带,表明本方法具有良好的重复性。

图6 三重PCR重复性试验
3 讨论
2018年非洲猪瘟传入我国,给我国生猪养殖业带来了巨大打击。在近5年时间里,研究人员及一线工作者不断探索与实践,总结出一套较为行之有效的防控方案,而这其中,实验室检测是最为关键的环节。2020年以来,ASFV毒株多样性不断增加,部分地区陆续出现基因I型毒株以及基因Ⅱ型变异毒株和重组毒株。新型毒株的毒力明显减弱,潜伏期变长,临床感染猪的症状也愈发不明显,这使非洲猪瘟防控面临着更加严峻的挑战[5-6]。
猪传染性疾病的多重感染和混合感染已经成为当前疫病的主要流行形式。夏道伦[7]研究显示,80%以上的发病猪均存在2种及以上病原体混合感染,这也导致了病猪临床症状的复杂化。当前猪场中PCV2和PCV3流行十分普遍,其对猪的致死率很低,但可引起感染猪的免疫功能抑制。因此,PCV与其他病原的混合感染一直是困扰养猪业的重要难题,而建立一种快速、高效且成本低廉的检测方法十分必要[8]。
PCR检测方法凭借其特异性强、敏感性高以及成本低廉等综合优点,在生产一线的病原学检测中一直发挥着重要作用。目前针对ASFV和PCV的PCR检测技术研究已有诸多报道。早在20世纪90年代初,Steiger等[9]就建立了ASFV的PCR检测方法,可对细胞、脾脏以及血液中的ASFV进行检测。近年来,李云灿等[10]和曾少灵等[11]分别针对ASFVVP72和VP73基因设计特异性引物,建立了相应PCR检测方法,且建立的方法具有良好的特异性和敏感性。此外,分别针对PCV2、PCV3和PCV4的PCR检测方法也已成功建立。但是,普通PCR方法仅可对单一病原进行检测,而多重PCR方法通过在同一反应体系中加入多对特异性引物,可同时检测多种病原,在病原混合感染的大背景下具有更广阔的应用前景。分别针对ASFV和PCV的多重PCR检测方法也有诸多报道,如王莹等[12]建立了可同时检测ASFV、尼帕病毒(NiV)、猪水疱病病毒(SVDV)以及口蹄疫病毒(FMDV)的多重PCR检测方法。分别针对PCV2与PCV3、PCV2与PCV4以及PCV3与PCV4的双重PCR鉴别检测方法也已建立,而针对PCV2、PCV3和PCV4的三重PCR检测方法也已得到应用[13]。
本研究采用了基于TaqDNA聚合酶的2×PCR Mix反应体系,其中包含了除引物和扩增模板之外PCR反应所需的所有材料,仅需要对引物浓度、退火温度以及扩增循环数等反应条件进行优化,大大简化了试验操作。在优化过程中发现,引物浓度是影响多重PCR扩增结果的关键因素,这与其他学者研究[14-15]结论一致。多重PCR试验的成败与特异性引物的设计密切相关,所扩增的不同病毒目的片段大小要易于区分,且退火温度要相近。本试验中,设计的3对特异性引物的退火温度相近,在61 ℃时可同时扩增出3种病原的单一目的条带,且扩增的3种基因片段大小分别为873、530和217 bp,差异明显易区分。以构建的10倍倍比稀释的标准质粒为模板,检验所建立的三重PCR方法的敏感性,发现该方法对ASFV、PCV2和PCV3的检出下限均为1×104copies/μL,这也与其他多重PCR检测方法的灵敏度相似[16]。特异性检测结果显示,本研究所建立的方法与猪场常见病原PRV和PPV均不能产生交叉反应,证明其具有良好的特异性。并且,该方法具有良好的重复性和稳定性,这为猪场ASFV和PCV感染的监测与防控提供了可靠的技术手段。
