不同分子生物学方法在H5亚型禽流感病毒检测中的应用比较
2023-12-18尚佳静于晓慧房立春亓丽红封莹洁蒋文明刘华雷刘冠慧
尚佳静,罗 娟,于晓慧,房立春,亓丽红,孟 鸽,封莹洁,蒋文明,刘华雷,刘冠慧,李 阳
(1. 河北工程大学生命科学与食品工程学院,河北邯郸 056038;2. 中国动物卫生与流行病学中心,山东青岛 266032;3.山东省农业科学院畜牧兽医研究所,山东济南 250199)
禽流感(avian influenza,AI)是由禽流感病毒(avian influenza virus,AIV)引起的一类急性、热性、高度接触性疾病。AIV属于正黏病毒科,为单股负链RNA病毒,有囊膜,主要通过呼吸道、消化道或者直接接触传播[1]。根据HA蛋白差异,AIV可分为16个血清型(H1~16),其中H5-AIV被归类于高致病性禽流感病毒(high pathogenic avian influenza virus,HPAIV)[2]。高致病性禽流感(high pathogenic avian influenza,HPAI)是世界动物卫生组织(World Organisation for Animal Health,WOAH)规定的法定报告疫病,我国将其列为一类动物疫病。2019—2022年,H5-AIV一直在欧洲、非洲和亚洲的禽类中流行,使全球禽类病例从3 430例增加至25万例[3-5]。据农业农村部官方网站报道,2022年全球60多个国家和地区的家禽和野鸟中暴发了H5-AI疫情,超1.31亿只家禽死亡或被扑杀;2023年以来,H5-AIV在欧洲、美洲、亚洲和非洲的40多个国家和地区传播,导致超过3 700万只家禽死亡或被扑杀。此外,哺乳动物(如貂、水獭、狐狸和海狮)感染H5-AIV的病例也不断出现[6-8]。尽管AIV通常在鸟类中传播,但哺乳动物感染H5N1-AIV的病例也在持续增加。在生物学上,哺乳动物比鸟类更接近人类,这更加引发了人们关于病毒可能适应新变化,从而对人类感染性更强甚至引发全球大流行的担忧。因此,建立快速且准确可靠的检测方法对H5-AI防控具有重要意义。
目前,实验室常见的H5-AIV检测方法主要有反转录聚合酶链式反应(RT-PCR)[9]、荧光定量PCR(RT-qPCR)[10]、病毒分离[11]、血凝和血凝抑制(HA/HI)试验等,为H5-AI疫情防控提供了有力支撑。但这些方法因操作复杂、耗时长、对场地要求高等局限性难以被广泛应用。重组酶辅助扩增技术(RAA)与成簇规律间隔短回文重复序列及其相关蛋白(clustered regularly interspaced short palindromic repeats/CRISPR associated proteins,CRISPR/Cas)是近年来新兴的核酸检测技术,可以在短时间内实现对病原的快速检测[12-13]。本研究使用RT-PCR、RT-qPCR、反转录重组酶辅助扩增(RT-RAA)、RT-RAA结合侧流层析试纸条(RTRAA-LFD)、RT-RAA-簇状规则间隔短回文重复序列及其相关蛋白结合侧流层析试纸条(RT-RAACRISPR Cas13a-LFD)等5种检测技术对构建的H5-AIV cRNA标准品和临床样本进行检测,旨在对目前已建立的5种H5-AIV检测方法进行比较分析,以期为H5-AIV感染的检测与防控提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 病毒及临床样本 本研究所用的H5-AIV毒株,均由中国动物卫生与流行病学中心禽病监测室保存备用;80份临床家禽肛拭子、咽拭子样本,采集自山东、湖南、广东等地。
1.1.2 仪器与耗材 荧光定量PCR仪,购自赛默飞世尔科技(中国)有限公司;恒温金属浴,购自莫纳生物科技有限公司;振荡混匀仪、恒温核酸扩增仪,购自江苏奇天生物科技有限公司;琼脂糖、TAE缓冲液,购自青岛睿博兴科生物技术有限公司;RT-RAA、RAA恒温扩增试剂盒(荧光型)、一次性核酸检测试纸条(显线法/消线法),购自杭州众测生物科技有限公司;RNA/DNA核酸提取试剂盒,购自济凡生物科技(青岛)有限公司;pEASY®-T1 Cloning Kit,购自北京全式金生物技术股份有限公司;胶回收试剂盒,购自TaKaRa公司;质粒小提试剂盒,购自天根生化科技有限公司;HiScript II One Step RT-PCR Kit、RNase抑制剂,购自南京诺唯赞生物科技股份有限公司;Evo M-MLV一步法RT-qPCR检测试剂盒Ⅱ(探针法),购自艾科瑞生物科技有限公司;LWaCas13a,购自金斯瑞生物科技股份有限公司;T7体外转录试剂盒、T7 RNA聚合酶、NTP,购自NEB公司;MgCl2、HEPES,购自生工生物工程(上海)股份有限公司。
1.1.3 引物及探针序列 本研究所用引物及探针序列见表1。

表1 引物和探针名称及序列
1.2 病毒核酸提取
根据济凡生物科技(青岛)有限公司RNA/DNA通用核酸提取试剂盒说明书,进行H5-AIV及临床样本核酸提取。
1.3 cRNA标准品制备
以H5-AIV核酸为模板,使用HA-F/HA-R引物进行RT-PCR扩增,扩增产物经琼脂糖凝胶电泳确定条带大小无误后进行回收纯化;将纯化产物连接至T载体,然后转化至DH5α感受态细胞中,经热激、冰浴后,向其中加入LB液体培养基37 ℃培养1 h;将菌液涂布于含有Amp抗性的LB固体培养基,挑取单菌落于LB液体培养基中37 ℃培养4 h;进行菌落PCR,将鉴定为阳性的菌液送至睿博兴科生物技术有限公司测序;提取质粒进行酶切鉴定,使用DNA回收试剂盒对目的基因回收,再经体外转录试剂盒进行体外转录获得cRNA,最后以Rneasy MiNi Kit纯化,测定纯化后的cRNA标准品质量浓度并置于-80 ℃保存。
1.4 RT-PCR检测
分别以不同拷贝数浓度梯度的cRNA标准品为模板,以RT-PCR-F/RT-PCR-R为引物,按照RT-PCR试剂盒说明书配制反应体系。反应程序:50 ℃ 30 min,94 ℃ 3 min;90 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 5 min。扩增结束后进行1%琼脂糖凝胶电泳,于照胶仪中观察结果。
1.5 RT-qPCR检测
分别以不同拷贝数浓度梯度的cRNA标准品为模板,以RT-qPCR-F/RT-qPCR-R为引物,以RTqPCR-P为探针,按照一步法RT-qPCR试剂盒说明书配制反应体系。反应程序:42 ℃ 5 min,95 ℃30 s;95 ℃ 3 s,60 ℃ 30 s,35个循环。
1.6 RT-RAA检测
分别以不同拷贝数浓度梯度的cRNA标准品为模板,以RT-RAA-F/RT-RAA-R为引物,以RTRAA-P为探针,按照RT-RAA恒温扩增试剂盒(荧光型)说明书配制反应体系。配制完成后将反应单元放于振荡混匀仪,37 ℃反应5 min,然后转移至恒温核酸扩增仪进行扩增,37 ℃反应20 min,记录检测结果。
1.7 RT-RAA-LFD检测
分别以不同拷贝数浓度梯度的cRNA标准品为模板,以RT-RAA-LFD-F/RT-RAA-LFD-R为引物,以RT-RAA-LFD-P为探针,按照RT-RAA恒温扩增试剂盒(荧光型)说明书配制反应体系,将不含B Buffer的反应混合溶液加入试剂盒反应干粉中,随后在反应管盖加入2.5 μL B Buffer,轻轻混匀后将反应单元置于恒温金属浴中,37 ℃反应15 min。待扩增反应结束后,吸取10.0 μL扩增产物加入含有60 μL PBS缓冲液的离心管中,将试纸条放入离心管,5 min内观察结果并记录。
1.8 RT-RAA-CRISPR Cas13a-LFD检测
分别以不同拷贝数浓度梯度的cRNA标准品为模板,以Cas13a-F/Cas13a-R为引物,按照RTRAA恒温扩增试剂盒(基础法)说明书配制RTRAA反应体系进行扩增。待扩增结束后,取5 μL扩增产物加入到45 μL CRISPR Cas13a检测体系中,体系如表2所示。
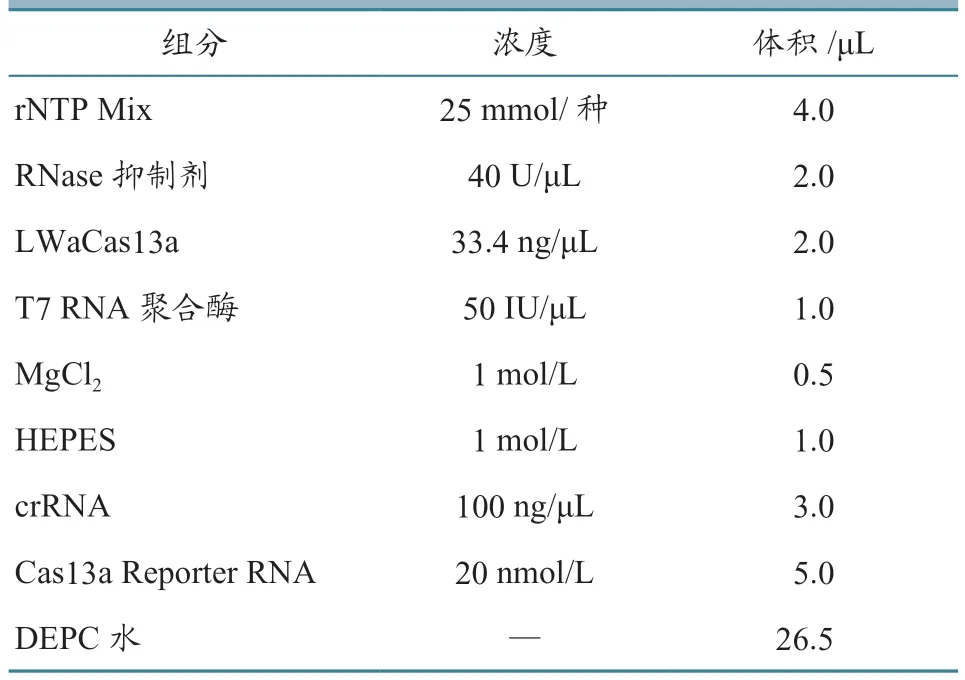
表2 RT-RAA-CRISPR Cas13a-LFD反应体系
将上述体系充分混匀后,立即放入恒温金属浴中,37 ℃反应20 min(注意避光),反应结束后将反应体系放入照胶仪中观察结果并拍照。
1.9 临床样本检测及数据处理
利用上述5种方法对80份临床样本进行检测,对检测结果应用SPSS软件分析符合率和Kappa值。符合率即不同方法检测结果与RT-qPCR结果相同数占样本总数的比例;Kappa值为一致性统计指标,Kappa值≥0.75说明两种方法检测结果具有良好一致性,0.4≤Kappa值<0.75说明一致性一般,Kappa值<0.4说明一致性较差。
2 结果
2.1 灵敏度比较
2.1.1 RT-PCR检测 测得cRNA标准品质量浓度为39.4 ng/μL,经换算,拷贝数浓度为4.1×1010copies/μL,将其稀释为1×1010copies/μL,经10倍倍比稀释后,以108~101copies/μL的cRNA标准品为模板,进行RT-PCR检测。结果(图1)显示,RT-PCR方法可检测到100 copies/μL的H5-AIV cRNA标准品。
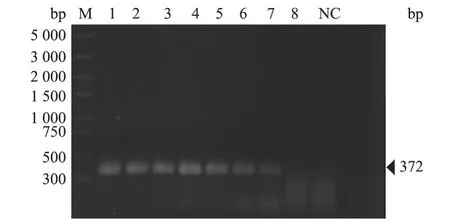
图1 RT-PCR方法灵敏度试验结果
2.1.2 RT-qPCR检测 以103~10-1copies/μL的cRNA标准品为模板,进行RT-qPCR扩增,评估该方法的灵敏度。结果(图2)显示,RT-qPCR方法可检测到10-1copies/μL的cRNA标准品。

图2 RT-qPCR方法灵敏度试验结果
2.1.3 RT-RAA检测 以103~10-1copies/μL的cRNA标准品为模板,进行RT-RAA检测。结果(图3)显示,RT-RAA方法可检测到1 copies/μL的cRNA标准品。

图3 RT-RAA方法灵敏度试验结果
2.1.4 RT-RAA-LFD检测 以105~10-1copies/μL的cRNA标准品为模板,进行RT-RAA-LFD检测。结果(图4)显示,RT-RAA-LFD方法可检测到1 copies/μL的cRNA标准品。
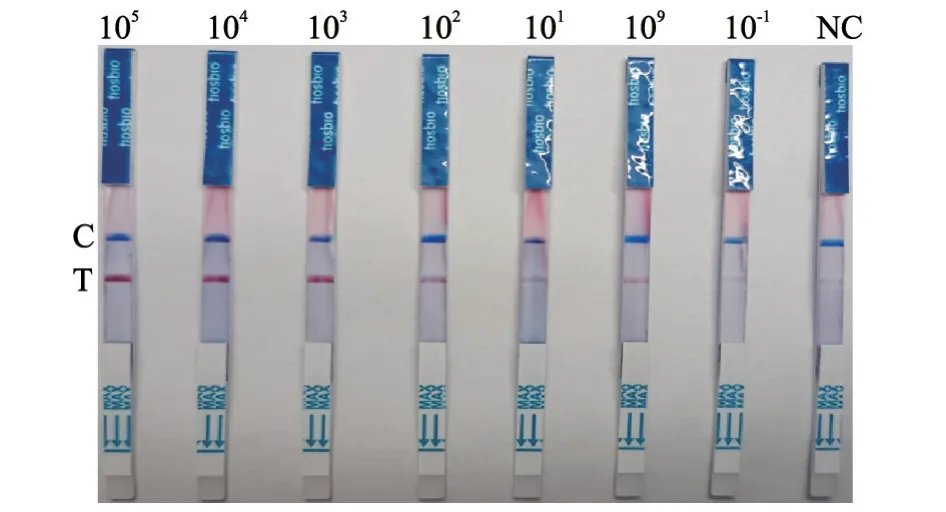
图4 RT-RAA-LFD方法灵敏度试验结果
2.1.5 RT-RAA-CRISPR Cas13a-LFD检测以106~10-2copies/μL的cRNA标准品为模板,以ddH2O为阴性对照,进行RT-RAA-CRISPR Cas13a-LFD检测。结果(图5)显示,RT-RAA-CRISPR Cas13a-LFD方法可检测到10-1copies/μL的cRNA标准品。

图5 RT-RAA-CRISPR Cas13a-LFD方法灵敏度试验结果
2.2 临床应用比较
利用RT-qPCR方法对本研究中所收集的80份临床样品进行检测,结果共鉴定出38份H5-AIV阳性样本,42份H5-AIV阴性样本。随后使用4种方法进行检测,并对检测结果进行分析比较。结果(表3)显示:RT-PCR、RT-RAA、RT-RAALFD、RT-RAA-CRISPR Cas13a-LFD与RT-qPCR结果的符合率分别85.00%、93.75%、88.75%、91.25%,与RT-qPCR相比,上述4种方法的Kappa值分别为0.74、0.87、0.77、0.82,提示RT-PCR一致性符合率最低。

表3 不同检测方法与RT-qPCR在临床样本检测的比较
3 讨论
由H5-AIV引起的HPAI不仅严重影响着我国养禽业的发展,还对公共卫生安全造成了威胁。我国是养殖业第一大国,鉴于动物和人类H5-AIV感染病例的不断出现,加强对其检测,防止进一步传播至关重要。
当前,针对H5-AIV常用的实验室检测方法主要有RT-PCR、病毒分离及RT-qPCR。RT-PCR已被广泛用于AIV检测,相较于RT-qPCR,其成本较低,便于操作,但扩增产物需进行琼脂糖凝胶电泳,这增加了检测时间,且显影剂对人体伤害较大[14];RT-qPCR虽灵敏度高,结果准确,但由于荧光定量PCR仪及试剂昂贵,且需专业人员进行操作等问题,无法满足现场快速检测的需求。应在生物安全三级实验室(BSL-3)或更高等级的设施中处理HPAIV,这使得试验开展具有一定的局限性,成本较高,增加了试验难度[15]。恒温核酸扩增技术与CRISPR技术具有特异性好,灵敏度高的特点,同时结合侧流层析试纸条可实现检测结果的可视化。本研究选用实验室常规RT-PCR、RT-qPCR方法及新兴RAA与CRISPR技术,对H5-AIV检测的灵敏度和临床应用效果进行了比较分析。结果显示:RT-qPCR方法灵敏度更高,但与RT-PCR方法一样检测时间需1~2 h,不仅耗时长还需精密仪器及专业人员操作,无法满足现场快速检测需求;RT-RAA、RT-RAA-LFD与RTRAA-CRISPR Cas13a-LFD均可在恒温条件下进行病毒核酸扩增,且RT-RAA-CRISPR Cas13a-LFD与WOAH推荐的RT-qPCR检测灵敏度一致,临床检测符合率较高,是值得推广的一项技术。但本研究中RT-RAA-CRISPR Cas13a-LFD扩增为两步法,即RT-RAA扩增一步,CRISPR一步,存在造成气溶胶污染的风险。因此,为进一步缩短检测时间并降低气溶胶污染风险,应将RT-RAA扩增与CRISPR于一管中反应。综上,RT-qPCR作为WOAH推荐的确认样本中是否存在病毒核酸的方法之一,灵敏度高,检测结果准确,但需昂贵仪器,难以被广泛应用;RT-RAA-CRISPR Cas13a-LFD与RT-qPCR方法灵敏度一致,较优于其余3种。临床样本检测结果表明,RT-RAA、RT-RAA-LFD、RT-RAA-CRISPR Cas13a-LFD与RT-qPCR临床诊断的符合率较高,高于RT-PCR的检出率。5种方法整体对H5-AIV检测结果良好,但对仪器设备要求有所差异,检测人员可根据实际情况进行选择。
总之,本研究使用不同分子生物学方法对H5-AIV的检测结果进行了比较和分析,以期为H5-AIV感染的防控提供可靠的技术支撑。
