海洋微藻多不饱和脂肪酸生物合成机制研究进展
2023-12-18许晓路张德勇
许晓路, 张德勇
(浙江树人学院生物与环境工程学院,杭州 310015)
多不饱和脂肪酸(PUFA)尤其是n-3 PUFAs在营养健康领域的市场需求一直很大。长期以来PUFAs主要依靠从海洋鱼油中提取,但随着渔业资源消耗、成本升高等问题,迫切需要开拓新的来源,因此来源丰富、可再生的海洋藻类成为备受瞩目的替代性来源。其实海洋鱼类体内的PUFAs很大程度上也是通过摄食各类海藻而获得的,因此藻类也被视为PUFAs真正的初级制造者。大型海藻和微藻(也包括一些淡水藻类)均可作为PUFAs的来源,相关研究也屡见报道,但目前鲜见关于藻类中PUFAs的生物合成机制的介绍,故文章拟对微藻中PUFAs的合成途径进行简要综述,兼及微藻产品的开发应用情况。
1 微藻产PUFAs的特征
海洋及淡水中均存在大量微藻,它们一般为浮游生物,有些被归为细菌,有些则被归为植物,既有原核生物也有真核生物。迄今已发现的微藻逾3 000种,主要包括蓝绿藻、绿藻、硅藻和金藻四大类[1]。大部分微藻是能进行光合作用的自养生物,但也有些种类营异养方式(如隐甲藻),或混合营养方式(如某些甲藻),同一物种也可能因环境因素而改变生活方式,因此藻类的代谢途径可能非常复杂多样[2]。微藻中富含的脂类尤其是研究热点,微藻中的脂质质量分数大致在1%~40%范围,某些种类中甚至能高达74%。微藻中的脂肪酸其碳链长度范围为12~24,包括n-3或n-6的PUFAs[3]。n-3 PUFAs主要指α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)、二十二碳五烯酸(DPA),n-6 PUFAs则主要指亚油酸(LA)、花生四烯酸(ARA)等,对人体健康有重要促进作用,在食品、保健品、医药、饲料等领域有广阔的应用前景。由于人们对微藻的认知和接受度有限,目前微藻在食品医药领域的应用尚不充分,仅有少数种类真正实现了商业化开发,还有巨大的开发潜力。
不同物种或不同生长环境的微藻,其必需多不饱和脂肪酸含量、20∶5n-3和22∶6n-3的比例等均可能差异悬殊。目前发现,善于合成DHA的主要有甲藻、鞭毛藻、某些隐藻、破囊壶菌及裸藻[4]。在某些甲藻中,22∶6n-3 PUFA在总脂肪酸中的质量分数高达40%,某些鞭毛藻中则可达30%[4]。破囊壶菌也是最重要的22∶6n-3生产者,例如某些破囊壶菌和裂殖壶菌中的DHA在总脂肪酸中的质量分数能高达60%[5]。善于合成EPA的则主要有三角褐指藻(Phaeodactylumtricornutum)等硅藻、微绿球藻(Nannochloropsissp.)等黄绿藻、以及某些鞭毛藻[3,6-8]。硅藻能合成约20%(质量分数)的EPA,并能合成少量DHA[6]。黄绿藻中20∶5n-3中的质量分数通常也在15%~30%之间[7]。其他微藻如蓝藻、绿藻等,很少产生长链n-3 PUFAs,仅发现ALA、硬脂酸(SDA-18:4n-3)等少数几种[3]。除了物种差别,长链PUFAs的生成还受环境因素(温度、光照、盐度、和养分可用性)、藻类发育阶段等影响,如温度改变可致微藻膜流动性改变以调整其脂肪酸构成、营养缺乏会促使微藻增加中性脂质[9,10]。Taipale等[3]研究16种藻类的PUFAs合成对外界因素的敏感性,发现对于隐藻、金藻和甲藻,提高温度或氮浓度均可导致SDA、EPA、DHA和DPA的含量升高;隐藻和金藻倾向于在平台期合成PUFAs,而硅藻、甲藻则倾向于在指数期合成PUFAs。可见微藻的开发应用亟待进一步开拓,其复杂的代谢途径也有待深入探索。
2 微藻中PUFAs的生物合成途径
微藻中的脂肪酸合成途径涉及3个过程:饱和脂肪酸的合成、碳链的进一步延伸、饱和键的脱饱和反应。但后2个过程是否需要进行及具体进行几步,则因具体产物而异。
2.1 饱和脂肪酸的合成——FAS途径
在动植物中,脂肪酸的合成均是以乙酰辅酶A为起始,由乙酰辅酶A羧化酶(ACCase)和脂肪酸合成酶(FAS)共同催化完成。而乙酰辅酶A则来自葡萄糖的分解,即葡萄糖酵解生成丙酮酸,丙酮酸再被丙酮酸脱氢酶脱羧和氧化生成乙酰辅酶A,因此也可以说合成脂肪酸的最初原料其实来自葡萄糖。
对于微藻,推测的微藻中饱和脂肪酸合成途径(FAS途径)如图1所示[11]。与植物相似,微藻中饱和脂肪酸合成阶段大致也是以乙酰辅酶A为前体原料,循着脂肪酸合成酶(FAS)途径合成棕榈酸(16∶0)及其他饱和脂肪酸。这一阶段亦称为脂肪酸的初始合成,发生于微藻的质体(一般是叶绿体)中,该反应应该还需要能量(ATP)和还原力(NADPH)的参与。但是不同种类的微藻其形态结构、生理特征及碳代谢有较大差异,因此其脂类的合成途径及运输方式可能也会存在差异[12]。关于微藻中乙酰辅酶A的生成过程目前了解尚比较有限,参照植物推测,其乙酰辅酶A可能有2个来源:一是由叶绿体中的丙酮酸脱氢酶/脱羧酶直接供给,二是通过线粒体中的丙酮酸脱氢酶间接供给,即线粒体中的乙酰辅酶A经水解后被运输至叶绿体,再由ACCase进行再生[13]。

图1 推测的微藻中饱和脂肪酸合成途径(FAS途径)[11]
合成脂肪酸的第一步反应是乙酰辅酶A和碳酸氢盐之间反应,形成丙二酰辅酶A[12,13]。丙二酰辅酶A作为脂肪酸从头合成途径的初始前体在整个合成途径中起着核心作用,而且后续还会参与在内质网(ER)中发生的碳链延伸反应。丙二酰辅酶A通过“缩合、还原、脱水和再次还原”4步反应的反复进行,不断添加二碳单位从而形成脂链。该反应伴随着CO2的释放以及NADPH的消耗[12]。在微藻中负责催化脂肪酸生物合成的酶为基质脂肪酸合成酶(Ⅱ型),该酶为由4种单功能酶单元组合而成的复合酶,以确保能同时催化4种酶促反应。由于植物中的FAS酶的基因序列已经被破解,学者们基于藻类与植物具有相似性,也顺利找到了微藻中的FAS酶的基因,并对其功能进行了表征[12]。第一步缩合反应由β-酮酰基ACP合成酶(KS)催化,目的是形成简单的碳-碳键。每种KS负责不同的反应:KSIII负责丙二酰辅酶A和乙酰辅酶A之间的初始缩合,KSI负责6个连续步骤生成16∶0-ACP,KSII负责16∶0-ACP经最后一个延伸反应形成18∶0-ACP[13]。接下来第二步是还原反应,由β-酮酰基ACP还原酶(KR)催化,该酶具有NADPH依赖性。第三步是β-羟酰基ACP参与的脱水反应,用以合成烯酰基ACP。第四步是烯酰基ACP接下来被第2个还原酶β-烯酰基ACP还原酶(βER)还原形成饱和酰基ACP[13]。哺乳动物细胞质中所发现的Ⅰ型脂肪酸合成酶被证实是由7种催化组件连接在一起形成的多功能巨合酶。微藻的细胞质中是否也普遍存在同样结构的复合酶尚不清楚,但已在微拟球藻(Nannochloropsisoceanica)和纤细裸藻(Euglenagracilis)中分离到推测的FAS I酶,说明微藻中确实可能存在类似的酶[14]。微藻的FAS途径经过一系列反应可形成产物棕榈酸(16∶0)或硬脂酸(18∶0)。
2.2 链延长反应与脱饱和反应——n-3途径与n-6途径
质体(叶绿体)中FAS途径合成的16∶0,可以再经最后一轮“缩合、还原、脱水和再次还原”4步反应,可得到更长的饱和脂肪酸硬脂酸(18∶0),16∶0和18∶0均是微藻FAS途径的主要产物。16∶0和18∶0均可以进入后续的反应进一步产生各种不同链长及不同不饱和度的脂肪酸[12]。
不饱和双键的形成由酰基辅酶A脱饱和酶负责催化。该酶是一种特殊类型的加氧酶,能够从烃链中去除2个氢,使其产生双键。根据其区域选择性,脱饱和酶通常被写为Δx,其中x是指从脂肪酸的羧基端开始添加双键的位置[15]。在FAS途径后,D9脱饱和酶负责在羧基末端的第9个碳上添加第1个双键,故该酶可使16∶0和18∶0分别产生第1个单不饱和脂肪酸,即棕榈油酸(16∶1n-7-PAL)和油酸(18∶1n-9-ODE)。
经FAS途径,形成了棕榈酸、硬脂酸产物,如果它们经脱饱和则又可产生棕榈油酸、油酸。如果是在植物中,这些比较初始的脂肪酸接下来通常有2种去向:一是留在质体中参与糖脂(主要是半乳糖脂)的合成;二是被释放到细胞质中,并转移到内质网,用于质体外脂质的合成[12]。学者们推测在微藻中存在与植物中相似的脂肪酸运输途径,利用C13放射性标记法在硅藻角毛藻(Chaetocerosmuelleri)中进行的初步研究支持这一推测[16]。目前认为微藻与植物类似,首先是在质体中合成饱和脂肪酸,然后运输到细胞质中进行后续的链延伸和(或)脱饱和反应。但鲜见这方面的研究,仅在少数种类如某些硅藻上开展过一些研究,而对于其他更多的微藻中的合成途径仍难以判断。
据推测,微藻中后续的PUFAs合成途径包括n-3途径、n-6途径及聚酮合成酶途径(PKS途径)[12]。n-3和n-6途径的发生场所不再是质体,而是线粒体和内质网(ER),以棕榈酸或其类似物起始,由特定酶的酰基辅酶A衍生物参与催化。在传统的氧依赖途径中,18∶1n-9先被D12脱饱和酶进行脱饱和,然后再被D15脱饱和酶进行脱饱和,分别形成亚油酸和α-亚麻酸,作为n-6和n-3脂肪酸家族的前体。但在硅藻中另有独特的发现,16∶1n-7可以通过D6和D15的脱饱和作用转化出更复杂的C16多不饱和脂肪酸(16∶2n-7、16∶2n-4、16∶3n-4或16∶4n-1),该途径被称为“C16多不饱和脂肪酸途径”[17]。
推测的微藻中多不饱和脂肪酸合成途径如图2所示[11, 18]。从18∶2n-6和18∶3n-3起始,可以分别沿着n-6途径或n-3途径生成各种更复杂脂肪酸。在自然界中,已鉴定出多种参与该途径的脱饱和酶复合物。其中前端脱饱和酶(以Δx命名)在碳链羧基端的x位置添加双键,而甲基端脱饱和酶(以ωy命名)在碳链羧基端的y位置引入双键甲基端[19]。不同生物中发现的脱饱和酶情况比较复杂,例如后生动物的细胞中普遍存在前端脱饱和酶如D5、D6,但没有甲基端脱饱和酶如ω6(D12)或ω3(D15)。哺乳动物理论上也可以利用自身的D4、D5和D6脱饱和酶将食物中的18∶2n-6和18∶3n-3进行链延长并脱饱和,生成C20-C22系列的PUFA(20∶4n-6、20∶5n-3、22∶6n-3)。但这种18∶2n-6和18∶3n-3转化为必需C20-C22PUFAs的效率通常是非常低,因此基本上仍须依赖通过摄食来获取。相反,微藻则同时具有甲基端脱饱和酶与前端脱饱和酶,因此在提供必需脂肪酸等方面的有着不可替代的价值。

图2 推测的微藻中多不饱和脂肪酸合成途径[11, 18]
2.3 PUFAs的无氧合成——聚酮合成酶途径(PKS)
部分微藻中还存在一种不依赖氧的PUFA合成途径,称为聚酮合成酶途径(PKS途径)。但它不像前述n-3途径、n-6途径那样普遍,仅见于某些物种中,主要是细菌、破囊壶菌及甲藻[20]。PKS途径最初是在深海细菌希瓦氏菌中最先发现的[21]。后来在破囊壶菌、甲藻、鞭毛藻和绿藻中先后均找到了编码PKS酶的基因,显示PKS途径存在于多种原生生物中[22-24]。
与FAS途径相似,PKS途径也是包括4步基本反应:缩合、还原、脱水和再次还原。甚至负责催化这些反应的四种酶也与FAS途径中的类似:β-酮酰基ACP合成酶(KS)、β-酮酰基ACP还原酶(KR)、β-羟酰基ACP脱氢酶(DH)和β-烯醇基ACP还原酶(ER)。不过FAS途径以及随后的链延伸和(或)脱饱和反应用到的酶很多,整个过程能耗很高,而PKS途径在还原和脱水环节其反应步骤较少,能耗低,产PUFAs的效率更高[25]。实际上,参与合成脂肪酸的分子在进行延伸时仍维持着不饱和状态。PKS途径基本上都是无氧条件下进行的,但在有氧条件下也仍是可以发生的[26]。
据研究,聚酮合成酶分为3类:Ⅰ型PKS是一种大型多功能酶,在同一多肽上分布着多个催化结构域。每个模块负责一组不同的、非迭代的反应,共同参与一个完整的聚酮链延伸循环。Ⅱ型PKS是由多个单功能酶组成的酶复合物,其中每个酶各有1个催化结构域并具有一组迭代活性作用。而Ⅲ型PKS实际上是负责参与缩合反应的一种同源二聚体酶。Ⅰ型和Ⅱ型PKS均需要酰基载体蛋白(ACP)来激活负责引导生成聚酮中间体的底物,而Ⅲ型PKS则是直接作用于乙酰辅酶A,不需要ACP参与[27]。Ⅰ型PKS是各类原生生物中的最主流的PKS,至今已先后在鞭毛藻、绿藻、甲藻及破囊壶菌中被发现[22,27-29]。不过,甲藻中的Ⅰ型PKS不一定总能观察到多功能活性,因为某些种类如短卡氏藻(Kareniabrevis)、骨亚历山大藻(Alexandriumostenfeldii)和三尖异头藻(Heterocapsatriquetra)中发现了具有非典型结构的Ⅰ型PKS,它们仅具有一个催化模块而不是多模块[28]。Ⅱ型PKS存在于鞭毛藻中,如球石藻赫氏颗石藻(Emiliania huxleyi)、隐藻和甲藻[29]。Ⅲ型PKS通常仅限于高等植物、真菌及细菌[30]。
PKS途径依赖与FAS途径相同的4种酶来进行,可以使用2种异构酶(2,3 i或2,2 i)完成,推测的某些微藻中无氧合成PUFAs的PKS途径如图3所示[11, 31]。PKS途径的前体物质也与FAS途径的相同,即乙酰辅酶A和丙二酰辅酶A。酮酰基合成酶(KS)和酮酰基还原酶(KR)负责添加二碳单位,而脱氢酶(DH)(或与异构酶相关的脱氢酶)和烯酰还原酶(ER)负责插入双键。PKS途径与的延伸和(或)脱饱和途径的差异在于双键的插入方式并不一样。具体而言,PKS途径通过添加碳并直接将不饱和键放在新生的酰基链上来生成新的脂肪酸,而在n-3和n-6途径中,双键是被插入原本完好的酰基链上。因此,PKS途径需要消耗的能量更少,因为不需要像常规途径中脱饱和反应那样消耗ATP。
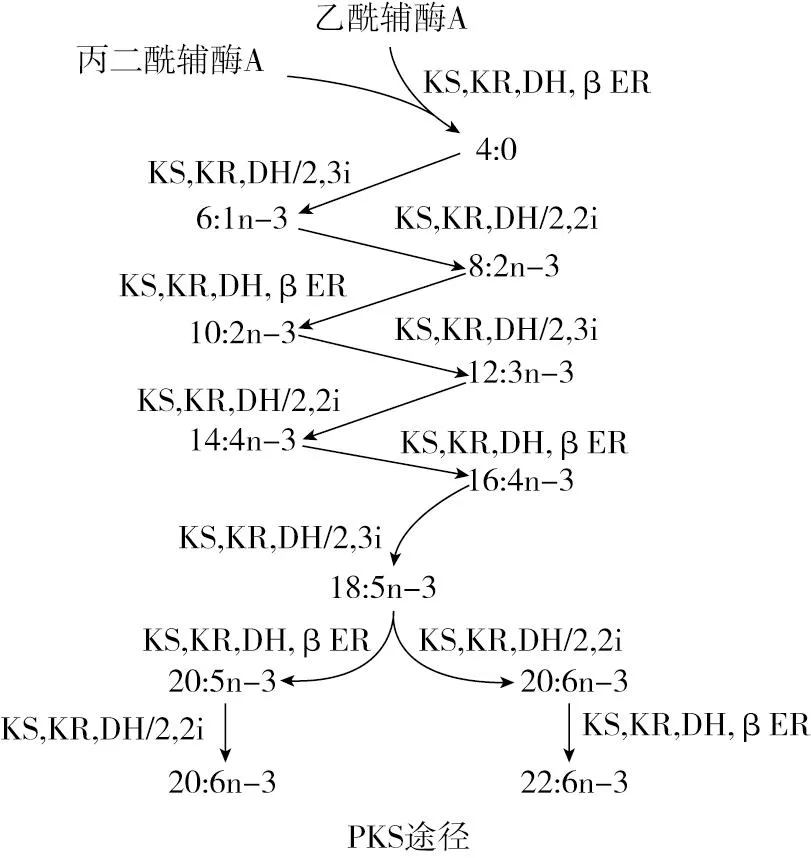
注:KS为3-酮酰基合酶;KR为3-酮酰基还原酶;DH为异构酶相关脱氢酶;βER为烯醇还原酶。
长期以来,关于PKS途径的研究大多关注的是n-3多不饱和脂肪酸的产生,尤其是22∶6n-3(DHA)和20∶5n-3(EPA)[32]。然而,近来有研究显示,PKS途径可能不仅限于n-3多不饱和脂肪酸的生成。例如,Zhang等[33]认为还存在用于合成n-6多不饱和脂肪酸DPA-6的PKS样途径。Remize等通过研究微小亚历山大藻(Alexandriumminutum)的脂肪酸合成途径,也进一步提出了可能存在用于生成22∶5n-6的n-6 PKS途径[24]。
3 微藻PUFAs的开发应用现状
微藻以富含各种营养成分、生理活性成分而知名,因此其最大的应用领域是食品保健品领域。市场上主流的微藻产品主要是以片剂、胶囊或粉末等形式作为膳食补充剂。一种较新颖的产品形式是微藻油,即利用微藻的n-3PUFAs开发成食用油,这种独特的微藻油在成分和性质上均不同于常见的植物油或动物油。例如利用裂殖壶菌的脂肪酸开发的藻油Algae Omega 3已被批准用于人类食用[34],作为成人膳食补充剂添加于食品(奶酪、酸奶、酱和调味品等)及饮料中。
另外,还可以将微藻成分添加到传统食品中,做成特殊的饼干、酸奶等。如眼微绿球藻(Nannochloropsisoculata)富含EPA和DHA,Babuskin等[35]利用其开发出了有益健康的功能性饼干和面食。巴夫藻(Pavlovalutheri)的n-3 PUFAs被证实具有抗炎作用,故有人将其添加到了酸奶中,开发了保健酸奶。虽然仍需进一步改进口味等问题,但往酸奶中添加富含n-3PUFA的海藻油的想法很新颖,对于开发面向素食主义者的特殊食品等颇有启发意义。据研究,人类摄入这种增强型酸奶后可显著提高血浆及红细胞中的DHA浓度。因此,来自藻类的营养成分对素食主义者是不错的选择[36]。给素食主义者补充来自肯氏壶藻(Ulkeniasp.)的DHA,不仅提高了其红细胞中有益健康康的n-3 PUFA的浓度,而且微藻油似乎还能改善他们的食欲和营养摄入状况[37]。n-3 PUFAs(EPA、DHA、ALA)还可以添加到婴儿牛奶、小球藻强化饮料等保健饮料中,或者添加到汤、粥、果汁、饼干、冰淇淋、奶昔或膳食补充剂中[38]。
微藻还有望应用于特定的医药用途。微藻脂质有抗氧化、抗癌和抗炎功能。例如,呋喃脂肪酸能清除自由基,在碳主链内形成富电子的呋喃环。在等鞭藻(Isochrysissp.)和三角褐指藻(Phaeodactylumtricornutum)上的研究证实其脂质具有很强的抗炎功效。不过由于难以纯化等原因,尚未完成临床试验,走向应用尚需时日[39]。蓝藻产生的脂肽能结合真核细胞中的微管蛋白或肌动蛋白丝,在癌症检测等领域有应用前景。另外在预防心血管疾病、糖尿病和高血压等领域微藻也有涉及[40]。
除了生理功能,微藻PUFAs独特的结构特性还能应用于食品加工工艺。富含蛋白质的藻类,如小球藻、雨生红球藻或四倍体藻,可用作食品表面活性剂。此前人们发现蛋白质可以用作乳液中重要的弹性层,不过经过实际使用发现其性能并不如传统的小分子表面活性剂。因为小分子表面活性剂往往扩散率更好。因此微藻中的小分子物质如糖脂(单酰甘油MAG或二酰甘油DAG)、磷脂(磷脂酰胆碱PC,即卵磷脂)、脂肪酸等用作表面活性剂有望表现更好[41]。海洋生物的磷脂通常富含卵磷脂(磷脂酰胆碱),其具有两亲性,因此特别适用于乳液制备。当前这方面的研究大多集中将n-3三酰甘油用于食品强化剂,而关于磷脂的报道则很少。例如,富含n-3 PUFA磷脂的油被用于鱼糜产品后,由于EPA和DHA的存在,使其具有更好的抗脂质氧化能力[42]。
微藻的脂质还可以用作食品增强剂和防腐剂。利用藻类开发的脂粉和面粉是一个新的研究热点。例如将可食用的杜氏盐藻添加到面食中,高含量的PUFA、植物分子和矿物质能改善面食制品的感官特性。它们作为鸡蛋的替代品,效果也非常好,尤其是对素食者而言。脂粉尤其是富含14∶0、16∶0、18∶1n-9和微藻EPA的脂粉,其抗菌性能也很不错,可以在食品储藏方面发挥重要作用[43]。微藻还可以用于提高奶酪等乳制品的营养特征。如小球藻(Chlorella)和节旋藻(Arthrospira)已被用于奶酪中,据报道对乳酸菌的活力有促进作用,能提高乳酪的质量及感官特性。眼微绿球藻(Nannochloropsisoculata)和球等鞭金藻(Isochrysisgalbana)已被用于开发新型的曲奇、意大利面、松饼等中,显著增加了n-3 PUFA的含量,获得消费者的感官好评[35]。类原核小球藻(Auxenochlorellaprotothecoides)可开发富含PUFA的海藻粉,被用于加工各种食品[44]。添加富含脂质尤其是n-3 PUFA的微藻,另一个重要优势是使食品更耐受热处理,这样食品的整体营养价值也可以保留得更好。
微藻的开发应用如火如荼,但人们对微藻内部的代谢机制仍了解有限。将来有必要进行更深入的研究,以期对不同种类或处于不同环境的微藻的营养健康价值有更全面的认知,或者更进一步对其代谢途径进行人为干预,实现提高产量、改善成分组成等。
