添加不同生物炭对人工窖泥培养微生物群落影响
2023-12-18陈思恒宁欣强唐棠罗惠波郑佳李华志甘元甲
陈思恒,宁欣强,2*,唐棠,罗惠波,2,郑佳,李华志,甘元甲
1(四川轻化工大学 生物工程学院,四川 自贡,643000)2(酿酒生物技术及应用四川省重点实验室,四川 宜宾,644000)3(宜宾五粮液股份有限公司,四川 宜宾,644000)4(资中县银山鸿展工业有限责任公司,四川 内江,641000)5(四川佳乐酒业股份有限公司,四川 泸州,646000)
中国白酒,作为世界六大蒸馏酒之一,以其独一无二的风味著称于世[1]。浓香型白酒作为白酒四大香型之一,具有窖香浓郁、绵柔醇厚、香味协调等特点[2]。窖池作为白酒酿造的容器,窖泥中含有己酸菌、甲烷菌等多种功能微生物,通过这些微生物的代谢活动,赋予了浓香型白酒独特的风味;这使窖泥成为浓香型白酒生产中最关键的部分之一,因此优质人工窖泥的培养成为生产优质白酒的前提[3-4]。目前人工窖泥培养研究主要包括窖泥配方优化、外源制剂添加、微生物作用机制和预防窖泥老化和复壮等方面[5]。但人工窖泥培养过程还存在水分易流失、营养物质利用率低、功能菌富集较慢等问题[6]。因此,加快培养的人工窖泥向优质老窖泥转化,提高人工窖泥培养质量具有重要的理论和现实意义。
生物炭常作为土壤改良剂,其对土壤理化性质和微生物群落结构具有较大的影响。而人工窖泥一般选用黄泥作为基质,与土壤有一定的相似性。生物炭是一种在缺氧状态下高温分解得到的比表面积大、孔隙发达且富含碳素的生物质炭,被广泛运用于环境等领域[7-8]。人工窖泥培养过程添加生物炭预期能够提高碳氮比,改善窖泥含水量、pH,进而调节窖泥微生物群落结构。在人工窖泥培养过程中,生物炭的孔隙能定植微生物细胞并且能保住水分[9-10],高碱度可以延缓窖泥pH过度降低,丰富的表面含氧官能团(oxygenated functional groups,OFGs)能促进电子迁移,加快微生物生长代谢活性,增强生物量及酶活性[11];另外生物炭富含大量羧、醇羟基等,能进一步提高窖泥保水性[12],加快人工窖泥向优质老窖泥转化。生物炭原料在结构、内含物等方面存在差别,不同原料高温裂解后在结晶度、交联和分支等结构特征上差异显著[13]。竹子等生物炭木质素含量高,炭化后大孔径结构多;而秸秆类生物炭由于纤维素含量高,炭化后结构以微孔为主,相比竹子生物炭,其灰分含量、矿物质种类和pH略高。另在碳含量上,秸秆生物炭一般为40%~80%,其他生物炭一般为60%~85%[14]。所以不同种类的生物炭在理化性质和结构上有明显差异,故有必要针对不同来源的生物炭对人工窖泥培养过程影响进行研究。
本研究选用宜宾本地某酒厂窖泥培养原料,在实验室条件下培养人工窖泥,分析添加丢糟生物炭(马弗炉烧制ZM、热解气化烧制ZR)、玉米秸秆生物炭(YM)、稻壳生物炭(DK)、水稻秸秆生物炭(SD)、竹生物炭(ZT)6种不同生物炭和不添加生物炭(B)的人工窖泥,在培养开始和结束(90 d)时微生物群落结构、内部菌属相关性、理化与微生物相关性的差异。对微生物群落结构与理化性质之间的相关性进行分析,解读生物炭添加对人工窖泥培养过程微生物种群结构的影响,为生物炭加快人工窖泥向优质老窖泥转化提供理论依据。
1 材料与方法
1.1 材料与试剂
培养人工窖泥材料均选取宜宾本地某酒厂;生物炭材料丢糟生物炭(马弗炉烧制、热解气化烧制)、玉米秸秆生物炭、稻壳生物炭、水稻秸秆生物炭、竹子生物炭(具体参数见表1);其他试剂均为国产分析纯。

表1 生物炭来源及主要特征参数
1.2 仪器与设备
PHB-4型pH计,上海仪电科学仪器股份有限公司;7890A气相色谱仪,美国Agilent公司;LRH-250恒温培养箱,上海一恒科学仪器有限公司;TG-10台式离心机,四川蜀科仪器有限公司;101型鼓风干燥箱,北京中兴伟业仪器有限公司;T6新世纪分光光度计,北京普析通用仪器有限公司;RR224ZH/E电子分析天平,奥豪斯仪器有限公司。
1.3 实验方法
1.3.1 生物炭添加量及窖泥样本采集
各种生物炭添加量均为15%(质量分数),采用五点取样法对窖泥进行采样,原始窖泥样本标记为B_S;培养90 d后,未添加生物炭空白组窖泥样本标记为B_E;添加丢糟生物炭(马弗炉烧制和热解气化烧制)、玉米秸秆生物炭、稻壳生物炭、水稻秸秆生物炭、竹子生物炭的窖泥样本分别标记为ZM_E、ZR_E、YM_E、DK_E、SD_E、ZT_E。
1.3.2 理化性质分析
样品预处理:将1 g窖泥加入10 mL水中,充分摇匀,8 000 r/min离心10 min,将上清液通过20 μm滤膜转移至离心管中储存在冰箱中备用,即为样品液。
采用烘干干燥法测定窖泥含水量;使用pH计测定窖泥pH值[15];采用纳氏试剂分光光度法(HJ 535—2009)测定窖泥铵态氮含量;采用修正的Folin-Lowry法测定窖泥腐殖质含量[16];采用比色法测定窖泥有机酸含量[17]。采用固相微萃取技术结合气相色谱-质谱联用仪(solid-phase microextraction combined with gas chromatography-mass spectrometry,SPME-GC-MS)检测窖泥己酸含量。取1 g窖泥样品于25 mL顶空瓶中,加入5 mL超纯水2 g NaCl,再加入50 μL乙酸正丁酯(色谱纯)作为内标,混匀后超声振荡30 min。用萃取针在50 ℃下萃取30 min。GC条件:不分流,进样口温度230 ℃;升温程序:40 ℃保持5 min,以4 ℃/min升温至100 ℃不保持,以6 ℃/min升温至230 ℃保持10 min;MS条件:传输线温度230 ℃,电离方式为电子电离源,电子能量70 eV,离子源温度230 ℃。
1.3.3 宏基因组提取和微生物群落结构组成分析
将窖泥样品取少许于取样管中,委托上海美吉生物科技有限公司完成DNA抽提和测序。具体操作如下,抽提DNA样品,利用1%(质量分数)琼脂糖凝胶电泳检测抽提的基因组DNA,并对DNA抽提产物进行PCR扩增和纯化。采用荧光定量对PCR产物进行定量分析和均一化,建立PE文库并Illumina MiSeq双端测序,得到原始序列。其中16S rRNA扩增子引物对为515 FmodF:5′-GTGYCAGCMGCCGCGGTAA-3′,和806RmodR:5′-GGACTACHVGGGTWTCTAAT-3′,扩增区为16S rRNA的V4区[18-19]。
采用软件对测序原始序列进行质控,包括序列拼接,去除含有N的序列、引物、接头、质量值低于20的碱基、长度低于200 bp的序列及嵌合体序列得到有效序列。使用软件对有效序列进行分类,通过Illumina MiSeq平台,ASV分析流程对数据处理分析,并在物种分类水平统计每个样本的微生物群落组成。利用ASV分析结果,计算Shannon、Chao1等α多样性指数与冗余分析(redundancy analysis,RDA)等β多样性分析[15]。并完成后续的微生物群落分析。
2 结果与分析
2.1 理化性质分析
对培养90 d后人工窖泥理化参数作显著性分析(P<0.05),结果如表2所示。生物炭添加显著影响窖泥pH、含水量、腐殖质等。添加SD、YM,窖泥的pH显著提高(相比空白组高0.40和0.39),这主要是由于生物炭有较高的碱度,延缓了pH的降低。添加ZM、SD、DK窖泥含水量显著高于空白组窖泥,含水量分别提高了 4.02%、2.13%、0.68%,主要是因生物炭表面有大且丰富的孔径和醇羟基等结构锁住窖泥部分水分,提高窖泥的保水性。添加生物炭窖泥腐殖质等营养物质利用率显著提高,是由于生物炭富含OFGs,促进种间电子传递,微生物代谢加快所致。
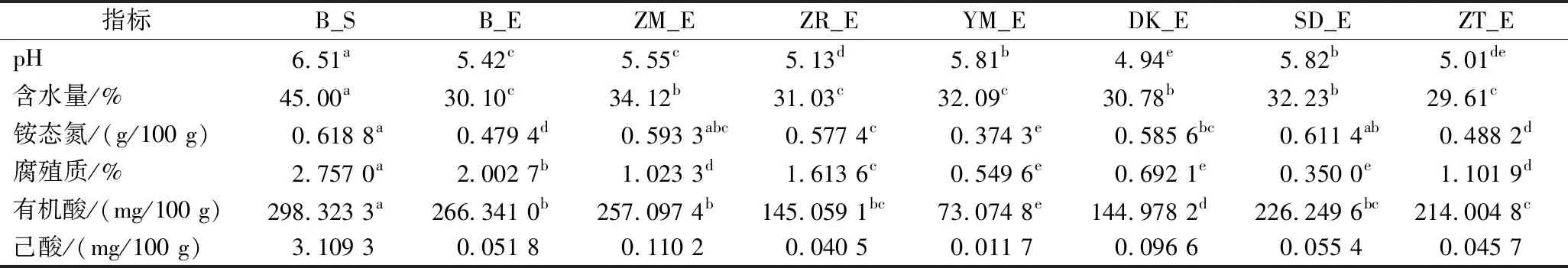
表2 人工窖泥样品理化参数
2.2 α多样性分析
如表3所示,培养90 d后的窖泥样本较原始样本丰富度指数(Chao1)降低。相较新窖泥,优质老窖泥Chao1指数会有一定程度的下降,表明人工窖泥在向老窖泥转化[20-21]。除YM和DK组外,其他生物炭添加组的物种丰富度均高于空白窖泥样本,添加SD窖泥Chao1指数相比空白组提高幅度达9.15%。除ZM组外,其余组窖泥多样性均下降。添加ZM、SD、ZR、ZT窖泥多样性Shannon指数比空白组高18.52%、12.15%、8.15%和4.81%,其中ZM组窖泥多样性最高。各组窖泥样品多样性指数随着窖龄增加总体呈上升趋势[22],且趋近于优质窖泥的多样性指数(Shannon 5.50~6.45)[15]。表明添加生物炭,能够使适应环境的微生物种群得到更好的富集并成为稳定的优势种群[23]。这可能是由于生物炭拥有丰富的多孔结构和OFGs,提高了人工窖泥丰富度和多样性的同时,加快微生物的富集。
2.3 β多样性分析
如图1-a所示,所有窖泥在属水平上共有55种。其中主要是Caproiciproducens(19.87%)、Clostridium_sensu_stricto_12(16.26%)为己酸菌和梭状芽孢杆菌(图1-b)。说明这共有属如Caproiciproducens和Clostridium_sensu_stricto_12是窖泥中重要的功能微生物,共同主导窖泥培养的正常进行。
如图2所示,添加生物炭后人工窖泥优势功能微生物属得到富集,重要的功能优势古生菌Methanosarcina[22,24]也得到富集。对比空白组窖泥,除YM组外,其他添加生物炭组窖泥Caproiciproducens和Clostridium_sensu_stricto_12等优势功能菌属相对丰度都有明显增加。对比不同生物炭,添加DK窖泥组的Caproiciproducens菌属、DK、ZM、ZR窖泥Clostridium_sensu_stricto_12菌属均高于空白和原始组窖泥样本。同时Lactobacillus菌属相对含量较空白组都有降低,添加ZM窖泥Lactobacillus菌属相对丰度更少,这是由于己酸菌、梭菌产生己酸等抑制了部分Lactobacillus生长[25]。说明添加ZM组窖泥微生物富含较为丰富的Caproiciproducens外,有利于Clostridium_sensu_stricto_12和Methanosarcina等优势菌生长,同时抑制Lactobacillus生长效果更明显,能加快人工窖泥向优质老窖泥转化。这可能是生物炭拥有丰富的OFGs,促进了种间电子传递,加快了微生物生长代谢。
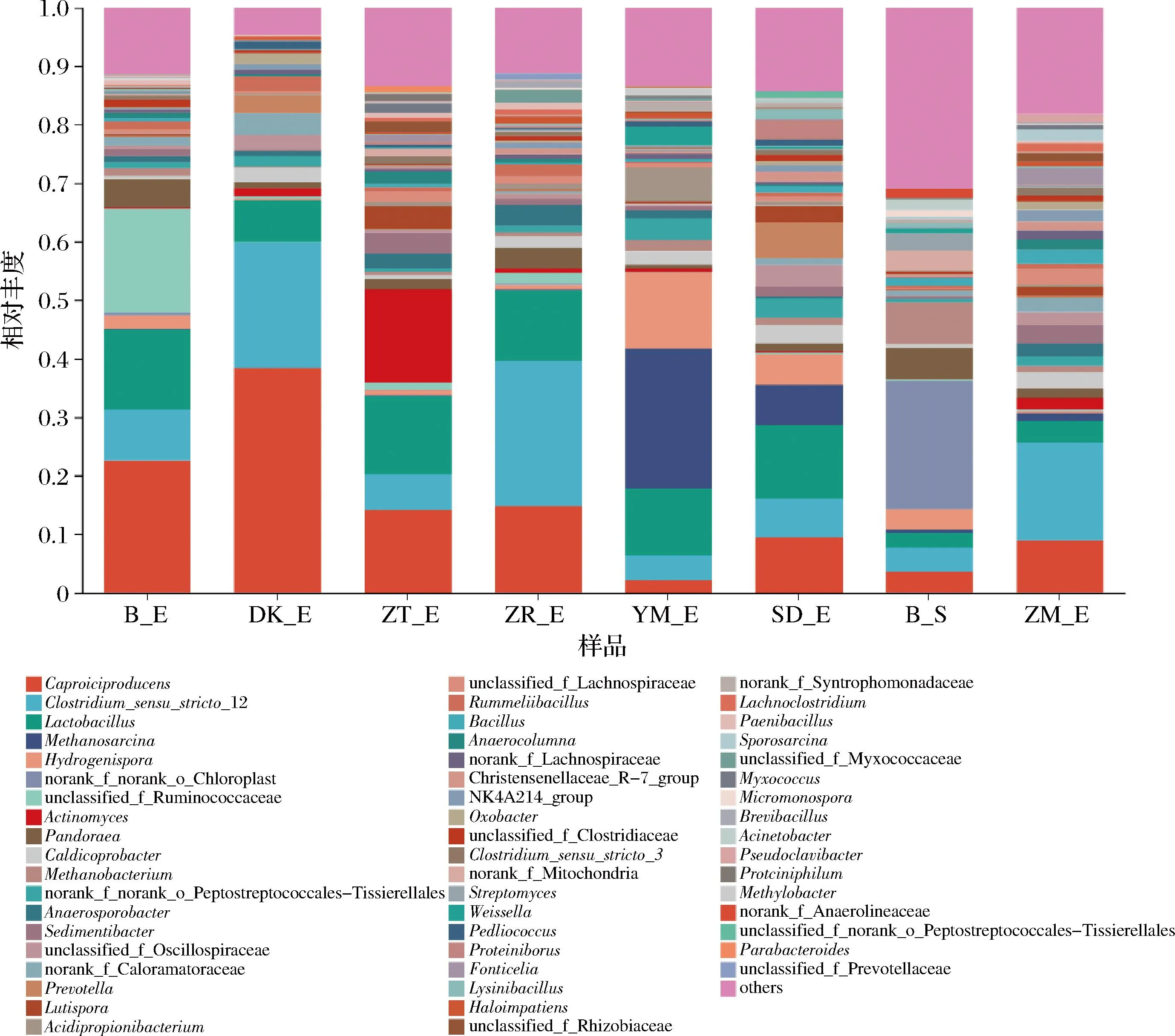
图2 各窖泥样品中相对丰度前50属水平微生物种群柱状图
通过热图进一步分析窖泥微生物属种,结果如图3所示。所有微生物属分别隶属于8个门,主要分布在Firmicutes。其中Caproiciproducens、Clostridium_sensu_stricto_12、Lactobacillus为窖泥中的优势菌属,与已报道四川酒企的窖泥中优势菌属类有高度的一致性[15]。

图3 各样品窖泥相对丰度前50属水平微生物种群热图
如图3所示,聚类分析结果表明,原始窖泥样本为单独一大簇(Ⅰ),培养后的窖泥为另一大簇(Ⅱ)。培养90 d后YM、SD分为一个亚簇,ZM、DK、ZR分为一个亚簇,B、ZT又分为一个亚簇。表明窖泥培养后在微生物属种上具有差异性。除ZT外,其他生物炭添加窖泥组较空白组在微生物属种上差异显著。原始窖泥样本中存在丰度较高的norank_f__norank_o__Chloroplast等微生物属,在窖泥研究的文献中其功能并不明确。在添加生物炭培养后,这类微生物相对含量明显减少甚至消失。添加ZM、DK、ZR窖泥培养后有相似的微生物组成,与Caproiciproducens和Clostridium_sensu_stricto_12有较强的相关性,与Myxococcus和Sporosarcina菌属则呈显著负相关。YM、SD窖泥中则与Acidipropionibacterium和Weissella等菌呈著正相关,表明添加ZM、DK、ZR的窖泥与酿酒重要优势功能微生物有更强相关性,和Lactobacillus相关性更弱。此类生物炭表面孔径更丰富更密集,表面OFGs更多,对人工窖泥理化性质和微生态环境调节效果更好,更有利于加快人工窖泥向优质老窖泥转化。
2.4 窖泥微生物群落网络相关性分析
根据Spearman相关性(|ρ|>0.6,P<0.05),分析分类学总丰度前50的物种,结果如图4-a所示。这些微生物共49个节点,所有节点都隶属于8个门,主要集中在Firmicutes,占所有节点的71%。各窖泥样品中共存在5个枢纽,都属于Firmicutes,在网络中十分重要(图4-a)。在添加生物炭培养后,窖泥中微生物分为了2个模块,其中1个是以Firmicutes为主的主体部分,占了网络相关性中绝大部分,Clostridium_sensu_stricto_12和Caproiciproducens在网络中最为重要,它们都是己酸菌且呈正相关,这与已有文献报道一致[22]。添加生物炭不会使窖泥微生态稳定性变差或退化,不会受到Lactobacillus等微生物对窖泥网络平衡造成的影响。
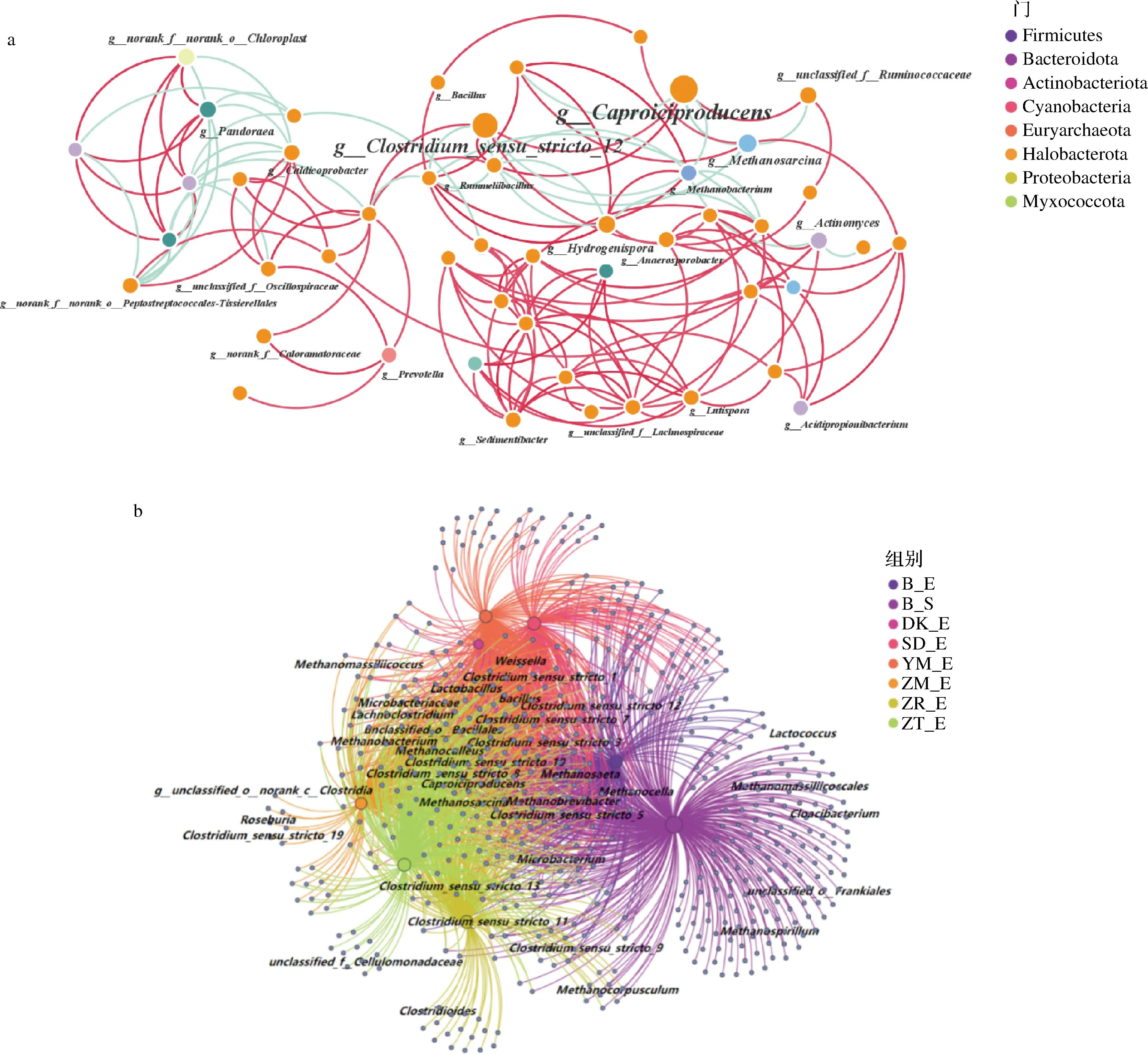
a-水平微生物网络相关性图;b-共线性网络图
共线性网络如图4-b所示,不同生物炭添加,对培养后人工窖泥中微生物组成会造成明显差异。原始窖泥样本独有属种种类较多,添加生物炭会抑制这些微生物生长,并促进Caproiciproducens、Clostridium、Bacillus、Methanobacterium等菌属富集。添加ZM窖泥组与Clostridium_sensu_stricto_19、Roseburi和g__unclassified_o__norank_c__Clostridia有较强的相关性,此类微生物都是在酿酒过程中能起到重要作用的梭菌。ZR、ZT窖泥组与Clostridium_sensu_stricto_11有较强的相关性。DK则没有与特有的功能微生物有强相关性,多样性不强。这可能是由于ZM等拥有更丰富的OFGs增强了种间电子传递效率,富集了更多种类的酿酒功能微生物。同时也表明己酸菌作为窖泥中关键的微生物,能联系其他微生物从而带动整个窖泥正常运行[26-27]。
2.5 窖泥微生物群落与理化因子相关性分析
基于窖泥核心菌群与理化性质的RDA,结果如图5-a所示。理化因子对RDA1和RDA2解释度依次是pH(99.67%)>有机酸(86.05%)>腐殖质(75.25%)>水分(49.61%),其中pH和含水量与微生物群落结构呈现极显著关系(P<0.01),添加不同生物炭的窖泥也被明显区分。图5-a表明,添加生物炭主要与pH、含水量和铵态氮等具有相关性,而pH和含水量是提高窖泥质量的主要驱动力[28-29],添加生物炭有利于提升窖泥质量。添加YM、SD主要影响窖泥pH,ZM、ZR主要影响窖泥含水量,DK、ZR则主要影响窖泥铵态氮和己酸。微生物影响方面,添加生物炭主要与窖泥内Caproiciproducens、Clostridium_sensu_stricto_12、Methanobacterium和Hydrogenispora有显著相关性。添加ZR、ZM和DK与Clostridium_

a-冗余分析;b-热图
sensu_stricto_12呈正相关。ZR和DK与Caproiciproducens呈正相关。YM、SD和ZM窖泥则与Methanobacterium和Hydrogenispora呈正相关性。说明添加生物炭能影响窖泥优势功能微生物的生长,添加ZR、ZM和DK影响窖泥Clostridium_sensu_stricto_12菌属的富集,ZR和DK影响窖泥Caproiciproducens菌属的富集。同时含水量、pH、铵态氮与Lactobacillus呈负相关,这与毕天然等[30]研究相符。pH及乳酸菌分别与大部分菌群和梭菌呈负相关,这与吴浪涛[26]的研究相符。但铵态氮、腐殖质与窖泥细菌有较强的相关性,与pH、含水量有负相关,这与较多学者的研究结果有差异[29-32]。
理化性质与微生物相关性热图如图5-b所示。pH、含水量和腐殖质与微生物呈显著相关性。pH降低与Methanobacterium呈极显著相关,而Methanobacterium产甲烷菌系是窖泥中功能古菌[23,33]。含水量和pH降低与Caproiciproducens和Clostridium_sensu_stricto_12呈负相关性。所以pH带来窖泥质量的影响可能与Methanobacterium有关。添加生物炭提高窖泥保水性并延缓pH降低,较高的含水量和偏中性的pH更有利于窖泥质量提高。
3 结论
本研究利用高通量测序技术研究添加不同生物炭对人工窖泥培养过程中微生物群落的影响,结果表明添加ZM窖泥含水量比空白组窖泥高4.02%,含水量提高有利于加快人工窖泥向优质窖泥的转化。添加ZM窖泥Shannon指数比空白组提高18.25%,多样性更趋近于优质老窖泥的多样性指数(Shannon 5.50~6.45)。添加ZM组能保证Caproiciproducens丰富度较高情况下,促进Clostridium_sensu_stricto_12等窖泥内产己酸功能微生物富集,其相对含量较空白组提高了7.99%,同时抑制Lactobacillus等对窖泥质量有不利影响的微生物生长,其相对含量较空白组减少了10.10%。RDA结果表明添加ZM与Clostridium_sensu_stricto_12有正相关性,且与Lactobacillus显著负相关。本研究为生物炭应用于人工窖泥向优质老窖泥转化提供了微生物学理论基础。
