水产品中氯霉素酶联免疫吸附分析法的构建与应用
2023-12-16蔡丹凤姚天择郎一涵傅炎勇申屠旭萍俞晓平
张 彪,蔡丹凤,姚天择,郎一涵,傅炎勇,申屠旭萍,俞晓平
(1 中国计量大学生命科学学院 杭州310018 2 杭州铭治医学检验实验室有限公司 杭州 310020)
氯霉素(Chloramphenieol,CAP)作为广谱抑菌抗生素,曾作为特效药应用于治疗人类的伤寒、副伤寒及敏感菌所致的严重感染性疾病[1],也曾作为畜禽和水产养殖投入品,多用于畜禽、水产品中厌氧菌感染和敏感微生物所致各种感染性疾病[2-4]。消费者长期使用氯霉素易引起造血系统、消化系统及神经系统疾病;氯霉素残留易诱发致病菌的耐药性,且经食物链被摄入消费者体内后,长期慢性积累后具有潜在的危害[5-7]。因此,欧美等国家已明令禁止使用氯霉素,我国农业农村部也相继发布并完善了《食品动物禁用的兽药及其它化合物清单》《动物性食品中兽药最高残留限量》,规定氯霉素不得用于食品和动物,动物性食品中不得检出氯霉素[8-9]。然而,由于利益的驱使以及检测难度大,动物性食品特别是水产品中氯霉素非法使用问题未得到有效控制和解决,仍然较为突出。因此开发一种操作简单、检测快速、高效灵敏的氯霉素分析方法显得极为重要。
目前,氯霉素的分析方法主要有高效液相色谱法(HPLC)[10]、气相色谱法(GC)[11]、液质联用法(LC-MS/MS)[12]、气质联用法(GC-MS)[13]、微生物法[14]和酶联免疫分析法[15-17]。液相与气相色谱法分析氯霉素,检测样本少,难以实现大规模样品检测;与前两种色谱法相比,液质联用法和气质联用法虽然灵敏度高,检测限低,但需要专业化人员操作,仪器成本和维护费用昂贵,不宜大规模应用;微生物法操作时间长且误差大,灵敏度不高,难以大规模普及应用[18-19]。因此,急需开发一种检测成本低、检测效率高的氯霉素快速检测方法。
近年来,抗体-抗原免疫分析技术因具有灵敏度高、检测成本低、产品可商业化及可实现现场即时检测等优点,而成为最具有发展和应用前景的痕量分析技术之一[20]。本研究利用氯霉素抗体与抗原,系统优化工作条件,构建氯霉素的间接竞争酶联免疫吸附测定法(ic-ELISA),并应用水产品中氯霉素残留量的快速检测,以期为其它小分子目标物酶联免疫吸附测定法的开发,动物性食品中氯霉素的快速检测提供高效的检测手段。
1 材料与方法
1.1 材料与仪器
氯霉素,德国Dr.Ehrenstorfer 公司;氯霉素抗体,天津泰进科技有限公司;卵清白蛋白(OVA)、牛血清白蛋白(BSA)、过氧化氢脲、3,3',5,5'-四甲基联苯胺(TMB),Sigma 公司;氯霉素包被原(CAP-OVA)实验室制备;其它试剂均为分析纯级。
Genics 酶标仪,TECAN 公司;96 孔酶标板,丹麦Nunc 公司;Millipore/Rios8 超纯水系统,法国Millipore 公司;CP80WX 超速离心机,日本日立公司。
1.2 试验方法
1.2.1 包被原添加量和抗体稀释倍数的优化 96微孔板每孔包被原的添加量依次为0.01,0.05,0.10 μg,抗体稀释倍数为1∶2 000,1∶4 000,1∶6 000,1∶8 000,1∶12 000,1∶16 000,1∶24 000,1∶32 000,二抗稀释倍数为1∶1 000,进行组合试验,加入底物溶液显色后,利用酶标仪测定不同条件下在波长450 nm 处的OD 值,并按照式(1)计算抑制率[21]。
1.2.2 包被原包被条件与封闭液的优化 在1.2.1节试验结果上,分别选4 ℃-12 h,4 ℃-14 h,4℃-16 h,37 ℃-2 h,37 ℃-3 h,37 ℃-4 h 6 种方式进行包被原包被,测定不同条件下OD 值,并计算IC50值;然后分别选0.5%脱脂乳粉,1.0%脱脂乳粉,0.5% BSA,1.0% BSA,0.5%明胶和1.0%明胶进行封闭液优化试验。
1.2.3 氯霉素间接竞争酶联免疫分析方法(ic-ELISA)的构建 竞争反应时间及温度,酶标二抗反应时间等参考前期工作[22]。ic-ELISA 方法的构建步骤如下[22]:在最佳包被条件下,包被原包被96微孔(100 μL/孔);磷酸盐缓冲液(PBST)洗板3次,200 μL/孔封闭液37 ℃封闭1 h;PBST 洗板3次,加入梯度标准或5 倍稀释样品提取液(50 μL/孔)和抗体(50 μL/孔),37 ℃孵育1 h;PBST 洗板4 次,加入酶标二抗(100 μL/孔),37 ℃孵育0.5 h;PBST 洗板5 次,加入底物37 ℃显色15 min,1.25 mol/L 硫酸(50 μL 孔)终止反应,测定波长450 nm 处OD 值,计算不同标准品的抑制率,以氯霉素质量浓度为横坐标,抑制率为纵坐标拟合S 型标准曲线,根据标准曲线获得本方法的灵敏度(IC50)和检测限(IC15)。
1.2.4 氯霉素ic-ELISA 特异性评价 选取氯霉素结构类似物(氟苯尼考、甲砜霉素)和孔雀石绿、隐色孔雀石绿、恩诺沙星、诺氟沙星、磺胺甲恶唑、磺胺二甲嘧啶、四环素、沙丁胺醇、庆大霉素、甲硝唑、结晶紫等11 种同类抗生素进行方法特异性评价,评价的指标为交叉反应率,计算方法见式(2)[22]。
1.2.5 氯霉素ELISA 的稳定性和应用性评价 日内和日间变异系数(CV)评价方法的稳定性[23],选取大黄鱼、缢蛏、牛蛙等水产品进行方法应用性评价。样品处理如下[3]:首先准确称取2.0 g 肌肉样品,加入到含6.0 mL 乙酸乙酯中,充分振荡5 min,5 000 r/min 离心5 min 后,取3.0 mL 上清液,50 ℃下氮气吹干,依次加入2.0 mL PBS 溶液和2.0 mL 正己烷均涡旋60 s,5 000 r/min 离心5 min 后,取下层水相用于分析。样品加标水平为5.0,10.0,20.0 μg/kg。LC-MS/MS 检测氯霉素的样品处理和分析条件参考GB/T 20756-2006 《可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定 液相色谱-串联质谱法》[24]。
2 结果与讨论
2.1 包被原添加量和抗体稀释倍数的优化
包被原添加量和抗体的稀释倍数是影响酶联免疫吸附分析法灵敏度和检测限的重要因素之一[25]。试验结果如图1 所示,每孔的包被量相同,随着抗体稀释倍数增加,OD 值和IC50值整体呈现下降趋势;当每孔包被原包被量为0.05 μg,抗体稀释倍数为1∶16 000 时,IC50值最小,OD 值为0.84,因而选择每孔包被量为0.05 μg,抗体稀释倍数为1∶16 000 进行后续研究。

图1 包被量与抗体稀释条件的优化Fig.1 Optimization of coating antigen amount and antibody dilution conditions
包被原包被条件和封闭液的种类及浓度是影响酶联免疫分析方法灵敏度(IC50)的重要因素[25]。如图2 所示,不同包被条件的OD 值差异显著(P<0.05),其中包被条件为4 ℃-14 h,4 ℃-16 h,37 ℃-3 h,37 ℃-4 h 时,IC50值较低,且IC50值差异不显著(P>0.05),变异系数小于4.53%,说明上述的包被条件下方法的稳定性好,结合检测时间和实际情况考虑,本研究选择包被条件为4 ℃-14 h 进行后续试验。如图3 所示,选取BSA和明胶封闭时,IC50值高于同质量分数的脱脂乳粉,差异极显著(P<0.01);0.5%脱脂乳粉为封闭液,IC50值最低。因此封闭液选择0.5%脱脂乳粉。
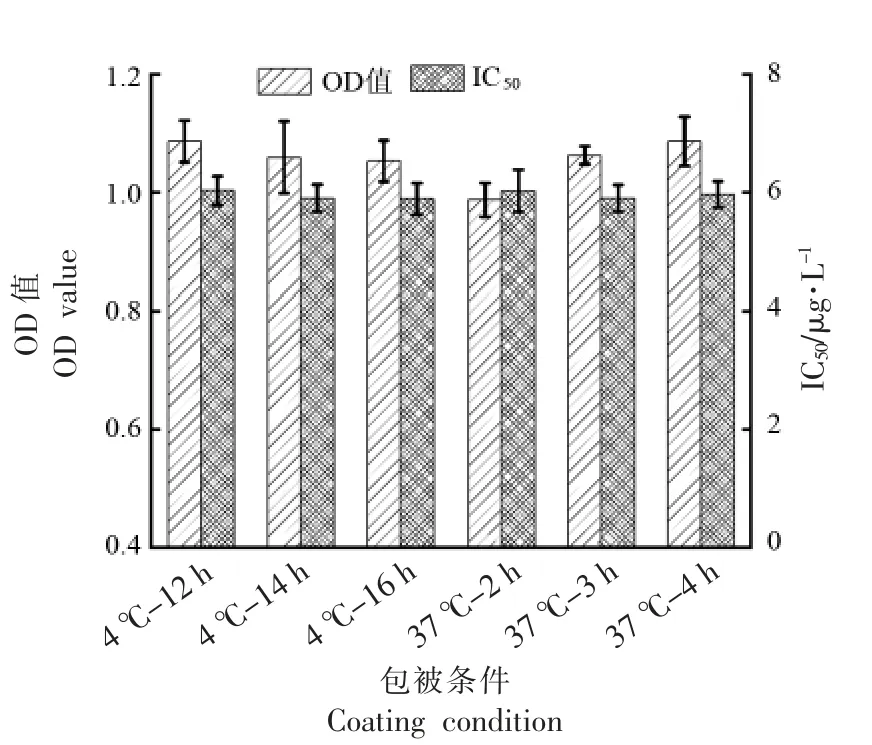
图2 包被条件的优化Fig.2 Optimization of temperature and time of coating condition

图3 封闭液种类的优化Fig.3 Optimization of the type of blocking solution
2.2 氯霉素ic-ELISA 标准曲线的构建
经过上述试验条件的优化,构建氯霉素ic-ELISA 最佳工作条件:包被量为0.05 μg/孔,包被条件为4 ℃-14 h,0.5%脱脂乳粉为封闭液,抗体稀释倍数为1∶16000。如图4 所示,本研究构建的氯霉素的“S”型标准曲线的方程为y=98.6856+(11.3477-98.6856)/[1+(x/6.1134)1.0235](R2=0.9994),计算得灵敏度IC50=(4.88±0.33)μg/L,检测限IC15=(0.29±0.13)μg/L。

图4 氯霉素ic-ELISA 方法标准曲线Fig.4 Standard curve of CAP by ic-ELISA
2.3 氯霉素ic-ELISA 方法特异性评价
为进一步验证氯霉素ic-ELISA 方法的有效性,本研究通过交叉反应率进行氯霉素ic-ELISA 特异性评价[26]。如表1 所示,氯霉素ic-ELISA 方法结果分析表明,氟苯尼考、甲砜霉素、孔雀石绿、隐色孔雀石绿、恩诺沙星、诺氟沙星、磺胺甲恶唑、磺胺二甲嘧啶、四环素、沙丁胺醇、庆大霉素、甲硝唑和结晶紫的交叉率低于0.1%,说明氯霉素抗体不能识别氯霉素的结构类似物和11 种同类抗生素,构建的氯霉素ic-ELISA 方法特异性良好。

表1 交叉反应率检测结果Table 1 The detection results of cross-reaction rate
2.4 氯霉素ic-ELISA 方法稳定性和应用性评价
本研究采用日内和日间变异系数评价氯霉素ic-ELISA 方法的稳定性,实际样品检测和加标回收评价氯霉素ic-ELISA 方法的应用性。如表2 所示,氯霉素ic-ELISA 方法的日内变异系数(CV)在2.28%~4.63%之间,日间CV 值在3.56%~6.96%之间,LC-MS/MS 方法CV 值在0.69%~1.94%之间,构建的氯霉素ic-ELISA 方法稳定性良好。对大黄鱼、缢蛏、牛蛙样品中氯霉素进行检测,仪器分析与本方法均未检测到本底浓度,样品中添加5.0,10.0,20.0 μg/kg 3 个水平,加标回收试验结果表明,ic-ELISA 方法对氯霉素回收率在83.90%~100.73%之间。对ic-ELISA 和LC-MS/MS 进行氯霉素检测结果进行线性回归分析(图5),日内(日间)检测数据与LC-MS/MS 检测数据相关系数R2=0.9924(R2=0.9793),说明ic-ELISA 检测结果与LC-MS/MS 检测结果具有很好的一致性。本文构建的氯霉素ic-ELISA 方法,稳定性良好,可应用于水产品中氯霉素含量的检测。
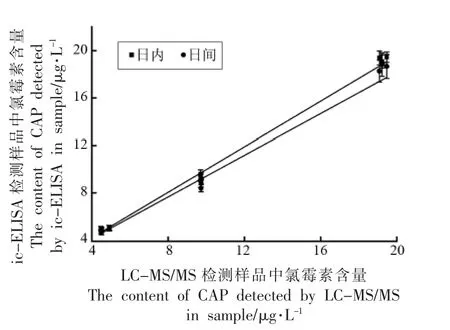
图5 ic-ELISA 与LC-MS/MS 检测结果相关性分析Fig.5 Correlation analysis of detection results between ic-ELISA and LC-MS/MS

3 结论
本文以食品动物禁用兽药氯霉素为研究对象,系统优化间接竞争酶联免疫分析(ic-ELISA)方法的包被原添加量、抗体稀释倍数、包被条件、封闭液种类等工作参数,建立ic-ELISA 方法。所构建氯霉素ic-ELISA方法,灵敏度为(IC50)4.88 μg/L,检测限(IC15)为0.29 μg/L,本方法只特异性识别氯霉素,不能识别结构类似物和同类抗生素,交叉反应率均低于0.1%。 本文构建的氯霉素ic-ELISA对大黄鱼、缢蛏、牛蛙添加回收率范围为83.90%~100.73%,变异系数(CV)范围为2.28%~6.96%, 检测结果与LC-MS/MS检测结果具有较好的一致性。 综上所述,本文构建的氯霉素ic-ELISA 方法,可应用于水产品中氯霉素残留进行准确检测,为食品安全提供一份保障。同时,本方法为禁止使用的农兽药残留、生物毒素、非法添加剂以及其它食品危害因子间接竞争酶联免疫分析方法开发与应用提供技术参考。
