体外探针法评价五味子和南五味子提取物对人肝微粒体CYP3A4酶活性的影响❋
2023-12-15林路洁,张明晓,李化等
五味子是木兰科植物五味子Schisandrachinensis(Turcz.)Baill.的干燥成熟果实,习称“北五味子”,而南五味子为木兰科植物华中五味子SchisandrasphenantheraRehd.et Wils.的干燥成熟果实。五味子和南五味子均具有益气生津、补肾宁心、收敛固涩的作用,临床应用广泛。《中国方剂数据库》收载了含五味子的方剂631首[1],同时还可见多种相关的成方制剂和单方制剂上市销售[2-3]。五味子和南五味子由于在保肝、调节中枢神经系统和心血管系统等方面治疗效果显著,临床上经常与其他药物联合使用。前人研究已发现五味子和南五味子在联合用药时,容易发生药效、代谢方面的相互作用[4-7]。吴静静等[8]借助网络药理学的研究方法,建立了疾病-基因和中药活性成分-蛋白质靶标的相互作用网络,由此阐明了五味子配伍枸杞子治疗儿童注意缺陷多动障碍症的药效作用机制。
细胞色素P450(cytochrome P450,CYP450)的诱导或抑制作用是导致药物代谢的相互作用的主要因素(约占70%)[9-11]。CYP3A(cytochrome P450 3A)占CYP450总含量的50%以上,参与50%~70%的药物代谢[12]。药物代谢学研究发现,五味子提取物及其所含的单一木脂素成分均对CYP3A酶的活性呈现了不同程度的诱导作用或抑制作用,如Brandin等[13]发现五味子醇提取物具有诱导CYP3A4酶活性的作用;陈倩等[14]的实验结果表明五味子对CYP3A 酶活性呈现抑制和诱导双重作用;Iwata等[15]发现五味子醇乙、五味子酯甲、五味子酯乙、戈米辛B、戈米辛C、戈米辛G、戈米辛N等单一木脂素成分对cytochrome P450 3A4(CYP3A4)具有不同程度的抑制作用;李维亮等[16]研究发现五味子乙素在体外可抑制CYP3A活性。但迄今为止,尚未有人比较研究五味子和南五味子提取物对CYP450酶活性的影响作用。
体外肝微粒体结合探针药物的方法是评价药物影响CYP450酶代谢的经典方法之一[17]。该法通常是在肝微粒体中加入CYP450探针药物(如睾酮或咪达唑仑)进行温孵,然后检测探针药物的代谢物的生成量,由此评估CYP450酶活性的影响程度[18-20]。为此,在本实验中,采用人肝微粒体体外温孵法,通过高效液相色谱-串联质谱技术(liquid chromatography tandem-mass spectrometry,HPLC-MS/MS)检测CYP3A4探针药物睾酮的代谢物6β-羟基睾酮含量,考察南、北五味子提取物、主要木脂素成分对CYP3A4酶活性的影响,以预测其联合用药时可能发生的药物代谢方面的相互作用,为五味子和南五味子在临床上安全、合理用药提供实验依据。
1 材料
1.1 仪器
Agilent 1290-AB QTRAP4500三重四级杆-线性离子阱液质联用仪(含自动进样器、在线脱气机、柱温箱、二元泵、ESI离子源、三重四极杆-离子肼质谱分析器和检测器),美国Agilent 公司;QYC-200型恒温摇床,中国上海福玛实验设备有限公司;MS3型涡旋混合器,德国IKA公司;SIGMA3-18K型高速低温离心机,德国Sigma公司。
1.2 药材
南五味子(SchisandrasphenantheraRehd.et Wils.)和五味子(Schisandrachinensis(Turcz.)Baill.)购于北京市同仁堂科技有限公司,经中国中医科学院中药研究所李化研究员鉴定。南五味子和五味子醇提物浸膏和水提物浸膏由本课题组自制(浸膏得率依次为34%、38%、20%和23%)。
1.3 试剂
睾酮、6β-羟基睾酮均购自上海甄准生物科技有限公司,货号分别为ZC-55873、IR-12693;烟酰胺腺嘌呤二核苷酸磷酸二钠(reduced coenzyme Ⅱ tetrasodium salt,NADP-Na2)购自北京索莱宝科技有限公司,货号为718B0225;烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide,NADPH)再生系统(-80℃冷冻保存)购自武汉普来特生物医药技术有限公司,A液货号为NRS001、B液货号为NRS002;五味子醇甲(纯度>98%)、五味子酯甲(纯度>98%)、五味子甲素(纯度>98%)、五味子乙素(纯度>98%)对照品,均购自成都曼斯特生物科技有限公司,货号分别为Must-13061206、Must-13110606、Must-13080205、Must-13091606;色谱级甲醇和色谱级乙腈购自美国Fisher公司,货号分别为206403和204681;超纯水由Milli-Q型超纯水制备仪(法国Millipore公司)制备。
1.4 细胞
混合人源性肝微粒体(THP)购自上海瑞德肝脏疾病研究所,于-80 ℃冷冻保存。
2 方法
2.1 溶液的配制
2.1.1 6β-羟基睾酮贮备液及其系列梯度稀释溶液的配制 取6β-羟基睾酮对照品适量,精密称定,用甲醇定容至10 mL棕色量瓶中,摇匀,得到质量浓度为1.0 mg/mL的6β-羟基睾酮贮备液。于4 ℃冰箱中密封保存,备用。临用前,用甲醇逐级稀释至相应质量浓度,得到6β-羟基睾酮系列梯度稀释标准溶液。
2.1.2 内标贮备溶液及内标稀释溶液的配制 取对乙酰氨基酚对照品适量,精密称定,用甲醇定容至10 mL棕色量瓶中,摇匀,得到质量浓度为0.96 mg/mL内标贮备溶液。于4 ℃冰箱中密封保存,备用。临用前,用甲醇稀释至质量浓度为50 μg/L的内标稀释溶液。
2.1.3 NADPH-Na4溶液的配制 取NADPH-Na4适量,精密称定,用磷酸缓冲溶液(phosphate buffered saline,PBS)溶解,制得质量浓度为2 mmol/L的NADPH-Na4溶液。临用前配制。
2.1.4 提取物溶液的配制 取五味子和南五味子水提物浸膏和醇提物浸膏适量,精密称定,分别置4个10 mL量瓶中,其中水提物干膏用超纯水溶解并定容,醇提物干膏用少量二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,然后加超纯水定容至刻度,DMSO含量不得超过1%,配制得到相应浓度的提取物溶液。将上述每种提取物溶液分别稀释成7.5、15、30 mg/mL的溶液,于4 ℃冰箱中密封保存,备用。
2.1.5 五味子木脂素单体成分溶液的配制 取五味子醇甲、五味子酯甲、五味子甲素、五味子乙素适量,精密称定,分别置4个10 mL量瓶中,加少量甲醇溶解,然后加超纯水定容至刻度,依次得到质量浓度为0.208、0.373、0.217、0.258 mg/mL的五味子醇甲、五味子酯甲、五味子甲素、五味子乙素对照品溶液。并将上述每种对照溶液分别稀释成25、50、100 μmoL/L的溶液,于4 ℃冰箱中密封保存,备用。
2.2 色谱条件
Agilent ZORBAX Eclipse Plus C18柱(2.1×100 mm,3.5 μm);流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱,0~1.5 min,10%~40%B,1.5~3.5 min,40%~75%B,3.5~4 min,75%~75%B,4~6 min,75%~10%B,流速0.4 mL/min;柱温30 ℃;进样量2 μL。
2.3 质谱条件
离子源采用电喷雾离子源,离子化电压5.5 kV;离子源温度为550 ℃;气帘气为241 kPa;喷雾气为350 kPa;辅助加热气为310 kPa,以多反应监测模式进行正离子扫描,用于定量分析的监控离子为m/z152.00~109.70(对乙酰氨基酚,内标),m/z305.20~269.00(6β-羟基睾酮)。采用上述条件检测6β-羟基睾酮的含量。
2.4 样品孵育
参考文献[18]建立孵育体系。孵育体系总体积为100 μL,包含1 mg/mL的人肝微粒体、2 mmol/L的NADPH、10 μmol/L的睾酮溶液、待测样品10 μL、PBS缓冲液,加入顺序为人肝微粒体、PBS缓冲液、睾酮溶液和待测样品(提取物溶液/木脂素溶液),体系中有机相含量应小于1%。待加入缓冲液、睾酮、人肝微粒体后,于37 ℃预孵5 min,再加入NADPH-Na4启动反应,37 ℃恒温震荡(150 r/min)5 min后,立即向体系中加入100 μL含50 μg/L的对乙酰氨基酚冰乙腈终止反应。
样品的处理:取上述温孵后的反应体系涡旋混匀1 min后,置于-20 ℃冰箱5 min,再离心10 min(16 000×g,4 ℃),取上清液,按上述检测条件进行LC-MS/MS分析。
3 结果
3.1 方法学考察
3.1.1 专属性考察 分别取空白人肝微粒体加入6β-羟基睾酮标准液和对乙酰氨基酚内标液温孵后,按2.4项下操作后,进样,得到相应的色谱图,见图1。结果显示,内标(对乙酰氨基酚)和6β-羟基睾酮的保留时间分别为1.50 min和2.61 min,各峰达到基线分离,空白人肝微粒体中无内源性杂质的干扰,方法专属性良好。
3.1.2 标准曲线的制备 在空白温孵液中分别加入系列6β-羟基睾酮稀释标准溶液(15、30、60、120、240、480、960.0 μg/L)和内标溶液,按照2.4项下方法进行处理,取上清液进样检测,记录6β-羟基睾酮峰和内标峰的峰面积,以二者的峰面积比为纵坐标(Y),相应的6β-羟基睾酮质量浓度为横坐标(X),进行加权线性回归(权重=1/X2),得到标准曲线方程为Y= 0.311 1X+ 2.616 5,r= 0.999 9结果表明6β-羟基睾酮在15.0~960 μg/L线性关系良好。
3.1.3 日内和日间精密度试验 在空白温孵液中加入低、中、高3个浓度(15.0、240、960.0 μg/L)的6β-羟基睾酮,每个浓度各5份,连续测定3天,计算6β-羟基睾酮峰和内标峰的峰面积比值、日内和日间精密度以及其相对标准偏差(relative standard deviation,RSD)。结果低、中、高浓度日内精密度RSD%分别为8.5%、4.5%、5.8%;日间精密度RSD%分别为10.3%、5.6%、4.8%;日内和日间精密度均小于11%,见表1,表明日内和日间精密度良好。

表1 人肝微粒体中6β-羟基睾酮的精密度和提取回收率实验结果(n=5)
3.1.4 提取回收率试验 在空白温孵液中加入低、中、高3个浓度(15.0、240.0、960.0 μg/L)的6β-羟基睾酮,每个浓度各5份,进样记录峰面积,计算6β-羟基睾酮峰和内标峰的峰面积比值、提取回收率以及其RSD。结果显示低、中、高提取回收率分别为102.1%±5.4%,105.2%±4.9%,105.7%±4.1%,RSD均小于11%,见表1,表明回收率良好。方法学验证的结果表明,该方法特异性、精密度和准确度等均符合本实验的要求。
3.2 五味子和南五味子提取物对人CYP3A4酶活性影响
按照“2.4”项下方法向孵育体系中分别加入低、中、高浓度(7.5、15、30 g/L)五味子和南五味子水提取物溶液、五味子和南五味子醇提取物溶液与睾酮溶液共同孵育,并设置不加五味子提取物的空白对照组,各浓度样品平行操作3次,采用LC-MS/MS检测相应代谢产物6β-羟基睾酮的生成量。以6β-羟基睾酮的生成速率作为酶活性指标,用V(mmol/min/mg)表示,其中,C为各样品组中6β-羟基睾酮生成量(mmoL/L),Cpro为微粒体蛋白质量浓度(mg/mL),t为孵育时间(min),计算公式为V=1 000×0.2×C/(t×Cpro)。
各样品组酶活性的测定结果如表2所示。五味子和南五味子醇提物和水提物在高中低三个浓度条件下,对CYP3A4酶活性均有抑制作用,呈浓度依赖性,且南、北五味子醇提物较水提物抑制程度更明显。五味子水提物和醇提物抑制人CYP3A4酶活性的能力强于南五味子水提物和醇提物。
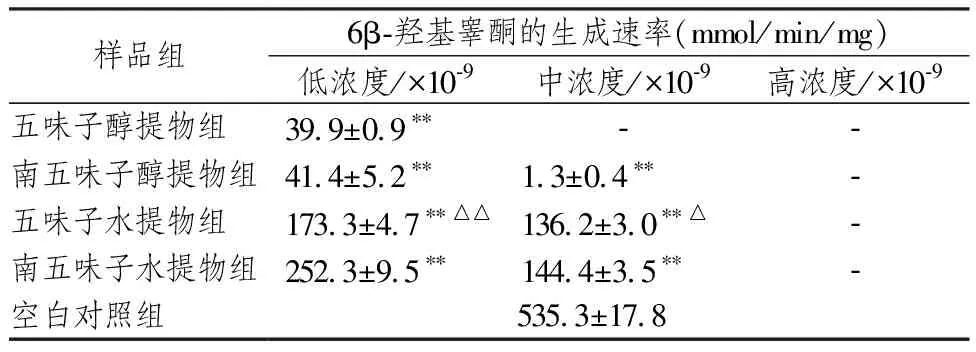
表2 五味子和南五味子醇提物和水提物对人CYP3A4酶活性的影响
3.3 五味子醇甲、五味子酯甲、五味子甲素和五味子乙素对人CYP3A4酶活性的影响
按照2.4项下方法向孵育体系中分别加入低、中、高浓度(25、50、100 μmoL/L)五味子醇甲、五味子酯甲、五味子甲素和五味子乙素对照品溶液与睾酮溶液共同孵育,并设置不加上述活性成分的对照组,各浓度样品平行操作3次,采用LC-MS/MS检测相应代谢产物6β-羟基睾酮的生成量。以6β-羟基睾酮的生成速率作为酶活性指标,用V(mmol/min/mg)表示,其中,C为各样品组中6β-羟基睾酮生成量(mmoL/L),Cpro为微粒体蛋白质量浓度(mg/mL),t为孵育时间(min),计算公式为V=1 000×0.2×C/(t×Cpro)。
各样品组酶活性的测定结果见表3。在人肝微粒体实验中,在五味子醇甲、五味子酯甲,五味子甲素,五味子素等单一木脂素成分的高、中、低三个浓度条件下,上述木脂素成分对CYP3A4酶活性都有不同程度的抑制效果,随浓度的增加抑制作用愈明显。其抑制能力由高到低依次为五味子酯甲,五味子乙素,五味子甲素和五味子醇甲。这与Iwata 等[15]的研究结果一致,五味子木脂素成分中以五味子酯甲的抑制作用最强。

表3 五味子醇甲、五味子酯甲、五味子甲素和五味子乙素对人CYP3A4酶活性的影响
4 讨论
本文建立了人肝微粒体温孵液中睾酮代谢物6β-羟基睾酮的HPLC-MS/MS分析方法,方法学考察的数据表明该方法简单、灵敏、准确,适用于开展6β-羟基睾酮的定量研究。研究结果为五味子和南五味子提取物在人肝微粒体中代谢特征及药物相互作用奠定了一定的实验基础。
本实验比较研究了五味子和南五味子提取物对药物代谢酶活性的影响,发现二者的醇提物和水提物均能对人CYP3A4酶活性产生抑制作用;二者的醇提物的抑制作用强于二者的水提物;五味子的醇提物和水提物的抑制作用强于南五味子。究其原因,这可能与提取物中木脂素成分含量差异密切相关。
本课题组在前期研究中发现五味子中总木脂素、五味子醇甲和五味子乙素的含量高于南五味子,五味子酯甲和五味子甲素的含量低于南五味子[21-22]。本研究发现上述木脂素成分对人CYP3A4酶活性抑制能力也存在差异,抑制能力从高到低依次为五味子酯甲,五味子乙素,五味子甲素和五味子醇甲。课题组后续还将开展体内代谢研究,并观察这些木脂素成分对CYP3A4酶蛋白或基因表达的影响,为进一步阐明五味子和南五味子在临床上混用是否会产生临床治疗风险提供科学依据。
鉴于五味子和南五味子及其制成的制剂中木脂素成分含量的差异性,以及它们对人CYP3A4酶产生的不同程度的抑制作用,提示五味子和南五味子在临床上混用,可能产生不良反应,同时也会因剂量使用不当,导致不良反应的发生。现版《中华人民共和国药典》规定南、北五味子每日临床用量均为2~6 g,但临床上有的方剂在治疗心脏疾病时重用五味子,用量已高达100 g[23]。如果临床需要大量服用五味子时,尤其需要注意处方中南五味子和五味子的区分,并加强对患者的木脂素类成分的血药浓度监测,避免与其他药物联合使用时产生的药物代谢性相互作用,从而确保其临床用药的安全性和有效性。
