壳聚糖创面敷料的微生物限度检验方法研究
2023-12-15常丽梅李仲洋王康俊
常丽梅 王 媛 李仲洋 王康俊
1.海南省药品和医疗器械审评服务中心,海南海口 570216;2.海南省药品检验所,海南海口 570216
壳聚糖又称脱乙酰甲壳素,为天然多糖甲壳素在碱性条件下脱乙酰基后的产物[1]。壳聚糖具有良好的生物相容性及多种生理学活性[2],其不仅具有良好的吸附性、吸湿性、成膜性、通透性以及较好的生物相容性、生物降解性和低过敏等特性,还具有抗微生物、抗氧化、抗菌等功能[3-5]。关于壳聚糖的抑菌活性机制,目前最容易被接受的理论是电荷作用,即壳聚糖的胺基(-NH2)正电荷与细菌细胞壁上的负电荷之间的静电作用,引起细菌表面膜性质的改变和损坏,从而抑制细菌的新陈代谢,导致细菌死亡[6-7]。壳聚糖的抑菌活性与分子量的大小、水溶性以及自身的脱乙酰化程度等密切相关。低分子质量壳聚糖对革兰氏阴性菌具有较好的效果,高分子质量壳聚糖对于革兰氏阳性菌具有较好的抑菌效果,且抑菌效果均随着相对分子质量的增加而升高,但是,随着壳聚糖相对分子量的增大,其水溶性逐渐降低[8]。
由于壳聚糖具有良好的生物活性,因而其在生物医药领域被广泛应用于止血、防粘连、创面护理等创面敷料。但是壳聚糖产品中不同分子量的壳聚糖及非无菌产品中防腐剂的使用,都会影响其微生物检验结果,可能出现假阴性。本研究采用《中华人民共和国药典(四部)》(2020年版)(通则1105)微生物计数法中平皿法[9]分别测定4种不同产品试验菌回收比值,以验证壳聚糖创面敷料微生物限度检验方法的可行性。
1 材料与方法
1.1 主要菌株
金黄色葡萄球菌[CMCC(B)26003](批号:9a5-2)、铜绿假单胞菌[CMCC(B)10104](批号:3a31-2)、枯草芽孢杆菌[CMCC(B)63501](批号:2a30-1)、白色念珠菌[CMCC(B)98001](批号:2a24-1)、黑曲霉菌[CMCC(B)98003](批号:OA1006),均由中国食品药品检定研究院提供。
1.2 仪器与试剂
BSC-1300ⅡA2生物安全柜(苏净集团苏州安泰空气技术有限公司)、LRH-250生化培养箱(日本松下公司)、DHG-9123A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司)、SQ810C高压灭菌器(日本YAMATO公司)。
胰酪大豆胨琼脂培养基(批号:220506)、胰酪大豆胨液体培养基(批号:2211162)、沙氏葡萄糖琼脂培养基(批号:221101)、沙氏葡萄糖液体培养基(批号:221025)、pH 7.0无菌氯化钠-蛋白胨缓冲液(批号:220425)、0.9%无菌氯化钠溶液(批号:220115),均由北京三药科技开发公司提供。
4种非无菌含壳聚糖的液体/凝胶型产品,具体信息参见表1。
1.3 试验菌液的制备[9]
取经33℃新鲜培养20 h的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的胰酪大豆液体培养物各1 ml,分别用0.9%无菌氯化钠溶液9 ml进行10倍稀释,制成菌落数约为1000 cfu/ml的试验菌液,备用。
取经25℃新鲜培养20 h的白色念珠菌的沙氏葡萄糖液体培养物1 ml,用0.9%无菌氯化钠溶液9 ml进行10倍稀释,制成菌落数约为1000 cfu/ml的试验菌液,备用。
取经25℃在沙氏葡萄糖琼脂培养斜面上培养1周的黑曲霉斜面培养物,加入3~10 ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液洗下霉菌孢子,吸取菌液1 ml,加入9 ml上述聚山梨酯80的无菌氯化钠溶液进行10倍稀释,制成菌落数约为1000 cfu/ml的试验菌液,备用。
1.4 供试品溶液的制备
取表1中试验用产品(A1~A4)各10 g(或10 ml),用pH 7.0无菌氯化钠-蛋白胨缓冲液溶解并稀释制成1∶10和1∶50的供试品溶液,备用。
1.5 计数方法适用性试验
鉴于壳聚糖目前较小的相对分子量为5万[10],且部分产品中含卡波姆,粒径均>0.45 μm,无法采用薄膜过滤法处理,参照《中华人民共和国药典(四部)》(2020年版)(通则1105)非无菌产品微生物限度检查有关微生物计数法[9]要求,选择平皿法(稀释法)对4种产品进行人工染菌的回收率测定,考察不同产品微生物计数方法的适用性。
1.5.1 试验组1 需氧菌计数:取1.4所述的1∶10供试品溶液9.9 ml各5份,置于20 ml无菌试管中,分别加入0.1 ml试验菌液(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉),混匀后制成人工污染试验菌的供试液,分别取人工污染试验菌的供试液1 ml注入平皿(1 ml/皿),立即倾入溶化后凉至45℃的胰酪大豆胨琼脂培养基约18 ml,每份平行制备2个平皿,待凝固后,于30℃~35℃倒置培养,白色念珠菌和黑曲霉培养5 d,其他菌培养3 d,计数菌落数,试验重复3次,取平均值。
霉菌和酵母菌计数:另取1.4所述的1∶10供试品溶液9.9 ml各2份,置于20 ml无菌试管中,分别加入0.1 ml试验菌液(白色念珠菌、黑曲霉菌),混匀后制成人工污染试验菌的供试液,分别取人工污染试验菌的供试液1 ml注入平皿(1 ml/皿),立即倾入溶化后凉至45℃的沙氏葡萄糖琼脂培养基约18 ml,每份平行制备2个平皿,待凝固后,于20℃~25℃倒置培养5 d,计数菌落数,试验重复3次,取平均值。
1.5.2 试验组2 需氧菌计数:取1.4所述的1∶50供试品溶液9.9 ml各5份,置于20 ml无菌试管中,后续操作同1.5.1试验组1,计数菌落数,试验重复3次,取平均值。
霉菌和酵母菌计数:另取1.4所述的1∶50供试品溶液9.9 ml各2份,置20 ml无菌试管中,后续操作同1.5.1试验组1,计数菌落数,试验重复3次,取平均值。
1.5.3 菌液对照组 取pH 7.0无菌氯化钠-蛋白胨缓冲液9.9 ml,置于20 ml无菌试管中,后续操作同1.5.1试验组1,分别进行需氧菌计数、霉菌和酵母菌计数。
1.5.4 供试品对照组 分别取1.4所述的1∶10、1∶50供试品溶液各9.9 ml,置于20 ml无菌试管中,以pH 7.0无菌氯化钠-蛋白胨缓冲液代替试验菌液,后续操作同1.5.1试验组1,分别进行需氧菌计数、霉菌和酵母菌计数。
1.5.5 回收比值计算及判定 采用平皿法(稀释法)分别稀释至1∶10和1∶50测定微生物回收率,试验菌回收比值=(试验组菌落数平均值-供试品对照组菌落数平均值)/菌液对照组菌落数平均值。判定依据:参照《中华人民共和国药典(四部)》(2020年版)(通则1105)供试品计数方法适用性试验,回收比值在0.5~2.0,符合要求。
2 结果
对4种产品人为污染需氧菌及霉菌和酵母菌后,试验菌回收比值测定结果显示:试验组1中4种产品的试验菌回收比值均<0.5,不符合《中华人民共和国药典(四部)》(2020年版)(通则1105)方法适用性的要求;试验组2中除产品A2回收比值不符合要求外,其他3种产品的回收比值均在0.5~2.0,符合《中华人民共和国药典(四部)》(2020年版)(通则1105)方法适用性的要求。试验结果见表2~3。
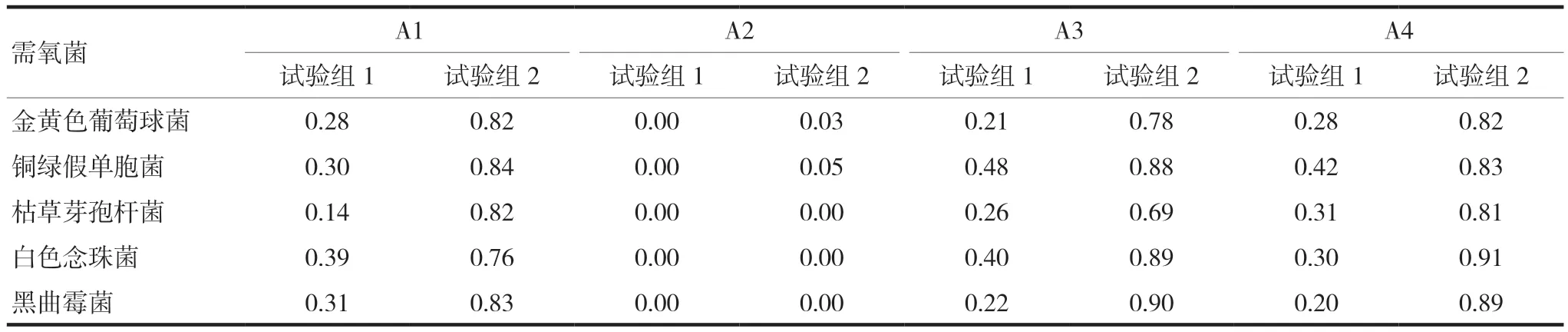
表2 需氧菌的回收比值

表3 霉菌和酵母菌的回收比值
3 讨论
分析表2~3数据可见,试验产品的试验菌回收比值随壳聚糖浓度的减小而增大,其原因归结为壳聚糖中的-NH2,随着壳聚糖浓度的增加,溶液中-NH2的浓度也随之增加,从而导致抑菌活性增强,试验菌回收比值减小。
壳聚糖具有广泛的抑菌活性,其抑菌活性与壳聚糖的分子量和浓度均有关[8,10],无论是低分子量壳聚糖还是高分子量壳聚糖,随着浓度的不断增加,其抑菌性均逐渐增大[11]。4种试验产品中仅A2在两种稀释浓度下试验菌回收比值均不符合要求且趋于0,可见其抑菌活性非常强,可能为壳聚糖的季铵盐衍生物等强抑菌性产品[12-13]。
壳聚糖的溶解性较差,难溶于水和大部分溶剂[14-15],目前在医药领域使用的壳聚糖多为壳聚糖衍生物。含壳聚糖创面敷料由于不同企业产品主要原材料不同,其产品抑菌性存在差异,采用微生物计数方法进行适用性试验是很有必要的。基于壳聚糖衍生物的特性,含壳聚糖非无菌产品微生物限度检验方法优选采用平皿法中的稀释法,并建议充分考虑壳聚糖衍生物信息及含量、所用防腐剂类别及用量、成品是否易溶于所选择的稀释剂、是否可以采用中和剂去除主成分及消除防腐剂的抑菌作用等,只有这样才能科学制订产品技术要求,更好地控制产品质量的一致性。
