下调HIF-1α /PLOD2 信号通路对缺氧肾透明细胞癌786-0 和ACHN 细胞株增殖、迁移和侵袭的影响
2023-12-14杨金成赵梦潮赵天琪苗冬青侯绍章
曹 雪, 杨金成, 李 媛, 赵梦潮, 赵天琪, 苗冬青, 侯绍章
(1.宁夏医科大学基础医学院病理学系,银川 750004; 2.银川市第一人民医院,宁夏医科大学第二临床医学院,银川 750004; 3.宁夏医科大学总医院药剂科,宁夏医科大学第一临床医学院,银川 750004)
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是最常见的肾癌类型,约占所有肾癌的80%~90%[1]。肾癌发病率在全球范围内居所有泌尿系统恶性肿瘤的第3 位,病死率居首位[2],近年来,我国肾癌发病率及病死率逐年攀升[3],由于ccRCC 早期无明显临床症状,呈高度恶性,易早期转移和复发,因此,ccRCC 的诊断和治疗是全世界共同面临的医学难题[4]。在ccRCC 发生和发展过程中,早期诊断和治疗非常重要,识别ccRCC 患者有效的肿瘤标志物和治疗靶点,对优化ccRCC 患者的治疗方案、延长患者生存周期以及改善患者预后均有重要意义。研究[5]显示,ccRCC中普遍存在缺氧情况,缺氧促进肿瘤细胞的迁移和侵袭。肿瘤细胞的生存和适应缺氧的能力依赖于缺氧诱导因子1α(HIF-1α)和缺氧诱导因子2(HIF-2),HIF-1α 及其下游基因的过度表达通过各种机制促进肿瘤的发生和发展,包括血管生成、细胞迁移、侵袭和增殖,癌症干细胞维持、诱导遗传不稳定和治疗耐药性[6]。有研究[7]表明,HIF-1α 在ccRCC 的发展中起抑制作用。但也有研究[8]表明,HIF-1α 在ccRCC 的发生发展中发挥着不可或缺的作用,降低HIF-1α 的表达可以减弱人肾癌细胞的增殖和迁移[9]。还有研究[10]表明,人ccRCC 组织中HIF-1α 阳性表达率明显高于癌旁组织。因此,可以通过靶向HIF-1α 及其下游信号分子来调节ccRCC 的发生和发展。
细胞外基质(ECM)沉积增加与肿瘤细胞的侵袭性有密切关系[11]。胶原蛋白是ECM 中最丰富的纤维蛋白,调节细胞黏附,支持趋化性和迁移性,是肿瘤细胞迁移和侵袭的“高速公路”。赖氨酸羟化酶2(LH2)由2-酮戊二酸5-双加氧酶2(human procollagen lysine-2-ketoglutarate-5-dioxygenase 2,PLOD2)基因编码,是影响胶原交联稳定性的关键酶,它催化赖氨酸羟化,赖氨酸羟化的模式和程度增强分子间胶原交联的稳定性[12]。PLOD2在宫颈癌[13]、口腔鳞状细胞癌[14]、胃癌[15]、结直肠癌[16]及ccRCC[17]等多种肿瘤组织中的表达都比正常组织高,且其表达水平与肿瘤分化、分期、转移及预后密切相关。还有研究[18-19]表明,在缺氧条件下,PLOD2 在HIF-1α 的诱导下表达显著上调,进而促进胶质瘤细胞和乳腺癌细胞增殖、迁移和侵袭。在肾癌方面,通过下调PLOD2 基因可明显抑制ccRCC 细胞的迁移与增殖[17]。因此,PLOD2 在ccRCC 的发生和发展过程中意义重大。但PLOD2 与HIF-1α 在ccRCC 发生和发展过程中是否存在关联目前未见报道。本研究通过调控ccRCC 细胞系中HIF-1α 的表达,探讨缺氧条件下HIF-1α 通过调控PLOD2 对ccRCC 细胞迁移、侵袭和增殖的影响,旨在为ccRCC的早期诊断和治疗寻找潜在的靶点。
1 材料与方法
1.1 材料
人ccRCC 细胞株786-0 和ACHN 购于武汉普诺赛生命科技有限公司;胎牛血清(FBS)购于Viva Biosciences 公司;RPMI 1640 和MEM 培养基购于Procell 公司;1%青霉素-链霉素溶液和胰蛋白酶EDTA 购于北京索莱宝科技有限公司;兔抗HIF-1α、GAPDH 单克隆抗体和Goat Anti-Rabbit IgG(H+L)HRP 抗体购于Affinity Biosciences 公司(中国),兔抗PLOD2 单抗购于Proteintech 公司;Goat Anti-Rabbit IgG 和Goat Anti-Mouse IgG 购于亚科因(武汉)生物技术有限公司;CCK-8 试剂盒购于Invigentech 公司;BCA 蛋白含量检测试剂盒和ECL 检测试剂盒(超敏型)购于江苏凯基生物技术股份有限公司;一步法PAGE 凝胶试剂盒(10%)购于上海雅酶生物医药科技有限公司。
1.2 方法
1.2.1 细胞培养及分组 将人ccRCC 细胞株786-0 和ACHN 于37 ℃水浴锅中解冻后复苏,分别置于RPMI 1640 或MEM 培养基中,在37 ℃、5% CO2培养箱中培养,当细胞融合度达到约70%后,随机将细胞分为正常对照组(NG 组)、缺氧组(Hypoxia 组,1% O2)和缺氧+HIF-1α 抑制剂组(Hypoxia+PX-478 组,55 μmol·L-1/45 μmol·L-1)。
1.2.2 CCK-8 法检测细胞活性 选取处于对数生长期的细胞,以5 000 个细胞/孔接种于96 孔板中,并培养约24 h。细胞稳定后,根据不同浓度的PX-478 进行细胞分组,每组设5 个复孔以减少误差,然后放入培养箱中24 h 或48 h,去培养基后,将CCK-8 和培养基按1∶9 的比例加入96孔板中,继续避光培养2 h 后,使用分光光度计读取450 nm 处的吸光度值,计算细胞活力。
1.2.3 Western blot 实验 当各组细胞在85%~90% 融合度时收集细胞,向其中加入适量裂解液放置于冰上,30 min 后在4 ℃条件下以12 000 r·min-1离心10 min,吸取上清液,进行蛋白定量后将蛋白样品与上样缓冲液混匀,100 ℃加热使蛋白变性,每组蛋白取40 μg 进行10% SDS-PAGE 凝胶电泳(80 V/120 V)。蛋白分离后,在4 ℃及200 mA 电流的条件下,将蛋白转移到PVDF 膜上,随后用10%脱脂奶粉溶液封闭2 h。封闭后分别加入一抗HIF-1α(1∶1 000)、PLOD2(1∶1 000)、GAPDH(1∶1 000),在冰箱中4 ℃孵育过夜。次日加入二抗(1∶5 000)室温孵育1.5~2 h,TBST 洗涤3 次后使用ECL 试剂盒显影,用Image J 软件进行灰度值分析,目的蛋白/GAPDH 灰度值表示目的蛋白的相对表达量,实验独立重复3 次。
1.2.4 细胞划痕实验 将ACHN 和786-0 细胞接种到6 孔板中,待孔底铺满细胞后,用无菌移液器枪头尖端在孔底划痕,注意保持枪头垂直,NG 组和Hypoxia 组加入无血清培养基,Hypoxia+PX-478 组加入含PX-478 的无血清培养基,0 h和12 h 后在显微镜下观察并拍照,保持划痕居中垂直,在6 个随机点测量划痕宽度并计算平均值。划痕愈合率(%)=(0 h 划痕宽度-观察时间划痕宽度)/0 h 划痕宽度×100%。
1.2.5 Transwell 实验检测细胞数目 将786-0和ACHN 细胞分组后,用无血清培养基处理,细胞悬浮液密度为3×105mL。在下室中加入含有20% FBS 的培养基(600 μL),每孔取100 μL 接种于有或没有凝胶基质层的上室,并用镊子轻轻将上室放到24 孔板中,避免产生气泡。培养24 h后,清洗小室内培养液,用4%多聚甲醛浸泡,15 min 后用结晶紫染色30 min,PBS 清洗染色剂,自然风干后,于显微镜下随机选择5 个区域进行细胞计数。
1.2.6 克隆形成实验 将786-0 和ACHN 细胞分组处理后,根据组别每孔取500~1 000 个细胞接种在6 孔板中,培养2 周,用PBS 洗3 次,用6 mL 4%多聚甲醛固定,20 min 后清洗6 孔板,然后加入结晶紫染色30 min,PBS 清洗染色剂,自然风干后拍照并统计每组的克隆数。
1.3 统计学方法
所有数据采用SPSS 23.0 进行统计学分析和GraphPad Prism 8.0 软件作图,各组实验独立重复3 次,数据以均数±标准差(±s)表示,组间两两比较采用Tukey 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 PX-478 对786-0 和ACHN 细胞活力的影响
CCK-8 法检测细胞活性发现,加入HIF-1α抑制剂(PX-478)后的细胞活力降低,且随着药物浓度的升高而降低,786-0 细胞系药物作用24 h 后的IC50是56.60 μmol·L-1,药物作用48 h后的IC50是46.48 μmol·L-1;ACHN 细胞系药物作用24 h 后的IC50是46.47 μmol·L-1,药物作用48 h 后的IC50是35.14 μmol·L-1,见图1。
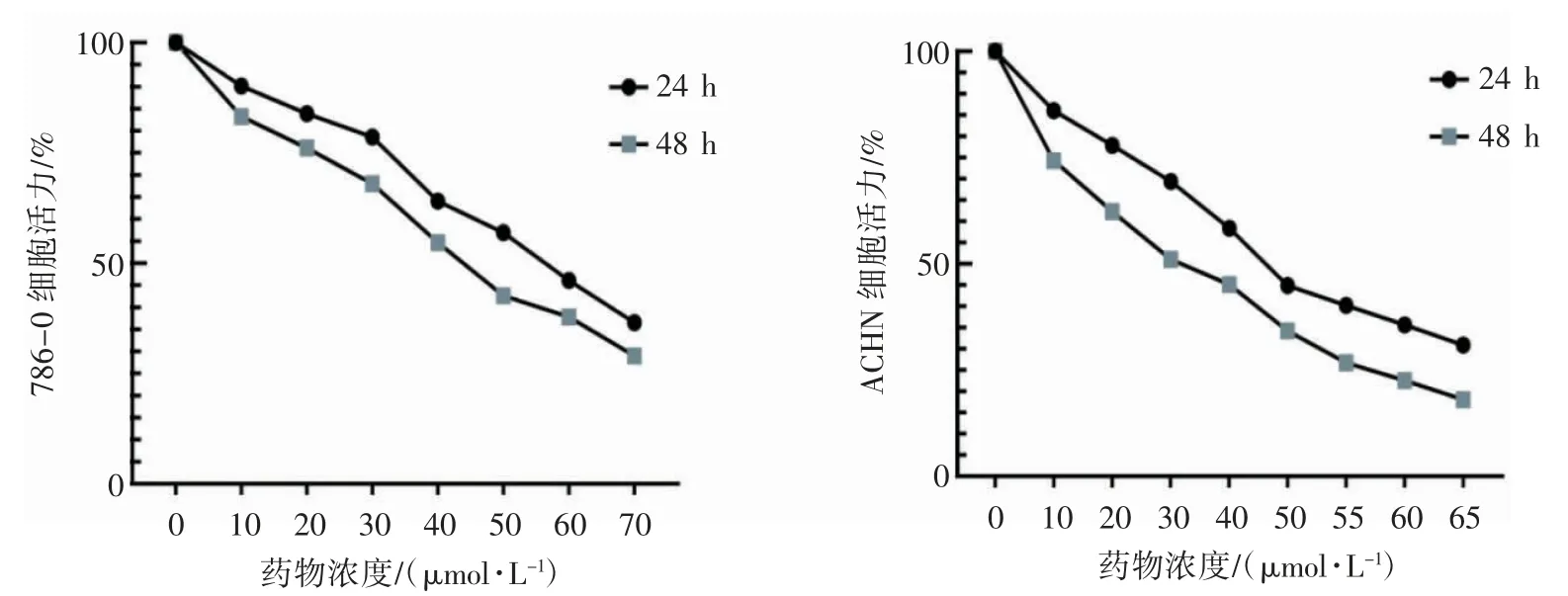
图1 CCK-8 法检测不同浓度PX-478 对人ccRCC 细胞活力的影响
2.2 缺氧和PX-478 对ccRCC 细胞HIF-1α、PLOD2 蛋白表达的影响
Western blot 实验检测HIF-1α、PLOD2 蛋白表达结果显示,在肾癌细胞786-0 和ACHN 中,与NG 组相比,Hypoxia 组HIF-1α、PLOD2 蛋白表达量均增加(P 均<0.05);与Hypoxia 组相比,Hypoxia+PX-478 组HIF-1α、PLOD2 蛋白表达量均降低(P 均<0.05),见图2。

图2 Western blot 实验检测各组ccRCC 细胞HIF-1α、PLOD2 蛋白表达水平
2.3 缺氧和PX-478 对ccRCC 细胞迁移能力的影响
细胞划痕实验对0 h、12 h 肾癌细胞786-0 和ACHN 迁移能力进行测定结果显示,与NG 组相比,Hypoxia 组ccRCC 细胞786-0 和ACHN 的迁移能力均提高(P 均<0.01),与Hypoxia 组相比,Hypoxia+PX-478 组细胞的迁移能力均降低(P均<0.01),见图3。

图3 细胞划痕实验检测ccRCC 细胞迁移能力(×40)
2.4 缺氧和PX-478 对ccRCC 细胞迁移、侵袭能力的影响
Transwell 实验对各组细胞的迁移和侵袭能力进行验证结果显示,与NG 组相比,Hypoxia 组ccRCC 细胞786-0 的迁移和侵袭能力均升高(P均<0.01);与Hypoxia 组相比,Hypoxia+PX-478组细胞的迁移和侵袭能力均降低(P 均<0.01),见图4。

图4 Transwell 实验检测ccRCC 细胞迁移、侵袭能力(结晶紫染色×100)
2.5 缺氧和PX-478 对ccRCC 细胞增殖能力的影响
克隆形成实验检测ccRCC 细胞786-0 和ACHN 增殖能力结果显示,Hypoxia 组ccRCC 细胞786-0 和ACHN 的细胞群落数目多于NG 组(P<0.01),Hypoxia+PX-478 组细胞群落数目比Hypoxia 组少(P<0.001),见图5。
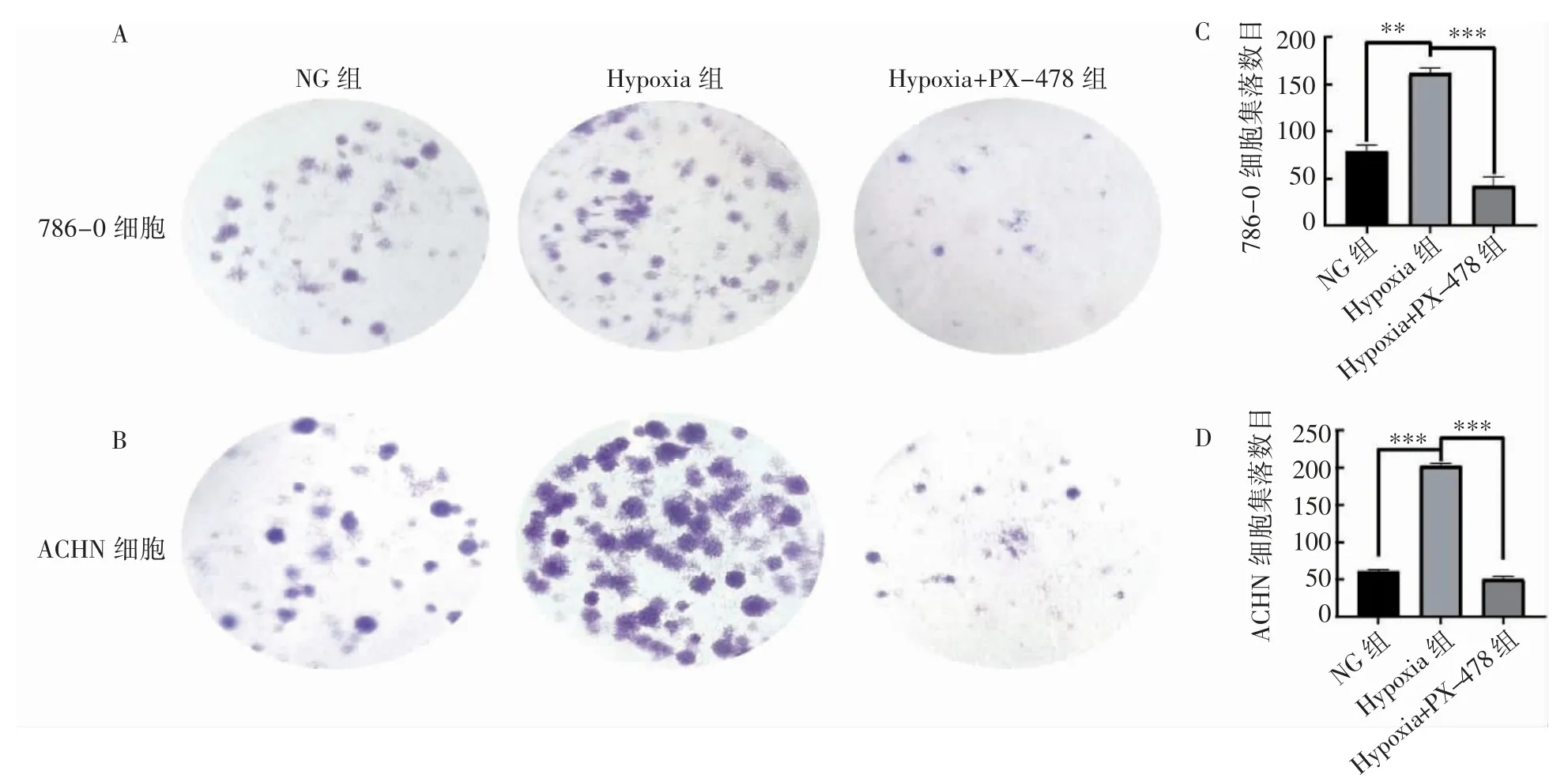
图5 克隆形成实验检测ccRCC 细胞增殖能力
3 讨论
肿瘤缺氧微环境在肿瘤发生和发展的进程中起着至关重要的作用[20],缺氧通过提高肿瘤细胞中的HIF-1α 及其下游因子的蛋白表达水平,加剧癌症的发生和发展[6],缺氧还可以通过上调PLOD2 的蛋白表达,促进肿瘤细胞的迁移和侵袭,如子宫内膜癌[21]、胃癌[22]和胆管上皮癌等[23]。滋养细胞[24]、胶质瘤细胞[18]、宫颈癌细胞[25]、乳腺癌细胞[19]和肉瘤细胞[26]在常氧和缺氧条件下,HIF-1α 均可通过上调PLOD2 的表达,促进肿瘤细胞的迁移和侵袭。
研究[10,17]证实,HIF-1α 和PLOD2 在肾癌组织中的表达高于正常组织,且HIF-1α 可通过上调血管内皮生长因子的表达促进ccRCC 的发生和发展[27]。在本研究中发现,加入HIF-1α 抑制剂(PX-478)后,人ccRCC 细胞的活力随PX-478浓度的增加而降低,HIF-1α 以及下游因子可能与ccRCC 细胞的生存密切相关;还发现缺氧环境下人ccRCC 细胞中HIF-1α 和PLOD2 蛋白表达均增加,加入PX-478 后缺氧环境中HIF-1α 和PLOD2 蛋白表达均降低。结果表明在缺氧条件下,通过抑制HIF-1α 的表达进一步降低ccRCC细胞中PLOD2 的蛋白表达量。
研究[17]表明,PLOD2 在ccRCC 中呈现高表达且促进ccRCC 细胞的增殖和迁移。为进一步研究其在缺氧条件下对肾癌细胞迁移、侵袭和增殖的影响,本研究细胞划痕实验和Transwell 实验发现,缺氧时,ccRCC 细胞中的PLOD2 表达上调,且ccRCC 细胞迁移和侵袭能力均增强,加入PX-478 后,PLOD2 表达下调且ccRCC 细胞迁移和侵袭能力均减弱。通过克隆形成实验发现,缺氧时,肾癌细胞增殖能力增强,加入PX-478 后,ccRCC 细胞增殖能力减弱。上述结果表明,缺氧条件下,HIF-1α 可通过上调PLOD2 的表达增强ccRCC 细胞迁移、侵袭和增殖的能力。
综上所述,缺氧条件下HIF-1α 和PLOD2 在人ccRCC 细胞中均呈现高表达,且可以通过抑制HIF-1α/PLOD2 通路来抑制ccRCC 细胞的迁移、侵袭和增殖,提示HIF-1α/PLOD2 通路具有促进ccRCC 发生和发展的作用。然而,对于PLOD2 通过何种信号通路促进肾癌细胞迁移、侵袭和增殖还需进行更深入的研究。
