甘草抗慢性呼吸系统疾病糖皮质激素耐药的网络药理学及分子对接研究
2023-12-14任小薇刘旭洋李金鑫蔡邦荣
任小薇,刘旭洋,李金鑫,杨 柳,蔡邦荣
(河南中医药大学协同创新中心,郑州 450046)
近年来,慢性呼吸系统疾病如慢性阻塞性肺疾病(COPD)、支气管哮喘发病率逐年上升,严重影响了患者身体健康及生活质量[1].COPD 和支气管哮喘的发病机制尚不清楚[2],糖皮质激素类药物或糖皮质激素联合β2 受体激动剂是目前临床主要治疗方法,能有效缓解患者临床症状,延缓或阻碍病程进展,提高患者生活质量和降低死亡率.然而,糖皮质激素类药物毒副作用大,长期使用又易产生耐药性而不得不加大剂量[3].糖皮质激素联合其他药物能延长激素疗效,减少用药剂量及毒副作用.因此,联合用药可能是解决糖皮质激素耐药和增效减毒的主要策略之一.
甘草性平味甘,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效.临床上,甘草单独或与其他药物组方广泛用于治疗呼吸系统疾病,如肺纤维化、COPD 和肺炎等[4-5],均取得较好疗效.甘草的有效成分(如甘草酸苷)与糖皮质激素联合使用治疗天疱疮可增强糖皮质激素的疗效,减少激素使用量[6].甘草与甲泼尼龙联合应用治疗急性加重期COPD 患者时,主要通过上调糖皮质激素受体表达量增强和延长激素疗效,其本身也具有较强的抗炎活性[7],但是甘草抗糖皮质激素耐药的分子机制鲜有报道.
网络药理学基于药物之间的构效相似性,根据已获得的大量数据开展生物信息分析,可建立药物-靶点-疾病网络,从而探索相关作用机制.分子对接技术则是基于分子之间的空间识别和能量识别原理,研究分子间的相互作用、预测其结合模式和亲和力的理论模拟方法.本研究以COPD 和支气管哮喘为示范,运用网络药理学和分子对接技术,探讨甘草抗糖皮质激素耐药的分子机制.
1 材料和方法
1.1 活性成分与靶点筛选
利用中药系统药理学数据库(TCMSP,https://old.tcmsp-e.com/index.php)检索了甘草所有成分,以OB≥30%、DL≥0.18(OB 为口服生物利用度,DL 为类药性)筛选出活性成分,通过TCMSP 平台找寻与活性成分相关的潜在靶点.
1.2 成分-靶点网络构建
将TCMSP 数据库得到的靶点蛋白与Uniprot 数据库中被验证的人类基因库中的目标基因相匹配,获得靶基因,利用Cytoscape3.9.1 软件构建成分-靶点网络图,体现成分靶点相互作用关系,以探究甘草的作用机制.
1.3 疾病靶点的收集
运用GeneCards(https://www.genecards.org/)、NCBIgene(https://www.ncbi.nlm.nih.gov/)和OMIM(https://omim.org/)数据库获得糖皮质激素耐药性或不敏感性(GROI)、COPD 和哮喘相关靶点,检索关键词依次为“Glucocorticoidresistance”、“Glucocorticoid insensitivity”、COPD 和Asthma. 对获得的靶基因分别合并后去重,得到疾病靶点.
1.4 蛋白质-蛋白质相互作用(PPI)网络的构建
为了说明靶点蛋白之间的相互作用,制作韦恩图得到交集靶点,将交集靶点输入STRING 数据库(https://cn.string-db.org/),选择“Homo sapiens”生物种类,Interaction Score≥0.4,其余均为默认设置,构建PPI 网络. 利用Cytoscape3.9.1 中的Centiscape2.2 插件筛选出核心靶点.
1.5 KEGG 和GO 富集分析
利用Metascape 数据库(https://metascape.org/gp/index.html#/main/step1)对核心靶点进行富集分析. 基因本体(GO)分析是为了统一表征所有物种的基因及基因产物的性质而发起的生物信息学计划,旨在建立一套适用于所有物种的对基因和蛋白质功能进行限定和描述并能随着研究不断深入而更新的语义词汇标准[8].GO 包括生物过程(biological process,BP)分析、细胞组分(cell component,CC)分析和分子功能(molecular function,MF)分析.KEGG 是对核心靶点富集通路的分析.Metascape 数据库中输入核心靶点,物种选择“H. sapiens”,进行Custom Analysis,设定P≤0.05,其他参数为默认设置,利用微生信平台对富集结果进行可视化展示.
1.6 分子对接
分别从蛋白数据库(PDB)(http://www.rcsb.org/)、TCMSP(http://tcmsp-e.com)以及PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库中获得目标蛋白的三维结构和药物分子结构,在AutoDock4 中对目标蛋白和药物分子去水加氢处理,将获得的处理后受体和配体的PDBQT 文件导入到AutoGrid4 中划定对接范围,在AutoDock4 中完成分子对接,通过OpenBabel GUI 和PyMol2.5 将分子对接结果文件进行可视化.
2 结果与分析
2.1 甘草活性成分-靶点相互作用网络
以OB(OB≥30%)和DL(DL≥0.18)值从甘草中筛选得到87 个活性成分和230 个靶点,构建成分-靶点网络,结果如图1 所示.由图1 可以看出,网络共包括317 个点和1 738 条边.其中,黄色角形节点代表非主要成分,红色角形节点代表主要成分,紫色圆形节点代表主要成分靶点,黄色菱形节点代表非主要成分靶点,每条边代表化合物分子与靶点之间的相互作用关系.在网络中,度(degree)表示网络中与节点相连的路线的条数,观察节点度的分布可以找到高度参与互动连接的化合物和靶点,它们在成分-靶点网络中起到关键作用. 成分-靶点网络中度值排名前10 的成分如表1 所示,从表1 可以看出,槲皮素(quercetin)有最多的潜在靶标151 个,其次是山奈酚(kaempferol)有62 个潜在靶标,这些度值较高的分子可能是甘草的主要活性成分.

表1 甘草主要活性成分Tab.1 Main active ingredients in licorice

图1 甘草成分-靶点网络Fig.1 Licorice ingredients-targets network
2.2 PPI 网络
为了进一步揭示甘草抗糖皮质激素耐药的分子机制,利用Venny 将230 个甘草靶点、3 992 个GROI靶点与791 个COPD 靶点和1 988 个哮喘靶点分别取交集,结果如图2 所示,得到交集靶点分别为86 个和113 个.

图2 交集分析Fig.2 Intersection analysis
将交集靶点导入String 数据库,采用Cytoscape3.9.1 进行PPI 网络的绘制,其中,甘草-GROICOPD 网络共有86 个节点、1 545 条边,节点平均Degree 值为35.9,聚类系数为0.728;甘草-GROI-哮喘网络共有113 个节点、2 203 条边,节点平均Degree 值为39,聚类系数为0.709. 利用Cytocape3.9.1 中的Centiscape2.2 插件对网络进行可视化分析以及度、介度中心度和接近中心度的阈值筛选,得到核心靶点.各靶基因节点颜色和大小按Degree 值进行展示,Degree 值越大代表连线数越多,节点越大,颜色越深,如图3 所示.

图3 PPI 网络Fig.3 PPI networks
经过筛选,甘草-GROI-COPD 网络获得19 个核心靶点,甘草-GROI-哮喘网络获得31 个核心靶点,按Degree值进行排序,甘草-GROI-COPD 网络前10 位的核心靶点基因分别为TNF、IL6、IL1β、TP53、VEGFA、PTGS2、JUN、CXCL8、MMP9、CASP3;甘草-GROI-哮喘网络前10 位的核心靶点基因分别为TNFα、IL6、TP53、IL1β、PTGS2、VEGFA、JUN、CASP3、MMP9、PPARG. 比 较 以上核心靶点可知,甘草抗COPD 或哮喘糖皮质激素耐药靶点具有极强的共性,这提示甘草在抗慢性呼吸系统疾病糖皮质激素耐药方面具有相似性.
2.3 KEGG 分析
利用Metascape 数据库对筛选出的核心靶点进行KEGG 通路富集分析,分别获得12 条和17 条富集结果.利用微生信平台对富集结果进行可视化处理,结果如图4 所示,气泡面积大小代表目标基因集中属于某一通路的基因数量,颜色代表以10 为底数的-logP值,值越大代表P值越小,通路与基因之间的联系越强.甘草作用信号通路主要涉及脂质及动脉粥样硬化通路、MAPK 信号通路、HIF-1 信号通路和FoxO 信号通路等,表明甘草有效成分可能通过调控多条相关通路改善糖皮质激素耐药作用.为了更好地分析甘草成分发挥作用的机制,建立了核心靶点-信号通路网络,结果如图5 所示,靶点与信号通路节点大小根据Degree 值进行排序.

图4 核心靶点气泡图Fig.4 Bubble diagrams of core targets

图5 核心靶点通路网络Fig.5 Core targets-pathways networks
2.4 GO 分析
利用Metascape 数据库进行GO 功能富集分析,设定P≤0.05,对核心靶点在基因功能中的作用进行研究,结果如图6 所示.
由图6 可知,核心靶点基因功能主要富集在生物过程、细胞组分和分子功能.甘草-GROI-COPD 模型中得到42 个条目,其中生物过程相关的条目最多,有34个,主要涉及细胞增殖的负调控、细胞迁移的正调控、细胞对氧化应激的响应、血管形态、细胞对生长因子刺激的响应和缺氧响应等;细胞组分相关的条目4个,主要涉及膜筏和转录调控复合物等;分子功能相关的条目4 个,主要涉及细胞因子受体结合和蛋白酶结合等.甘草-GROI-哮喘确定了67 个条目,其中生物过程相关的条目最多,有48 个,主要涉及细胞对氧化应激的反应、细胞增殖的负调控、细胞迁移的正调控、激素反应、细胞死亡的正调控、细胞分化的负调控、DNA 结合转录因子活性的调控等;细胞组分相关的条目9 个,主要涉及转录调控复合物、膜筏等;分子功能相关的条目10 个,主要涉及RNA 聚合酶Ⅱ特异性结合DNA 转录因子、细胞因子活性、激酶结合、泛素蛋白连接酶结合、血红素结合、蛋白酶结合、激酶调控活性以及蛋白激酶活性等.
2.5 分子对接验证
分子对接研究中,结合能越低,“靶点蛋白-活性分子”之间的亲和力越高,构象越稳定,发生作用的可能性越大.本研究对槲皮素、山奈酚、柚皮素、芒柄花素4个潜在有效成分与5 个目标靶点蛋白(IL6、TP53、VEGFA、MMP9 和JUN)进行分子对接以验证结合活性,结果如表2 所示.
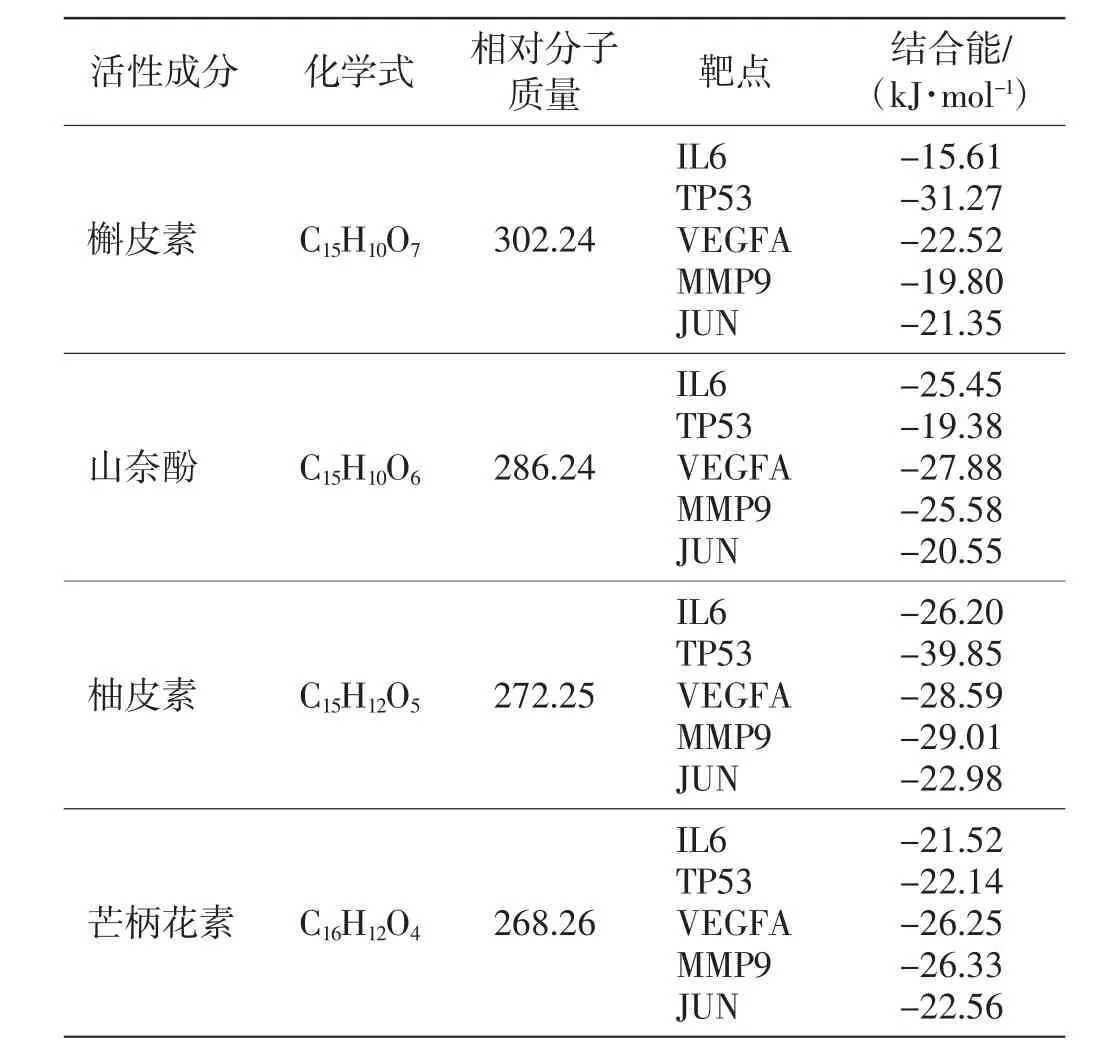
表2 甘草潜在有效成分与核心靶蛋白对接的结合能Tab.2 Binding energy of main components of licorice and core target proteins
由表2 可知,4 种活性分子与靶点蛋白均具有较好的亲和性. 通过分子对接得到结合能≤-25.12 kJ/mol 的“靶点蛋白-活性分子”共10 个,选择4 个结合能活性最小的“靶点蛋白-活性分子”绘制成对接模式图,结果如图7 所示.槲皮素和柚皮素与靶点蛋白的结合主要通过氢键,其中,柚皮素与TP53、MMP9 和VEGFA 靶点分别通过2 个、4 个和2 个氢键进行结合,槲皮素则通过1 个氢键与TP53 进行结合.分子对接研究表明,甘草中的槲皮素、山奈酚、柚皮素和芒柄花素与核心靶蛋白均有较高的亲和力,由此证明,甘草的有效成分可通过作用于糖皮质激素耐药的核心靶点蛋白实现增效减毒作用.
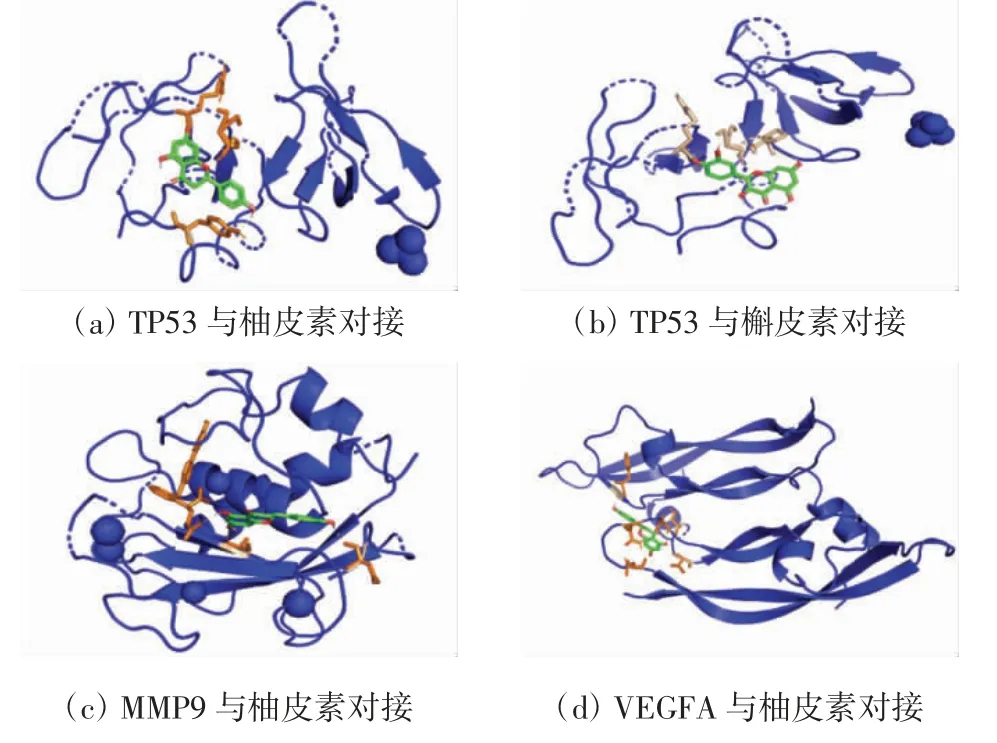
图7 甘草潜在有效成分与核心靶蛋白分子对接模式Fig.7 Molecular docking mode between potential active ingredients of licorice and target proteins
3 讨论与结论
炎症反应是COPD 和哮喘等慢性呼吸系统疾病的主要发病机制之一,糖皮质激素类药物是临床最有效的抗炎药物,但哮喘患者使用糖皮质激素会出现耐药性,COPD 患者对糖皮质激素天然不敏感.有研究发现,氧化应激是引起糖皮质激素耐药或不敏感的重要因素之一[9].现代医学研究发现,甘草具有较强的抗氧化和抗炎活性,临床上甘草单独或与其他药物组方广泛用于治疗呼吸系统疾病如肺损伤、纤维化和COPD[4-5,10]等.本研究运用网络药理学技术研究了甘草抗糖皮质激素耐药的潜在有效成分及其作用机制,并利用分子对接技术对“靶点蛋白-活性分子”之间的亲和力进行验证.研究发现,槲皮素、山奈酚、异黄酮、芒柄花素、异鼠李素、柚皮素、查尔酮等是甘草中抗糖皮质激素耐药的主要成分.近期有研究报道[11]槲皮素具有较强的抗COPD 糖皮质激素不敏感作用,主要通过激活AMPK/Nrf2 通路发挥作用,但具体作用靶点尚不清楚.本研究发现槲皮素可作用多个靶点,分子对接结果显示,槲皮素与TP53 具有较强的亲和性,TP53 可能是其关键靶点.另外,山奈酚也可通过激活AMPK/Nrf2信号通路抑制内皮细胞的氧化应激,通过降低氧化应激水平逆转糖皮质激素耐药作用[12].本研究发现,IL6、TP53、VEGFA、JUN和MMP9等是甘草抗糖皮质激素耐药的核心靶点基因.IL6上调可促进活性氧的生成,从而降低糖皮质激素受体(GRα)的表达和GR 与转录因子的结合活性[13].TP53是一种熟知的抑癌基因,TP53 缺乏多与重度呼吸疾病相关.在COPD、肾病综合征及急性淋巴白血病等患者中,糖皮质激素治疗可使TP53表达上调,而耐药性患者的TP53表达水平上调不明显[14].血管内皮生长因子A(VEGFA)与糖皮质激素耐药相关研究目前尚未开展,但有研究发现VEGFA表达水平与COPD 严重程度呈正相关,VEGFA高表达会使病情加重[15].活化的中性粒细胞分泌MMP9 会导致中性粒细胞对地塞米松不敏感,提示MMP9 是糖皮质激素不敏感治疗靶点[16].一些研究[17-19]发现,槲皮素、山奈酚、柚皮素具有较强的抗炎活性,甘草本身可抑制IL6、TNFα、MMP9 等多种炎症因子的表达.本研究的分子对接结果也证实甘草中的槲皮素、山奈酚、柚皮素等对IL6、TP53、VEGFA、MMP9、JUN 多个靶蛋白有较强的亲和力.以上结果表明,甘草不仅能通过多成分、多靶点抗糖皮质激素耐药,而且自身也直接发挥抗炎作用.
GO 分析结果显示,甘草通过调控氧化应激响应抗糖皮质激素耐药是主要生物过程之一,此外,还通过调节膜筏和转录调控复合物、细胞因子受体结合和蛋白酶结合等多环节抗糖皮质激素耐药.Mei 等[20]、Bin等[21]研究发现,氧化应激可导致PI3K/Akt 通路和NF-кB通路活化,GRα、HDAC2 和c-JUN 的表达量和活性下降是其主要分子机制.槲皮素和芒柄花素可调节PI3K/Akt通路[22-23],槲皮素和柚皮素也可通过抑制NF-кB 通路上调糖皮质激素受体表达量[24-25].Li 等[26]研究发现,促炎因子(IL2、IL6)、趋化因子及细胞表面受体基因在糖皮质激素耐药小鼠中显著上调,促炎因子如IL6 和IL-1β等显著增加可通过激活NF-κB 通路抑制GRα 的表达或GRβ 下降,导致GRα/GRβ 比例失衡,产生耐药性[27].KEGG 结果显示,氧化应激通路、AGE-RAGE 通路和MAPK 信号通路是甘草抗糖皮质激素耐药的主要通路.越来越多的研究证实,氧化应激可引起Nrf2 和组氨酸去乙酰化酶2(HDAC2)活性下降或低表达,激活PI3K/Akt 通路是糖皮质激素不敏感的主要分子机制[20].AGE-RAGE 通路可调控多种信号通路,如NF-κB、ERK1/2、p38 丝裂原活化蛋白激酶、c-Jun N 末端激酶JNK 等通路[28]. Bin 等[21]研究发现,红霉素可通过抑制MAPK/JNK 的活性降低c-Jun 的表达,从而改善COPD患者对糖皮质激素的不敏感性.以上研究表明,甘草可通过多条通路发挥抗糖皮质激素耐药的作用.
综上,本研究发现甘草能够逆转糖皮质激素耐药性,其作用机制呈现多环节、多途径、多靶点的特征.IL6、MMP9和JUN是糖皮质激素耐药的关键靶点基因,甘草中槲皮素、山奈酚、柚皮素和芒柄花素等成分可通过直接清除活性氧自由基,降低IL6、MMP9和JUN的表达,也可间接作用于核心靶蛋白,通过抑制AGE-RAGE 通路、PI3K/Akt 通路、MAPK/JNK 和NFкB 通路,上调AMPK/Nrf2 信号通路和糖皮质激素受体(GRα)的表达逆转糖皮质激素耐药,对糖皮质激素治疗COPD 和哮喘起到了增效减毒作用. 甘草安全性高,临床剂型较多,甘草联合糖皮质激素治疗COPD和支气管哮喘可能是解决其糖皮质激素耐药或不敏感的主要策略.本研究不足之处在于甘草筛选成分存在同质化现象,后期实验可运用高效液相色谱串联四极杆飞行时间质谱技术(HPLC-Q-TOF-MS/MS)等方法确定其入血成分化合物数据库,再进行网络分析、关键成分筛选,可避免出现明显的同质化现象.单纯的网络药理学研究无法完全体现甘草抗糖皮质激素耐药的活性和分子机制,后续将会通过体内外实验验证其药效和作用机制,以期为临床应用提供新思路和新方法.
