复合益生菌发酵培养基与冻干保护剂的筛选
2023-12-14张晓月左志晗孙家塍刘洪瑞张晶晶孙金生
张晓月,王 涛,左志晗,孙家塍,刘洪瑞,张晶晶,孙金生
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
水产养殖业中,益生菌由于能够在一定程度上促进动物生长,因此应用广泛[1-2],尤其是利用益生菌发酵生产的饲料产品越来越受到养殖业的青睐[3].目前在水产养殖行业中应用的菌种比较匮乏且单一,可应用于水产养殖的菌种筛选也没有新的突破.摆脱菌种结构的单一性、提高应用效果是急需解决的重要问题[4].益生菌制剂主要分为单一菌剂和复合菌剂,单一菌剂是指有效活菌是单一微生物的制剂,如芽孢杆菌制剂、酵母菌制剂等,单一菌剂虽然针对性较强、发酵工艺简单,但作用效果比较单一,很难应对养殖环境复杂和水生生物疾病多样的情况.复合菌剂是指由2 种以上微生物构成的制剂,如芽孢杆菌与乳酸菌组成的复合微生物添加剂[5],复合菌剂不仅具有多种功效,且相较于单一菌剂使用效果更加显著,但大多质量无法保证且无法满足养殖行业的需求.如有些复合益生菌的搭配不够科学,针对性不强,无法适用于不同的养殖环境和水体,常常不能够发挥其应有效果.
益生菌制剂在饲料加工、运输、贮存过程中容易失去活性[6],也存在定植于动物肠道时间较短或仅少数能定植在肠壁发挥作用[7]等问题,因此益生菌制剂的保存和制备方法尤为重要.菌种保存和发酵剂的制备是保证益生菌制剂能够正常发挥原有效果的保障,可以保证菌种活性,减少益生菌制剂在保存及运输过程中的活性损失[8].现用于益生菌保存和制备的方法主要有真空干燥、冷冻干燥以及喷雾干燥法[9].其中真空冷冻干燥技术具有适用范围广、存活率高、保藏时间长、菌种稳定性高的特点,同时在储存和运输方面成本低且方便快捷[10-12],是益生菌发酵剂制备较为理想的方法.可用于微生物冻干保护剂的物质有很多,按照保护剂的性质可分为多元醇类、糖类、蛋白质类、氨基酸和肽类[13-14],要根据微生物的不同使用适合的保护剂种类和浓度才能够获得较好的保护作用.
本课题组前期从健康水产动物肠道中分离筛选出了4 株益生效果较好的动物内源性益生菌,即枯草芽孢杆菌(Bacillus subtilis)、格式乳球菌(Lactococcus garvieae)、施氏假单胞菌(Pseudomonas stutzeri)和酵母菌(Yeast),本研究以4 株菌为实验菌株,进行发酵共培养,通过无机盐去除实验优化初始培养基,通过冻干保护剂筛选实验选出适合的保藏保护剂.研究可为开发适合水产养殖用复合益生菌制剂提供实验指导.
1 材料与方法
1.1 实验菌株
枯草芽孢杆菌(YA)、格式乳球菌(M4ⅡY)、施氏假单胞菌(JM)、酵母菌(Y),均由本实验室前期从水产动物半滑舌鳎(Cynoglossus semilaevis)肠道中分离鉴定,-80 ℃冰箱中保存.
1.2 实验试剂
试剂:乙酸钠、蛋白胨、磷酸氢二钾,上海迈瑞尔化学技术有限公司;酵母粉、柠檬酸氢二铵,上海毕得医药科技股份有限公司;吐温80,天津歆毅翎科技有限公司;牛肉浸粉,天津市宝坻区军扬生物试剂销售中心;葡萄糖,天津市沃凯生物科技有限公司;硫酸镁、硫酸锰,天津凯玛特化工科技有限公司;TSB 胰酪大豆胨液体培养基(HB4114-19)、YPD 液体培养基(HB5193-1)、MRS 肉汤培养基(海博#HB0384-1),青岛海博生物技术有限公司.
冻干保护剂:可溶性淀粉、甘油,上海迈瑞尔化学技术有限公司;脱脂奶粉,蒙牛乳业集团有限公司.
初始培养基:葡萄糖20 g,蛋白胨10 g,牛肉浸粉5 g,酵母粉5 g,MgSO40.1 g,乙酸钠5 g,柠檬酸氢二铵2 g,K2HPO42 g,MnSO40.05 g,吐温80 1 mL,蒸馏水1 000 mL,pH 值为7.4.
1.3 菌种活化及扩大培养
将4 株益生菌由保藏状态恢复到室温状态,使用一次性接种环分别将枯草芽孢杆菌与施氏假单胞菌菌液涂布于固体TSB 平板上,格氏乳球菌菌液涂布于MRS 平板,酵母菌菌液涂布于YPD 平板上.涂布后将平板置于培养箱中,28 ℃条件下培养24 h,待长出单菌落后,重复上述步骤,再次活化.
1.4 培养基优化(去除无机盐)
以培养基中不去除任何无机盐为对照组,逐一去除初始培养基中的各种无机盐(硫酸镁、乙酸钠、柠檬酸氢二铵、磷酸氢二钾、硫酸锰),其余成分保持不变,配制成液体培养基,调pH 值到7.4,121 ℃条件下灭菌20 min. 待培养基冷却后,将活化好的4 株菌(1×108mL-1),以2%的接种量同时接入到液体培养基中,各液体培养设置3 个平行. 置于摇床上,220 r/min、28 ℃培养15 h(时间依据每株菌的生长曲线比对后确定).将菌株的共培养液梯度稀释后分别涂布于MRS、TSB、YPD 固体平板上,分别对4 株菌进行平板计数.其中,枯草芽孢杆菌与施氏假单胞菌均涂布于TSB 培养基上.依据菌落形态区分计数:枯草芽孢杆菌菌落为多边形,边缘毛糙不整齐;施氏假单胞菌菌落为白色圆形,表面光滑湿润,边缘整齐.
1.5 固定化吸附剂的选择
1.5.1 吸附剂吸水性的比较
以稻壳粉、玉米芯粉、牡蛎壳粉和玉米粉4 种粉末作为吸附剂,分别称取5 g,放入50 mL 烧杯中,每种吸附剂设置3 组平行,烧杯中加蒸馏水至吸附剂完全被水浸没,静置2 h 后过滤去除多余水分.称量吸水饱和后吸附剂的质量,并计算出各种吸水材料的吸水率.计算公式如下:
式中:m2为吸水饱和后吸附剂的质量;m1为吸水前吸附剂的质量.
1.5.2 吸附剂对于4 株菌吸附效果的比较
对4 株菌进行菌种活化,同时接种于共发酵培养基中进行混菌发酵.称取4 种吸附剂各2 g 于三角瓶中,向每个三角瓶中加入混菌发酵液20 mL,将其混匀.静置吸附30 min 后取上清液,梯度稀释后涂平板菌落计数,分析4 种吸附剂的吸附效果.
1.6 益生菌制剂的干燥
采用低温真空冷冻干燥法对益生菌制剂进行干燥处理.将活化好的混菌转移到冻存管中,加入不同的保护剂混合均匀(设置3 个平行),先在4℃条件下预冷12 h,然后转入-80 ℃冰箱中冷冻24 h,最后转入低温真空冷冻干燥机中处理26 h,得到冻干菌粉.
1.7 真空冻干保护剂的筛选
将活化好的混菌转移到冻存管中,每个冻存管中加入不同含量不同种类的冻干保护剂:甘油,体积分数分别为1%、2%、3%、4%、5%;脱脂奶粉,质量分数分别为4%、8%、12%、16%、20%;可溶性淀粉,质量分数分别为4%、8%、12%、16%、20%.每种保护剂的每个含量设置3 个平行,进行低温冷冻干燥.干燥后将冻干菌粉进行复水并稀释平板计数,对4 株菌的存活率进行统计并计算,计算公式如下:
2 结果与分析
2.1 培养基优化(去除无机盐)
为实现4 株水产养殖用益生菌的共发酵培养并且保证每株菌的数量,需要找出能够使它们共同生长的培养基.根据4 株益生菌单独培养时分别使用的培养基成分得出初始培养基成分,在利用该初始培养基进行混菌发酵时,发现枯草芽孢杆菌始终不生长.由于4 株菌所使用的有机营养成分均相似,只有无机盐差别较大,推测可能是某种无机盐对枯草芽孢杆菌的生长有一定的影响,因此设计去除无机盐实验,分别统计去除某一种无机盐后4 株益生菌的数量,结果如图1 所示.

图1 去除无机盐后4 株益生菌的数量Fig.1 Quantity of four probiotic strains after removing of inorganic salts
由图1(a)可以看出,当培养基中分别去除柠檬酸氢二铵和硫酸镁时,酵母菌的数量下降,显著低于对照组的数量,说明这2 种无机盐是酵母菌生长不可缺少的成分;当分别去除乙酸钠和磷酸氢二钾时酵母菌的数量也有所下降,但与对照组之间的差异不具有统计学意义(P>0.05);去除硫酸锰对酵母菌没有显著影响.由图1(b)可以看出,当分别去除柠檬酸氢二铵和硫酸锰时,施氏假单胞菌的数量显著下降,生长受到限制,去除磷酸氢二钾和乙酸钠对施氏假单胞菌的数量没有显著影响,去除硫酸镁时酵母菌的数量增加.由图1(c)可以看出,培养基中分别去除柠檬酸氢二铵和硫酸锰时,格氏乳球菌的生长受到显著影响,而去除其他3 种无机盐对其没有显著限制作用.由图1(d)可以看出,培养基中只有去除了乙酸钠枯草芽孢杆菌才能正常生长,因此乙酸钠是限制枯草芽孢杆菌生长的最主要因素.
2.2 固定化吸附剂的选择
2.2.1 吸附剂的吸水性
选取4 种常见吸附剂进行吸水性的比较,分别计算每种材料的吸水量和吸水率,结果如图2 所示.由图2 可以看出,玉米芯粉的吸水率最高,为5.30%;其次是稻壳粉,吸水率为1.69%,每5 g 的平均吸水量为8.44 g;再次为玉米粉,吸水率为1.26%,每5 g 的平均吸水量为6.29 g;牡蛎壳粉的吸水效果最差,吸水率为0.70%,每5 g 的平均吸水量为3.48 g.
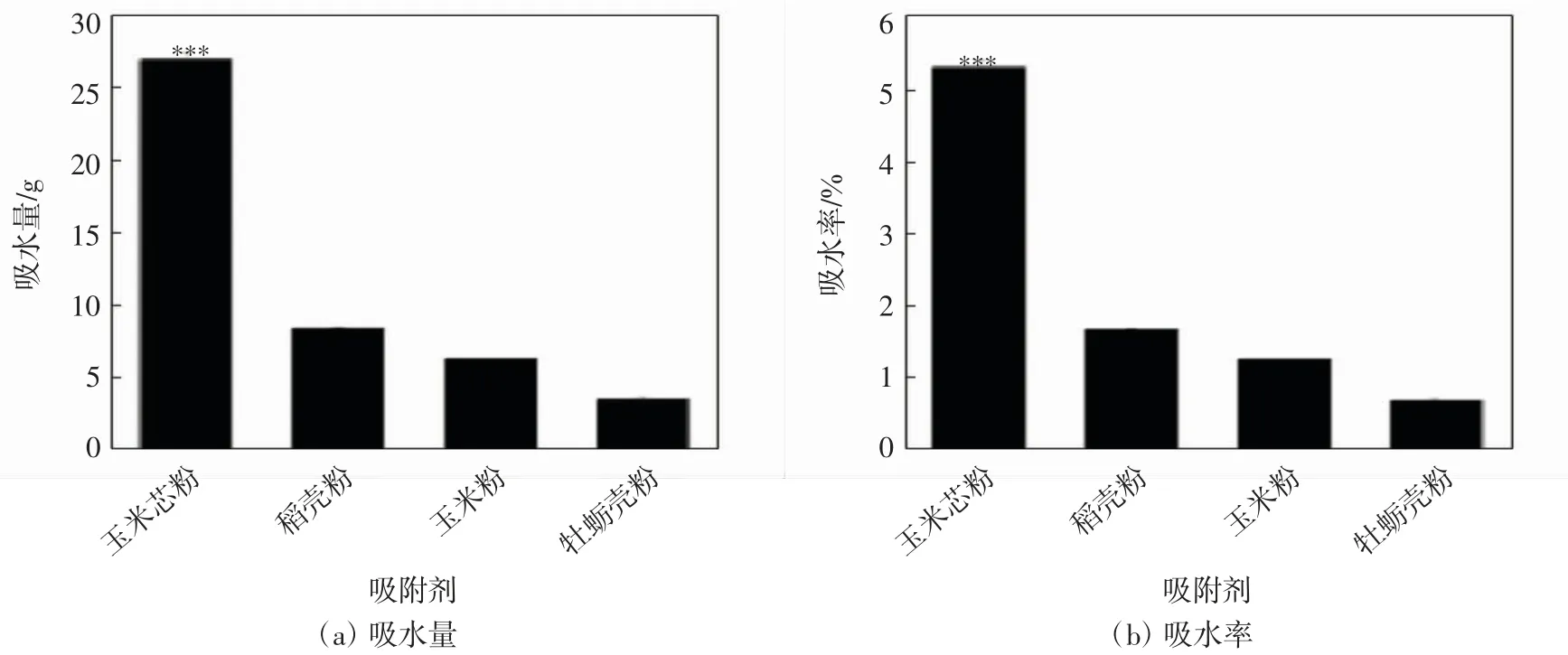
图2 不同吸附剂的吸水性Fig.2 Water absorption of different adsorbents
2.2.2 吸附剂对4 株菌的吸附效果
比较4 种吸附剂对益生菌的吸附效果,结果如图3 所示.由图3 可以看出,4 种吸附材料对不同菌株表现出不同的吸附能力.综合来看,牡蛎壳粉对酵母菌和格氏乳球菌的吸附效果最好,上清液中剩余的菌株浓度分别为3.95×107mL-1和14.0×107mL-1;对施氏假单胞菌和枯草芽孢杆菌吸附效果较差,上清液中剩余的菌株浓度分别为7.77×107mL-1和8.73×106mL-1.稻壳粉与牡蛎壳粉的吸附效果相似,对酵母菌和格氏乳球菌表现出较好的吸附效果,上清液中剩余菌株浓度分别为2.25×108mL-1和1.71×108mL-1;对枯草芽孢杆菌和施氏假单胞菌的吸附效果较差.比较4 种吸附剂,玉米粉对4 株菌都有较强的吸附性,上清液中菌体浓度总体上低于其他3 种吸附剂,尤其对枯草芽孢杆菌和施氏假单胞菌有显著吸附效果,上清液中菌体剩余浓度分别为4.53×106mL-1和1.73×107mL-1.而玉米芯粉只对枯草芽孢杆菌表现出显著吸附效果,上清液中剩余菌株浓度为0.46×106mL-1,对施氏假单胞菌、格氏乳球菌、酵母菌都表现出较差的吸附效果.因此最终将玉米粉确定为4 株菌混合发酵制剂的固定化吸附剂.
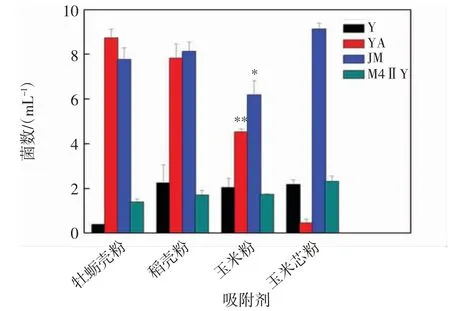
图3 不同吸附剂对益生菌的吸附效果Fig.3 Adsorption effect of different adsorbents on four probiotic strains
2.3 真空冻干保护剂的筛选
为了使益生菌制剂便于施用和保存,采用真空冷冻干燥技术,将混菌菌液干燥制成粉末制剂.在此过程中冻干保护剂的选择对最终制剂中菌种的活性至关重要,因此本研究对可溶性淀粉、甘油和脱脂奶粉这3 种冻干保护剂的作用效果进行了比较,结果如图4 所示.
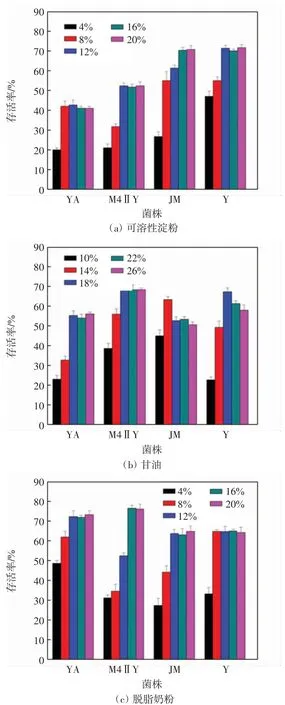
图4 冻干保护剂对益生菌的保护效果Fig.4 Protective effect of freeze-drying protective agents on four probiotec strains
由图4(a)可以看出,可溶性淀粉质量分数为8%时,枯草芽孢杆菌的存活率可达42.3%,当质量分数升高到12%时菌株存活率为42.6%,达到最高,当质量分数升高到16%及以上时枯草芽孢杆菌的存活率均无明显变化;可溶性淀粉质量分数为4%~12%时,随着质量分数的增加,格氏乳球菌和酵母菌的存活率逐渐升高,当质量分数达到12%时,二者的存活率均达到最高,分别为52.3%和71.3%,可溶性淀粉质量分数再升高到16%及20%时,二者的存活率无明显变化;而施氏假单胞菌在质量分数为16%的可溶性淀粉中存活率最高,为70.3%,质量分数升高到20%对其存活率几乎没有影响.由图4(b)可以看出,甘油作为保护剂时,枯草芽孢杆菌、格氏乳球菌和酵母菌在18%的甘油保护下存活率最高,分别达到55.3%、69.9%和67.3%,甘油体积分数升高到22%及以上对枯草芽孢杆菌、格氏乳球菌的活性无明显影响,但酵母菌的活性开始降低;而施氏假单胞菌在14%的甘油中存活率最高,达63.3%,甘油体积分数升高到22%及以上时其活性开始降低.由图4(c)可以看出,脱脂奶粉作为保护剂时,枯草芽孢杆菌和施氏假单胞菌在20%的脱脂奶粉中存活率最高,分别为72.3%和64.0%,格氏乳球菌在16%的脱脂奶粉中存活率最高,可达76.7%,酵母菌在8%和16%的脱脂奶粉中存活率相近并达到最高,分别为65.0%和65.1%,脱脂奶粉质量分数的进一步升高对4 个菌株的存活率均无显著影响. 综合来看,3 种冻干保护剂中脱脂奶粉对4 株菌的保护效果最好.
3 讨论与结论
本研究对枯草芽孢杆菌、格式乳球菌、施氏假单胞菌和酵母菌进行发酵共培养,制成复合益生菌制剂,探究培养基中无机盐、吸附剂和冻干保护剂对复合制剂的影响.合适的共发酵培养基可以实现复合益生菌制剂中菌株的共培养[15].培养基是实现共发酵培养的关键,不同组分对不同微生物产生的影响也不相同,组分间也会有交互作用,对微生物的生长和代谢产生影响.本研究对4 株菌共发酵初始培养基进行了优化与筛选,结果发现,在去除乙酸钠的培养基中枯草芽孢杆菌才会生长,而对其余菌株生长影响不显著;在共发酵培养基中分别去除柠檬酸氢二铵、硫酸镁、磷酸氢二钾和硫酸锰4 种无机盐均会对某些菌株的生长造成抑制,所以4 种无机盐在共发酵培养基中的添加十分必要.该实验结果表明,在共发酵过程中保证碳源、氮源两大营养要素的前提下,无机盐的种类对微生物的生长至关重要,后期将会进一步优化无机盐和有机营养成分的含量.Niu 等[16]研究发现,微生物对无机盐的需求量很少,通常低浓度起促进作用,而高浓度可能会产生抑制,最适的无机盐种类及浓度需根据菌种的生理特性等条件确定,这与本研究结果相似.现阶段复合益生菌制剂在生产和加工过程中面临的主要问题为菌体易受外界影响而失活,本研究发现,在制剂加工过程中,共发酵培养基中无机盐成分及比例对菌株的生长有显著影响.
微生物应用过程中,游离分散的细胞易受到环境因子的影响,导致菌的活性及密度不高,进而影响整个生物反应过程[17].针对这一问题,微生物固定化技术越来越受到研究者关注,该技术主要采用物理或化学方法将微生物通过吸附、共价结合、截留及包埋等方式固定在特定材料中,再将整体加入到反应体系中,以此提升微生物活性与密度[18-19].本研究首先通过固定化吸附剂对比实验,确定了菌株发酵液在进行冻干之前所需的最佳固定化吸附剂,4 种常用的固定化吸附剂牡蛎壳粉、稻壳粉、玉米粉和玉米芯粉中,最适合做4 株菌发酵液固定化吸附剂的是玉米粉.与其他3 种吸附剂相比,玉米粉对4 株菌都有较强的吸附性.吸水性实验结果表明,4 种吸附剂中,玉米粉的吸水效果较差,但是对菌体有较强的的吸附性,由此说明吸水性好的固定化吸附剂不一定对菌体的吸附效果好,还需要进一步实验证明,不能盲目选择.
液态的益生菌制剂通常对包装和保存条件要求较高,且容易造成菌体活性降低,不利于市面上流通及使用[20].真空冷冻干燥技术可将液态的益生菌制成固态的益生菌制剂,菌粉水分含量低,有利于长期保存,菌体存活率较高,发酵活力较好,遗传特性稳定[21],是目前制备微生态制剂的常用方法[22-23].然而,菌体在冷冻干燥过程中会暴露在额外的应激压力下,细胞内形成冰晶,再结晶过程中会对细胞膜造成损伤,降低成品活性[24],所以冻干保护介质成为提升菌体存活率的重要影响因素. 实际操作中由于益生菌细胞的差异,不同的冻干保护剂对不同菌体的保护效果有很大差异[25],如脱脂奶粉常用作乳酸菌的冻干保护剂,且效果较好[26].本研究进行了冻干保护剂筛选实验,采用的甘油、可溶性淀粉和脱脂奶粉均为常见的冻干保护剂.用3 种冻干保护剂对共培养的4 株菌进行冻干保护实验,结果显示,脱脂奶粉保护效果最好,每种菌的活性均可达到64%以上,脱脂奶粉最适质量分数确定为16%,将其作为复合制剂的冻干保护剂.昝继清等[27]在精酿啤酒酵母SCE14 冻干保护剂的筛选优化研究中发现,保护剂海藻糖、蔗糖、脱脂奶粉作为冻干保护剂效果较好;陈颜红等[28]在植物乳杆菌LP-7501S 冻干保护剂优化研究中发现,效果较好的保护剂为脱脂奶粉、山梨醇、蔗糖,而海藻糖作用效果不显著.由此可见,同一种保护剂对不同菌株作用效果不同,需要依据复合菌株的综合特性选择冻干保护剂.
本研究通过初始培养基中单一无机盐去除实验,确定了4 株水产养殖用益生菌的复合发酵培养基.通过固定化吸附剂和冻干保护剂的对比筛选实验,确定了复合益生菌使用的固定化吸附剂和冻干保护剂及其最佳使用浓度,为后续复合益生菌制剂的开发利用提供了实验依据.
