基于16S rDNA高通量测序研究肠道菌群与抗结核药物性肝损伤的相关性
2023-12-14姚琳顾斌斌严瑾瑜唐佩军沈兴华张建平吴妹英
姚琳 顾斌斌 严瑾瑜 唐佩军 沈兴华 张建平 吴妹英
结核病是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染导致的慢性传染病,虽然初治肺结核治疗效果显著,但药物不良反应却导致了治疗有效性及依从性的降低[1],其中以抗结核药物性肝损害(anti-tuberculosis drug-induced liver injury,ATLI)最常见[2]。肠道菌群对维系宿主健康起着重要作用,它除了与疾病发生有关,还能改变药物的代谢、疗效和毒性[3]。从生理学角度看,肠道菌群和肠道外器官间最重要的联系之一是“肠-肝轴”[4]。肠道菌群失调会引起肠道屏障完整性的丧失,加速肝脏损伤[5]。本研究旨在通过高通量测序及生物学分析技术,比较初治肺结核患者抗结核治疗前后肠道菌群的差异,研究药物治疗对初治肺结核患者肠道菌群的影响,以期识别出与ATLI可能相关的菌群标志物,为干预ATLI的发生开拓新思路。
资料与方法
一、资料收集
1 研究对象:收集2020年1月1日至2021年1月31日期间就诊于苏州市第五人民医院的25名初治肺结核患者的外周血和粪便标本。
2 诊断标准:初治肺结核的判定标准:依据《肺结核诊断》(WS 288—2017)[6],具有肺结核相关的临床表现与体征,影像学、病原学、病理学等检查有活动性结核病的依据;且从未进行抗结核治疗。ATLI的判定标准:依据中国《抗结核药物性肝损伤诊治指南(2019年版)》的诊断标准[7],至少满足以下一种及以上标准:(1)活动性肺结核患者在使用了一线抗结核药物之后,血清ALT水平≥3倍的正常值上限(ULN)和(或)TBIL升高≥2倍ULN。(2)血清 AST、ALP 和TBIL水平同时升高,且至少l项升高≥2倍ULN。(3)所有受试患者均需排除其他疾病或病因所引起的肝脏损伤。
3 纳入标准:(1)符合《肺结核诊断》(WS 288—2017)标准[6]。(2)年龄16~60岁。(3)首次确诊且未接受过治疗的患者。(4)口服标准化抗结核治疗方案:2HREZ/4HR。(5)入组前肝功能正常。(6)纳入本研究前1个月内未使用过抗生素、益生菌等微生态制剂等。(7)所有受试者均长期(5年以上)居住在苏州地区,并且都自愿签署了知情同意书。排除标准:(1)怀孕、哺乳期妇女。(2)有消化道疾病的患者。(3)伴有严重的单一脏器或多脏器功能不全等疾病者。(4)伴有糖尿病、自身免疫性疾病、HIV 等患者。(5)抗结核治疗中断或因病情调整治疗方案的患者。随访时间:本研究设定4次随访采样时间点。第1次在患者诊断为肺结核病但尚未开始用药时(T0),第2次在使用结核药物治疗1周时(T1),第3次在抗结核治疗2周时(T2),第4次使用结核治疗4周时(T4),采集这4个节点的粪便和血清学标本。4周内患者出现肝功能异常纳入肝损伤组(ATLI组),采集出现肝损伤时(Tinjury)的粪便样本,肝功能正常病例作为对照组(Non-ATLI 组)。本项目由苏州市第五人民医院伦理委员会批准(2021-026)。
二、研究方法
(一)运用纵向研究的方法,对入组患者抗结核药物治疗前后不同时间点的肠道菌群进行比较,观察抗结核药物使用过程中菌群的变化,探究肠道微生物群的改变与药物性肝损伤的关系。
(二)现场调查:收集研究对象的基本资料,包括性别、出生年月、体重、身高、居住地、吸烟史和饮酒史等;跟踪随访抗结核治疗期间患者发生肝功能异常的情况,记录肝损时患者的临床表现、血清学指标。
(三)实验研究
1 仪器与试剂 NanoDrop2000分光光度计(美国热电公司);DNA 测序仪(Mi Seq)(美国 Illumina 公司);PCR 扩增仪、电泳仪(美国 BIO-RAD 公司);金属浴、离心机(Thermo Fisher);MK-3酶联仪(芬兰雷勃公司);旋涡混合器(海门市其林贝尔仪器制造有限公司);微量加样器(μL)(德国 Eppendorf 公司);-80℃超低温冰箱、-20℃冰箱(美菱冰箱);ABI GeneAmp® 9700 型(美国ABI公司)。NEXTFLEX® Rapid DNA-Seq Kit(美国Bioo Scientific公司);E.Z.N.A.® soil DNA kit(美国Omega Biotek公司);AxyPrep DNA Gel Extraction Kit(美国Merck公司);Agarose-Molecular biology grade(美国Invitrogen 公司);QuantusTMFluorometer(普洛麦格生物技术有限公司);FastPfu DNA Polymerase、5×FastPfu Buffer(北京全式金生物技术有限公司);无水乙醇(南通化学试剂有限公司)。
2 标本收集与保存:(1)粪便样本的收集:患者清晨留取粪便后放至无菌粪便盒中,立即冷藏并送至实验室,采用无菌牙签取粪便样品中段0.2 g左右粪便标本放置于灭菌冻存管中,并保存在-80℃ 冰箱。(2)血清标本采集:抽受试者5mL左右外周静脉血,常温静置,3000r/min离心10min,取血清,-80℃保存备用。
3 肝功能指标检测:采用生化分析仪检测血清中谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBil)、直接胆红素(direct bilirubin,DBil)和碱性磷酸酶(alkaline phosphatase,ALP)水平。
4 粪便标本DNA提取和PCR扩增:(1)粪便微生物DNA的提取:严格按照E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)说明书进行入组患者粪便肠道微生物群落总DNA抽提。(2)DNA浓度及纯度测定:NanoDrop2000测总DNA浓度并记录;1%琼脂糖凝胶电泳测DNA的提取质量。抽提的粪便DNA-80℃保存备用。(3)16S rDNA高变区的PCR扩增:使用正向引物(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rDNA的V3~V4 高变区进行PCR扩增。(4)PCR产物纯化及浓度的测定:将PCR产物加入离心管后震荡混合,按照AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)说明书进行胶回收。(5)测序文库的构建及高通量测序:根据NEXTFLEX DNA测序试剂盒的操作步骤建库:①对基因组修复好的末端进行接头链接。②去除接头自连的DNA片段。③PCR扩增整合文库模板。④利用磁珠回收PCR产物,最终获得文库。通过NovaSeq PE250平台实施后续的测序。
5 测序数据处理:通过fastp(version 0.20.0)和FLASH(version 1.2.7)软件对序列数据进行质控和拼接。使用UPARSE软件(version 7.1),通过97%相似度对序列进行操作分类单元(Operational Taxonomic Unit,OTU)聚类,并去除嵌合体。使用RDP classifier(version 2.2) 对具有代表性的特定序列进行物种分类注释分析,比较Silva 16S rRNA数据库(v138),阈值设置为70%。Qiime2软件分析样本微生物群的Alpha多样性指数。使用 Qiime(版本 1.9.1)计算UniFrac 距离矩阵。采用R软件的limma包进行组间差异菌群的分析。
三、统计学处理
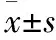
结 果
一、血清肝功能指标变化
按照初治肺结核患者抗结核治疗4周内是否出现肝损伤,将25名患者分为肝损组(ATLI)12人和对照组(Non-ATLI)13人。将肝损组(ATLI)和对照组(Non-ATLI)患者抗结核治疗前后的血清肝功能指标进行对比后发现,两组患者的血清肝功能指标在治疗前(T0)无统计学差异(P>0.05)(见图1A);而血清谷草转氨酶(AST)和 谷丙转氨酶(ALT)在肝损组患者出现肝损时(ATLI-Tinjury)和对照组患者治疗4周时(Non-ATLI-T4)对比具有统计学差异(P<0.05)(见图1B)。
图1 ATLI组和Non-ATLI组间不同时间点肝功能指标的比较
二、样本测序量及深度
79份样本经16S rDNA测序后进行双端序列的质控、拼接、去噪,最后得到2230137条高质量的序列,平均22385条序列/样本,共生成1850个ASVs。对每个样本随机抽取13746条序列绘制稀疏曲线,发现当测序深度达2000以上时曲线进入平台期,说明测序数据量足够大,测序深度满足实验要求(见图2)。
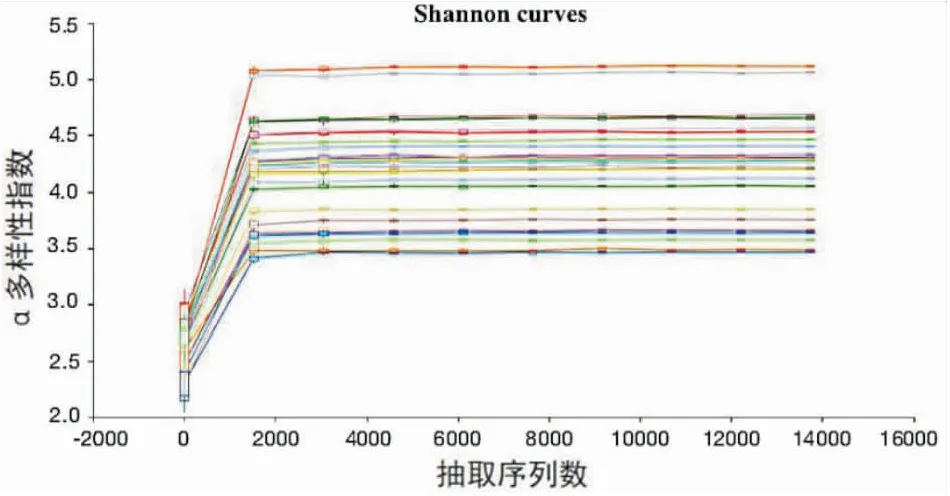
图2 稀疏曲线
三、肠道菌群的Alpha多样性
Alpha多样性系特定生态环境内物种的多样性,主要用以评价以下两方面:一是丰富度,即物种类别越高,丰富多样性越高;二是均匀度,即菌落中不同物种的数目均匀程度越高,多样性越高。因此,本研究选择表示物种多样性的Shannon指数、simpson指数,物种均匀度的evenness指数,物种丰富度的chao1指数、faith_pd指数以及observed_features指数来评价肠道微生物群Alpha多样性的变化情况。肝损组(ATLI)和对照组(Non-ATLI)在T0到T4的纵向比较中发现,chao1指数、faith_pd指数、observed_features指数在用药后1周、2周、4周下降均有统计学意义(P<0.05),而Shannon指数在肝损伤组和对照组从T0到T4期的纵向比较中均无统计学差异(P>0.05)。因此,从T0到T4期的过程中,肝损组和对照组均表现为仅肠道菌群的丰富度下降,而物种多样性未发生明显的改变(见图3)。
图3 ATLI组和Non-ATLI组从 T0到 T4时α多样性变化
四、肠道菌群的Beta多样性
Beta多样性是评价个体间微生物组成相似性的指标,受个体间物种种类差别的影响。通过对ATLI和Non-ATLI组患者T0到T4的动态比较后发现,两组患者在抗结核治疗前(T0) 和抗结核治疗4周(T4)对比时,在unifrac距离矩阵进行主坐标分析(Principle Co-ordination Analysis,PCoA)时均存在统计学差异(P<0.05)。表明肝损组和对照组患者在使用抗结核药物治疗后,肠道菌群的结构均发生了改变(见图4)。
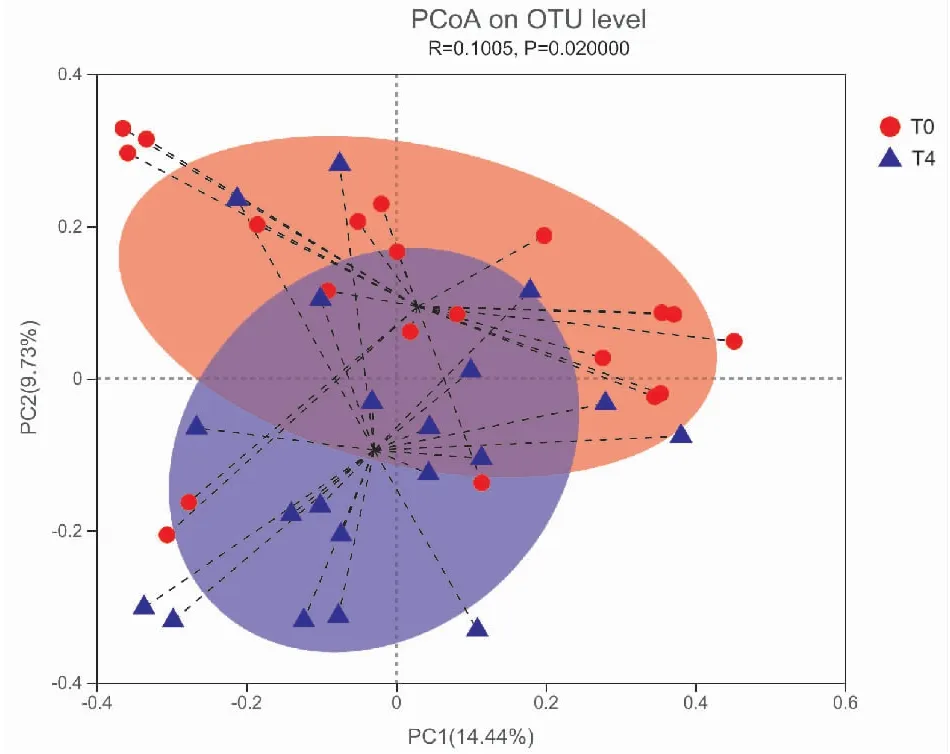
图4 ATLI组和Non-ATLI组从T0到T4时肠道菌群的PCoA分析
五、肠道菌群物种组成及组件丰度差异分析
79份样本1850个ASVs共识别出11个门、17个纲、29个目、64个科、223个属水平的细菌。Wilcoxon秩和检验分析表明,ATLI-TinjuryvsATLI-T0 时有12个菌属的相对丰度差异均有统计学意义(P<0.05),其中肠杆菌(Enterobacter)、梭杆菌(Fusobacterium)、乳杆菌(Lactobacillus)、柠檬酸杆菌(Citrobacter)、魏斯氏菌(Weissella)、塞内加尔厌氧菌(Senegalimassilia)在ATLI-Tinjury时的相对丰度明显高于ATLI-T0,而产粪甾醇真杆菌、瘤胃球菌科(Ruminococcaceae)、普拉梭菌科(Fusicatenibacter)、凸腹真杆菌、Family XIII AD3011 group、苏黎世杆菌科(Turicibacter)在ATLI-Tinjury时的相对丰度显著低于ATLI-T0(见表1)。
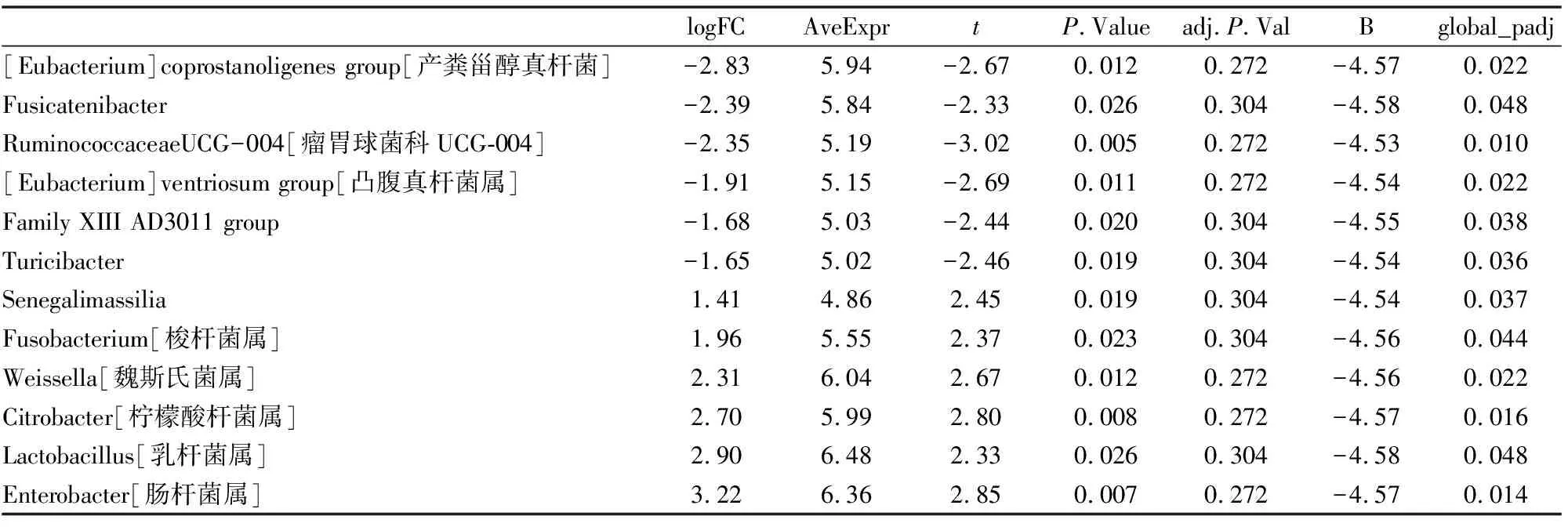
表1 肝损伤组从T0到Tinjury肠道菌群物种组成及组件丰度差异分析
(表2)结果显示,对照组治疗前及治疗4周的动态变化中,有21个菌属的相对丰度差异均具有统计学意义(P<0.05)。其中梭杆菌属(Fusobacterium)、DTU089在Non-ATLI-T4时的相对丰度均高于Non-ATLI-T0;而罗姆布茨菌(Romboutsia)、肠球菌(Enterococcus)、瘤胃球菌(Ruminococcus)、肠杆菌属(Enterobacter)、毛螺菌科(Lachnospiraceae)、消化链球菌(Peptostreptococcus)、Oribacterium、缠结优杆菌、metagenome、孪生球菌属(Gemella)、奇异菌属(Atopobium)、粪球菌(Coprococcus)、欧陆森氏菌(Olsenella)、明串珠菌属(Leuconostoc)、卡氏伯克霍尔德菌(Burkholderia-Caballeronia-Paraburkholderia)、塞内加尔菌属(Senegalimassilia)、Lachnospiraceae UCG-010、萨特氏菌(Sutterella)、eligens group菌的相对丰度在Non-ATLI-T4 中均低于Non-ATLI-T0。
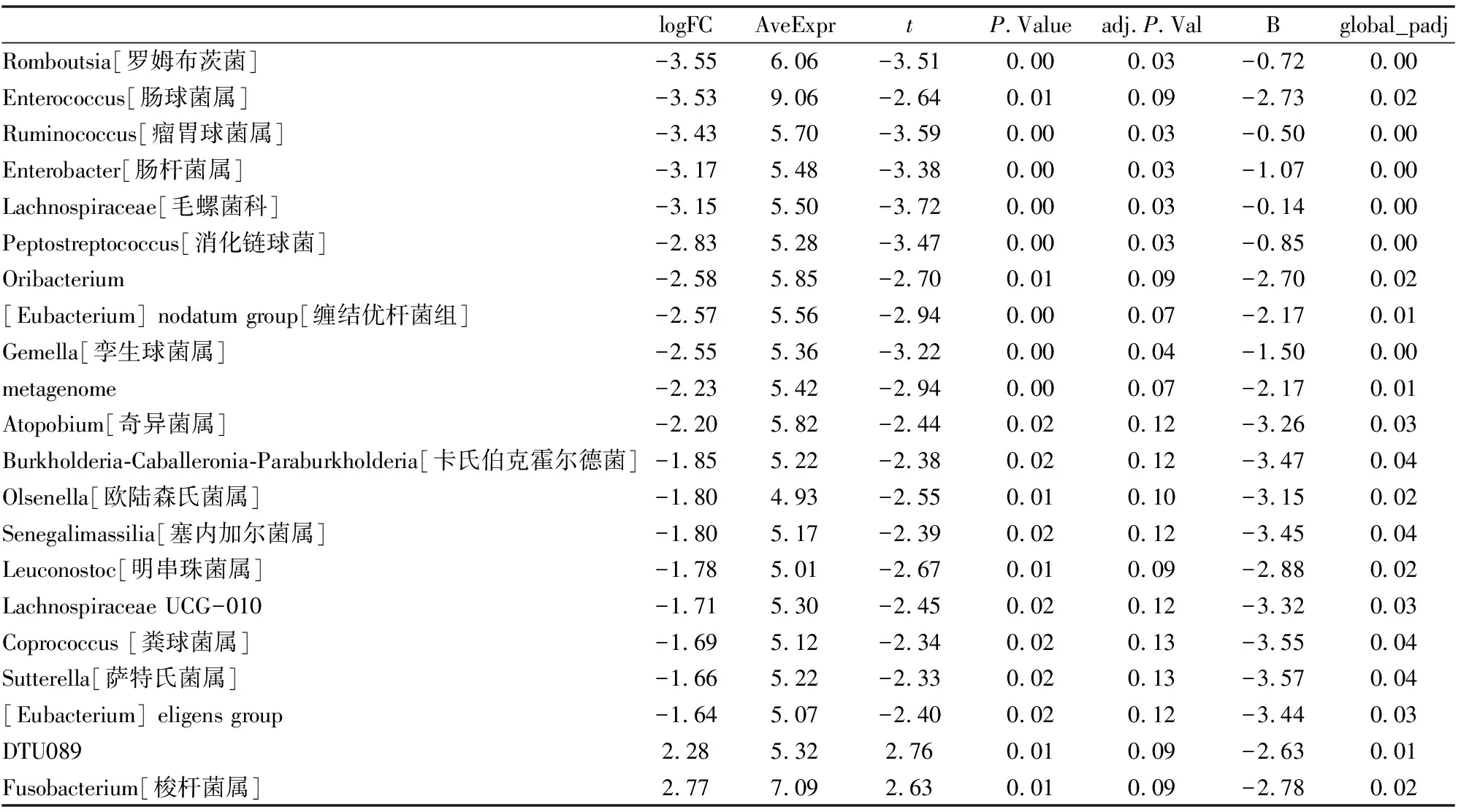
表2 对照组从T0到T4肠道菌群物种组成及组件丰度差异分析
六、LEfSe物种差异分析
如(图5)所示,通过LEfSe差异分析,在ATLI-TinjuryvsNon-ATLI-T4组之间共筛选出17个具有显著差异的分类群[P<0.05,线性判别分析(Linear discriminant analysis,LDA)>2]。其中,肠杆菌(Enterobacter)、乳杆菌(Lactobacillus)、Anaerosporobacter、Herbinix、变形杆菌(Proteus)、普雷沃氏菌属9(Prevotella 9)在ATLI-Tinjury组明显高于Non-ATLI-T4组;而产粪甾醇真杆菌(Eubacteriumcoprostanoligenes group)、Fusicatenibacter、奇异菌属(Atopobium)、埃格特菌(Eggerthella)、Solobacterium、瘤胃球菌科的UBA1819(Ruminococcaceae UBA1819)、缠结优杆菌(Eubacteriumnodatum group)、考拉杆菌属(Phascolarctobacterium)、Eubacteriumbrachygroup、Sellimonas、Lachnoclostridium在ATLI-Tinjury组明显低于Non-ATLI-T4组。
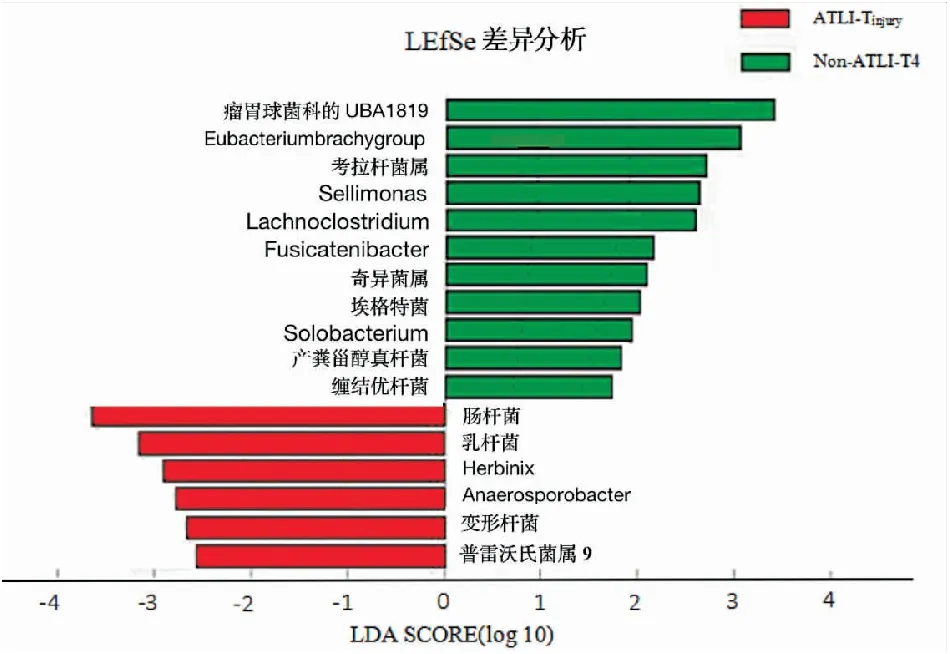
图5 肝损组和对照组的差异肠道菌群
七、肠道差异菌与肝功能指标的相关分析
将17个肠道差异菌和血清肝功能指标进行相关性分析,因Fusicatenibacter、奇异菌属、埃格特菌、Solobacterium、产粪甾醇真杆菌、缠结优杆菌丰度值低,无法进行后续的分析,故最终选取11个差异菌与血清学指标进行相关性分析。如(图6)所示,乳杆菌、Herbinix、Anaerosporobacter、[Eubacterium]brachy group、变形杆菌、普雷沃氏菌属9、肠杆菌、考拉杆菌属均与肝功能指标AST、ALT存在相关性。
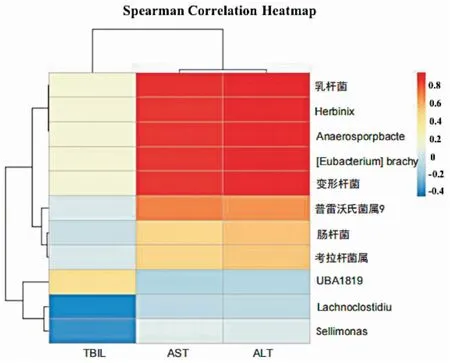
图6 组间差异菌与肝功能指标的相关性分析
讨 论
肠道菌群参与人体多个器官、组织的病理生理过程,在结核病发生、发展、治疗、转归中发挥了重要的作用。本研究将肠道菌群与抗结核药物性肝损伤建立联系,追踪随访了25例初治肺结核患者治疗前后肠道菌群的动态变化,并根据抗结核治疗4周内是否出现肝损伤分为肝损组(ATLI)和对照组(Non-ATLI),通过两组之间的比较,旨在找出与抗结核药物性肝损伤有关的差异肠道菌属。
肠道菌群可以通过影响免疫调节系统、生长代谢等方式间接影响机体的健康状况。已有研究证实,代表肠道菌群Alpha多样性的Shannon指数被作为微生物组健康的重要指标[8-9],Shannon指数越高,表明肠道菌群的多样性越高,机体越健康。肠道菌群多样性的下降与相关疾病的发生息息相关,Alpha多样性的下降可导致肥胖、代谢性疾病(糖尿病)、自身免疫性疾病、肿瘤、营养不良、炎症性肠病等。结核病的一线药物治疗实际上是一个持续的、多药联合的抗生素应用过程,已有研究证实抗结核药物可影响肠道微生物群的构成。本研究中观察了抗结核治疗前后不同时间段肠道菌群的纵向变化情况,发现在ATLI组和Non-ATLI组中,反映肠道菌群丰富度的chao1指数、faith_pd指数、observed_features指数均下降,而反应物种多样性的Shannon指数未发生明显改变,这表明抗结核药物及用药时间仅改变了肠道菌群的丰富度,而物种多样性未发生改变,这与Hu等人[10]的研究结果存在差异。本研究还进行了肠道菌群β多样性的分析,结果显示ATLI组和Non-ATLI组患者在使用抗结核药物治疗后,菌群结构均发生改变,表明抗结核药物影响了肠道菌群的整体结构。然而,在对ATLI-Tinjury组和Non-ATLI-T4组进行比较后发现,两组患者肠道菌群的β多样性并无明显差异。考虑到两组患者在治疗前的疾病是相同的,并且都接受了相同的治疗方案,因此无论抗结核治疗后是否出现肝损伤,疾病本身及药物种类对所有结核患者肠道菌群总的影响理论上应该是相似的。
除此之外,本研究还进行了肠道菌群物种组成及组件丰度差异的分析。通过Wilcoxon秩和检验分析发现,两组患者的肠道菌群都发生了明显改变,其中ATLI组在T0和Tinjury两个时间节点、Non-ATLI组在T0和T4两个时间节点分别有12和21个菌属的相对丰度发生了明显的变化。本研究的实验结果表明:梭杆菌属的相对丰度在两组患者抗结核治疗过程中均有增加,这与Fang[11]等人报道的结果不相符,导致研究差异的原因可能与测序方法不同、样本量的大小等因素均有关,故后续还需扩大样本量深入探讨梭杆菌属在两组患者抗结核治疗过程中的变化情况。瘤胃球菌属的相对丰度在两组患者抗结核治疗过程中均减少。两组患者在抗结核治疗过程中肠道菌群的物种组成及丰度变化既有差异,又有一定的相似性。原因可能有以下几个方面:首先,抗结核药物(尤其是广谱抗生素利福平)及肺结核疾病本身可导致肠道菌群的组成变化;其次,由于“肠-肺轴”的存在,肺结核病所处的不同状态也可影响菌群的组成[12];最后,两组之间的差异性基于“肠-肝轴”理论,Chen[13]等人研究发现,肠道菌群的变化与肝脏损伤存在显著的相关性。肝损伤时,肠道微生物群中的瘤胃球菌、毛螺菌科、乳杆菌等有益菌的相对丰度明显降低,肠道细菌致病性相关基因富集,可能会影响药物及其代谢物和相关异生物的代谢和毒性,影响了宿主的平衡[14-16]。
最后,本研究还进一步比较分析了两组间的差异菌,并根据LEfSe分析,最终发现17个具有显著差异的分类群,分别为肠杆菌、乳杆菌、Herbinix、Anaerosporobacter、变形杆菌、普雷沃氏菌属9、产粪甾醇真杆菌、Fusicatenibacter、奇异菌属、埃格特菌、Solobacterium、瘤胃球菌科的UBA1819、缠结优杆菌、考拉杆菌属、Eubacteriumbrachygroup、Sellimonas和Lachnoclostridium。本研究的最终目标是找出与ATLI有关的菌群标志物,我们将找到的可能与肝功能受损相关的菌属与肝功能AST、ALT、TBIL、DBIL指标进行相关性分析,发现乳杆菌、Herbinix、Anaerosporobacter、[Eubacterium]brachy group、变形杆菌、普雷沃氏菌属9、肠杆菌、考拉杆菌属均与肝功能指标AST、ALT相关,提示这些菌属可能与抗结核药物性肝损伤的发生有关。这与吴冬雪[17]等人研究所涉及的与肝损伤有关的菌属不一致,这可能与不同地域研究对象自身肠道菌群特征差异有关。
综上所述,本研究通过将抗结核治疗期间出现肝损伤及未出现肝损伤的患者肠道菌群进行对比,分析了两组之间肠道菌群的变化,并试图寻找与ATLI有关的肠道菌属。最终发现,初治肺结核患者在口服抗结核药物治疗后不同时间段的肠道菌群多样性和β多样性虽未见明显差异,但物种丰富度及物种组成均发生了明显的变化。本研究也找出了药物性肝损伤时的细菌物种,为今后以肠道微生物为靶点干预抗结核药物性肝损伤提供新的研究思路。
