超分割放疗对局限期小细胞肺癌患者T淋巴细胞亚群和肿瘤标记物的影响
2023-12-14王泽伟王伟佳张洪岩
王泽伟 王伟佳 张洪岩
小细胞肺癌是恶性程度较高的肺癌之一,依据美国退伍军人医院定义[1]分为局限期和广泛期,局限期小细胞肺癌是局限于一侧胸腔,且与原病灶覆盖同一视野单个照射野,临床表现为增殖速度快、早期转移及易复发等特点,预后不佳,严重影响患者的生活质量[2]。由于局限期小细胞肺癌对于放化疗均较为敏感,化疗联合胸腔放疗综合疗法逐渐成为其标准治疗方案,具有一定临床疗效,但大多数患者仍在短时间内发生肿瘤复发及远处转移,若未得到有效控制,则肿瘤恶化程度加重,患者预后较差[3]。随着医学技术的快速发展,超分割放疗模式被提出,超分割放疗联合化疗为Ⅰ类推荐方案[4],理论上,采用超分割方式胸腔放疗应该优于常规分割放疗,但也有专家提出超分割放疗可能会增加毒副作用[5]。但在临床治疗中,超分割放疗对此尚缺乏统一结论,鉴于此,本研究将超分割放疗用于局限期小细胞肺癌患者,探讨其对T淋巴细胞亚群和肿瘤标记物的影响,并观察其生存质量情况。
资料与方法
一、研究对象
选取2018年1月—2019年12月本院收治的64例局限期小细胞肺癌患者,按照随机数字表法分成观察组与对照组,各32例。纳入标准:(1)经病理检查证实为小细胞肺癌,经影像学检查(颈胸腹部CT、脑磁共振、全身骨扫描等)证实为局限期小细胞肺癌。(2)年龄为18~75岁。(3)预计生存期>3个月,KPS评分≥70分。(4)患者均知情本研究并签署知情同意书。排除标准:(1)伴有放疗或化疗禁忌证者。(2)非小细胞肺癌或混合型。(3)分期为广泛期。(4)重度心肺功能异常及骨髓功能障碍者。(5)既往有小细胞肺癌病史或其他肿瘤病史。(6)放弃治疗者。(7)近6个月内出现过心肌梗死病史。(8)既往无化疗、胸部放射治疗史。本研究经廊坊市第四人民医院伦理委员会批准。
二、方法
化疗采用标准EP方案,同期依托泊苷100 mg/m2d1-d3+顺铂75 mg/m2d1(21 天为1个周期),化疗期间辅助予止吐,保肝等治疗。
首先患者双手上举抱头,仰卧于真空固定袋上行真空固定,腹带固定,平稳呼吸,在螺旋CT下增强扫描胸部,层厚为5 mm,CT扫描定位后经CT模拟系统或三维治疗计划系统设计放疗计划,图像重建后,由三位以上医师共同勾画治疗靶区及周围重要器官,靶区勾画按照相关规定,大体肿瘤体积范围包括原发灶、阳性淋巴结大体位置(CT扫描短径≥1 cm);临床靶体积是以化疗后肿瘤范围及外扩0.8 cm区域;计划靶体积为临床靶体积外扩1~1.5 cm区域。按照化疗后病变范围,采用3~6个照射野,90%以上的等剂量线覆盖计划靶体积,周围组织器官受照射剂量均控制在可接受范围内,应用Presise直线加速器(医科达公司生产),使用3~6个适形照射野,照射源为6MV-X射线,在患者治疗期间每周均给予胸片检查,将每次的结果与治疗前相对比,确定靶区选择的准确性。对照组予常规分割放疗,总剂量为70 Gy,2 Gy/次,1次/天,每周5 天。观察组予超分割放疗,总剂量为45 Gy,1.5 Gy/次,2次/天,间隔时间≥6 h,每周5 天。
两组均先进行1个周期的放化疗,后采用化疗与放疗序贯治疗,均完成3个周期化疗。
三、观察指标
(1)比较两组疗效。两组治疗完成后4个周期,行胸部CT评价疗效,并依照世界卫生组织发布的实体瘤疗效进行评定[6],将其分为完全缓解(肿瘤完全消退及显著改善免疫功能)、部分缓解(肿瘤退缩≥50%且无新病灶及免疫功能有所改善)、稳定(肿瘤退缩<50%或增大<25%,免疫功能稍有改善)、进展(肿瘤增大≥25%或有新病灶,免疫功能无改善),总有效率=(完全缓解+部分缓解)例数/总人数×100%。
(2)比较T淋巴细胞亚群、肿瘤标记物水平。分别于治疗前及治疗4个周期后抽取患者外周空腹静脉血3 mL,分离血清,应用免疫荧光法检测血清CD4+、CD8+、CD4+CD8+水平;经放射免疫法检测血清癌胚抗原(CEA)、糖类蛋白-125(CA-125)、细胞角蛋白19可溶性片段(CYFRA21-1)水平。试剂盒由福瑞生物工程公司提供。
(3)比较两组不良反应情况。密切观察两组化疗、放疗期间有无不良反应情况。
四、统计学方法
结 果
一、两组一般资料比较
两组一般资料比较无统计学差异(P>0.05)(见表1)。
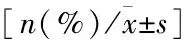
表1 两组一般资料比较
二、两组疗效比较
观察组治疗总有效率(87.50%)较对照组(65.63%)高(P<0.05)(见表2)。
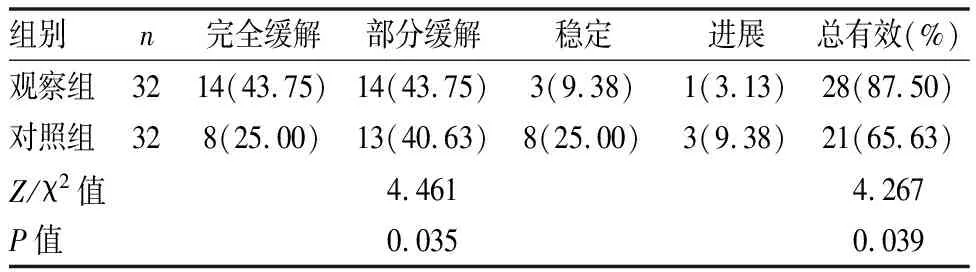
表2 两组疗效比较[n(%)]
三、两组T淋巴细胞亚群比较
两组治疗后CD4+、CD4+CD8+较治疗前升高,CD8+较治疗前降低,观察组治疗后CD4+、CD4+CD8+较对照组升高,CD8+较对照组降低(P<0.05)(见表3)。
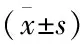
表3 两组T淋巴细胞亚群比较
四、两组肿瘤标记物比较
两组治疗后CEA、CA-125、CYFRA21-1均较治疗前降低,观察组治疗后CEA、CA-125、CYFRA21-1均较对照组降低(P<0.05)(见表4)。
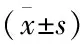
表4 两组肿瘤标记物比较
五、两组不良反应发生率比较
观察组放射性食管炎发生率较对照组高(P<0.05)(见表5)。

表5 两组不良反应发生率比较 [n(%)]
六、两组总生存时间比较
所有均随访3年,对照组生存时间中位数为21个月,95%CI:20.136~21.864,观察组生存时间为22个月,95%CI:20.385~23.615,两组比较,无显著差异(χ2=1.450,P=0.229),其生存曲线(见图1)。
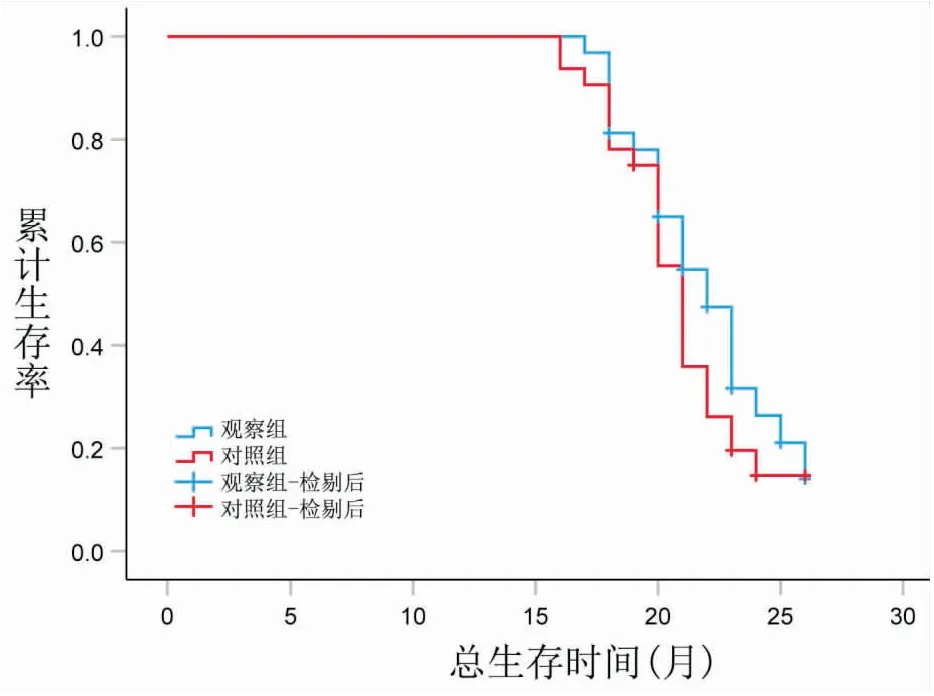
图1 两组总生存时间比较
讨 论
由于局限期小细胞肺癌的生物学行为及临床特征,易在早期发生全身性扩散转移,而其发病率逐年增加,已成为威胁全球公共卫生问题之一[7-8]。目前对于局限期小细胞肺癌,临床仍主要采用同步放疗联合EP方案化疗等综合治疗[9],由于在确诊时大多为晚期,多以常规分割放疗为主,但可引起多种毒副作用,整体疗效并不十分理想[10]。因此,安全有效的治疗方案对局限期小细胞肺癌患者尤为重要。
既往研究表明,炎症反应可刺激CD4+细胞被激活,诱导Th1类因子分泌干扰素,促进免疫应答,进而提高机体免疫功能[11]。CEA是大肠癌组织所产生的糖蛋白肿瘤标志物,在肺癌组织中呈现高度表达状态;CA-125是可与单克隆抗体OC125结合的糖蛋白,其水平与肿瘤病情进展密切相关[12-13]。CYFRA21-1是肺组织肿瘤上皮中含量最高的细丝蛋白,可作为检测肺癌的灵敏指标[14]。本研究结果显示,观察组治疗总有效率较对照组高;两组治疗后CD4+、CD4+CD8+较治疗前升高,CD8+较治疗前降低,观察组CD4+、CD4+CD8+较对照组升高,CD8+较对照组降低;两组治疗后CEA、CA-125、CYFRA21-1均较治疗前降低,观察组均较对照组降低,提示超分割放疗用于局限期小细胞肺癌患者,可提高免疫功能,降低肿瘤标记物水平,整体疗效较好。超分割放疗相较于常规分割放疗,能通过降低放疗的总剂量及增加每天治疗剂量等分割方式,可进一步缩短治疗总时间,降低肿瘤细胞增殖的风险,对肿瘤细胞有较好的杀伤效果。在理论上,放射剂量越高,可增强肿瘤杀伤效果,超分割放疗虽缩短了总体放疗时间,但增加每天的放疗剂量,进一步改善免疫功能并降低肿瘤标记物水平,以达到抑制癌细胞加速再生殖的目的[15-16]。因此,超分割放疗联合EP化疗,能弥补放疗缺陷,促使肿瘤细胞聚合、癌细胞停止分裂,并阻滞DNA复制转录,从而抑制肿瘤增殖。
本研究进一步对其生存曲线分析,对照组总生存时间中位数为21个月,观察组总生存时间为22个月,说明超分割化疗与常规放疗的生存时间相似。相关研究表明[17],超分割化疗60 Gy∶45 Gy,60 Gy组的两年生存期达73%,显著优于45 Gy组的48%,说明肿瘤患者在耐受不良反应的情况下,增加化疗总剂量可改善生存周期。另由于实际操作受到多种因素影响,临床运用常规放疗方法的次数较多[18]。故在局限期小细胞肺癌患者放化疗中,应用超分割放疗与常规分割放疗生存获益相当,分析可能因为观察时间较短,或样本量较少的缘故,尚需进一步扩大样本量、多中心进行研究。此外,观察组放射性食管炎发生率较对照组高,说明超分割放疗对局限期小细胞肺癌患者的主要毒性反应为放射性食管炎,临床降低毒副作用不明显。
综上所述,超分割放疗用于局限期小细胞肺癌患者,可提高免疫功能,降低肿瘤标记物水平,近期疗效较好,且未明显延长生存时间。
