虫草素对大鼠肾缺血再灌注损伤铁死亡的影响*
2023-12-14罗进辉童运涛张慧范倩倩吕彬
罗进辉,童运涛,张慧,范倩倩,吕彬
1.武汉科技大学附属汉口医院,湖北 武汉 430012; 2.华润武钢总医院,湖北 武汉 430080
肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)是临床常见的急性损伤性疾病之一,肾移植、肾结石切除术、部分肾脏切除术等外科手术中肾脏血流量被阻断均可引起RIRI[1],该病致死率较高,且增加了患慢性肾病和终末期肾病的风险,影响全球30%~80%的肾移植患者[2]。氧化应激反应、细胞因子释放、活性氧生成和毒物积累均是导致RIRI发病的危险因素,而这些病理生理反应均会引起肾小管上皮细胞损伤,导致细胞死亡[3]。最新的研究表明,铁死亡等细胞程序性死亡参与RIRI的发生发展过程[4]。与常见的细胞凋亡、细胞自噬等过程不同,铁死亡作为铁离子依赖的细胞氧化性死亡方式,主要发生在线粒体中,影响细胞内脂质氧化代谢功能[5]。虫草素是从传统中药野生蛹虫草中提取的天然活性物质,《新华本草纲要》记载:“蛹草性平,味甘,有补精髓,益肺肾,止咳化痰之功效。”虫草素作为虫草属真菌的主要成分,现代药理研究发现其具有抗氧化、抗炎、抗肿瘤、神经保护和肾脏保护等生物活性,在多种炎症性疾病和氧化应激损伤疾病中发挥重要调节作用[6-7]。然而,目前尚不清楚虫草素在RIRI铁死亡中的作用和相关机制。基于此,本次研究采用虫草素处理RIRI模型大鼠观察其对大鼠肾脏组织损伤及铁死亡的影响,探讨其可能存在的机制,旨在为虫草素应用于RIRI疾病的临床治疗提供实验依据。
1 材料
1.1 动物24只雄性SD大鼠购自湖北省实验动物研究中心,均为6~8周龄,体质量为180~220 g,饲养于空气湿度为50%,相对温度为23 ℃条件下,给予充足的饮用水和食物,适应性喂养1周后。本研究经武汉市汉口医院伦理委员会审批通过,伦理编号:hy11202114。
1.2 药物与试剂虫草素(上海懋康生物科技有限公司,货号:MS0075);铁死亡抑制剂Ferrostatin-1(美国selleck生物科技有限公司,货号:S7243);铁离子比色法检测试剂盒(Abcam公司,货号:ab83366);二氯二氢荧光素-乙酰乙酸酯(dichlorodihydrofluorescein acetoacetate,DCFH-DA)培养液(西安百萤生物科技有限公司,货号:15204);谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、溶质载体家族7成员11(recombinant solute carrier family 7 member 11,SLC7A11)、铁蛋白重链(ferritin heavy chain 1,FTH1)、长链脂酰辅酶A合成酶4(long chain acyl CoA synthase 4,ACSL4)、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1(nicotinamide adenine dinucleotide phosphate oxidase 1,NOX1)、环氧合酶-2(cyclooxygenase-2,COX2)一抗(山羊抗小鼠IgG抗体,美国Thermo Fisher Scientific公司,货号:MA5-32827、711589、701934、PA5-27137、PA5-27882、PA5-88606、MA5-14568)及相应二抗(Abcam公司,山羊抗小鼠IgG抗体,美国Thermo Fisher Scientific公司,货号:MA5-32827、711589、701934、PA5-27137、PA5-27882、PA5-88606、MA5-14568);ECL显色发光剂(福州奥研实验器材有限责任公司,CAS号:BL523B)。
1.3 仪器显微镜(北京瑞科中仪科技有限公司,型号:Olympus CX33);全自动生化仪(武汉宏康世纪科技发展有限公司,型号:XR220);流式细胞仪(上海三崴医疗设备有限公司,型号:FACSVia);微孔板阅读器[赛默飞世尔科技(中国)有限公司,型号:Varioskan LUX]。
2 方法
2.1 RIRI大鼠分组及模型构建将24只大鼠随机分为对照组、模型组、虫草素组和铁死亡抑制剂组,每组各6只,除对照组外,其余3组大鼠均构建RIRI模型。造模开始前,虫草素组大鼠腹腔注射 8 mg·kg-1虫草素,铁死亡抑制剂组大鼠腹腔注射5 mg·kg-1Ferrostatin-1,对照组和模型组给予等剂量生理盐水腹腔注射,连续注射7 d[8]。7 d后采用45 mg·kg-1戊巴比妥钠腹腔注射将大鼠麻醉,待麻醉生效后,去除大鼠背部皮毛并消毒,沿背部脊椎和肋骨下缘1 cm处剪开皮肤、肌肉,暴露肾脏,分离肾动脉,使用动脉夹夹闭两侧肾动脉,缺血处理 1 h 后松开动脉夹,恢复血流,当观察到肾脏动脉充盈,颜色由暗红变为鲜红时,表明RIRI模型构建成功[9]。对照组大鼠仅切开暴露肾动脉,不使用动脉夹夹闭。所有大鼠均在确定无脏器损伤及出血后将肠管放至原位,使用5-0细线逐层缝合关腹,体积分数75%酒精常规消毒后保持常规饲养。各组大鼠均未出现死亡,最终纳入统计的每组大鼠均为6只。
2.2 肾脏病理损伤观察术后24 h,取大鼠肾组织,切成5 mm3小块,脱水透明封片后制成石蜡切片,采用过碘酸雪夫氏染色(periodic acid-schiff stain,PAS)观察肾脏病理损伤情况。将石蜡切片用梯度酒精脱水后以0.5%过碘酸水溶液氧化 30 min,自来水冲洗15 min后加入schiff试剂浸染15 min,冲洗15 min后苏木精染液复染5 min,冲洗15 min后加入盐酸酒精处理1~3 s,自来水冲洗 10 min 后梯度酒精和二甲苯溶液脱水,明胶树脂封片,显微镜下观察各组大鼠肾组织病理染色情况。
2.3 肾脏指标检测手术24 h后,采集各组大鼠颈总动脉血,采用全自动生化仪检测各组大鼠颈总动脉血中血尿素氮(blood urea nitrogen,BUN)和血肌酐(serum creatinine,Scr)含量。
2.4 Fe2+、活性氧(reactive oxygen species,ROS)和线粒体超氧化物水平检测将各组大鼠肾组织以PBS缓冲液冲洗,加9倍量匀浆介质研磨,4 000 r·min-1离心10 min(离心半径10 cm),取上清液,采用铁离子比色法测定肾组织中Fe2+含量。将组织匀浆上清液加入96孔板中,每孔加入裂解液 200 μL,摇床裂解2 h;将3 mmol·L-1标准品稀释为300 μmol·L-1、150 μmol·L-1、75 μmol·L-1、37.5 μmol·L-1、18.75 μmol·L-1、9.38 μmol·L-1、4.69 μmol·L-1,设定对照孔。将4.5%高锰酸钾溶液与PBS按11混合配置为混合液,混合均匀后,60 ℃孵育60 min,冷却室温,加铁离子检测剂 30 μL,混匀,室温孵育0.5 h,取200 μL加入96孔板培养,多功能酶标仪检测吸光度(550 nm波长处),绘制标准曲线,获得Fe2+含量。将肾组织置于预冷的50 mL离心管中,PBS冲洗3次后与ROS检测试剂盒中25 μmol·L-1DCFH-DA培养液在37 ℃条件下避光培养30 min,30 min后PBS再次冲洗3次,常规消化后以 1 800 r·mim-1的转速离心5 min,丢弃上清液,剩余部分于1 mL PBS缓冲液中悬浮,采用流式细胞仪检测各组大鼠肾组织中的ROS水平,并于显微镜下观察染色情况。此外,取各组大鼠肾组织,按照先前的方法分离出肾小管上皮细胞[10],使用Mitosox荧光探针检测线粒体超氧化物水平,将细胞在Mitosox Red的hank缓冲液中培养30 min,PBS缓冲液清洗细胞,于波长 488 nm 和525 nm下检测Mitosox荧光强度,并根据染色及未染色的细胞于吸收波长为488 nm下进行Mitosox红光阈值调整。
2.5 细胞凋亡检测取各组大鼠肾组织,采用 Percoll 密度梯度离心法[11]分离培养肾小管上皮细胞,再采用Annexin V/7-amino-actinomycin D染色法[12]检测细胞凋亡水平。将5×105个大鼠肾上皮细胞重悬于100 μL PBS缓冲液中,37 ℃避光条件下加入2.5 μL PE-Annexin V和2.5 μL 7-AAD,共同孵育15 min,再加入400 μL缓冲液,采用一次性管轻轻吹匀细胞后以流式细胞仪检测各组大鼠肾小管上皮细胞凋亡率,设置FL1通道检测Annexin V绿色荧光,FL3通道检测AAD红色荧光。
2.6 Western Blot检测相关蛋白表达水平采用Western Blot法检测各组大鼠肾组织中GPX4、SLC7A11、FTH1、ACSL4、Nrf2、NOX1和COX2的蛋白表达水平,每组取3只,实验重复3次。使用 RIPA 裂解液提取总蛋白,BCA法对蛋白质浓度进行定量检测,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后电转移至膜,室温下采用5%脱脂奶粉封闭 2 h,4 ℃下与GPX4、SLC7A11、FTH1、ACSL4、Nrf2、NOX1、COX2一抗(稀释比例均为11 000)避光孵育过夜,Tris磷酸盐缓冲液清洗后用辣根过氧化物酶标记的荧光二抗(稀释比例均为1500)37 ℃ 下孵育1 h。Tris磷酸盐缓冲液清洗3次后,避光条件下采用ECL显色发光剂进行显影,以GAPDH作为内参计算各组蛋白灰度值。

3 结果
3.1 各组大鼠肾脏病理损伤对比PAS染色结果显示,对照组大鼠肾小囊、肾小球和肾小管结构清晰,肾小管上皮细胞排列整齐,基底膜完整;模型组大鼠肾小囊囊腔、肾小管管腔扩张明显,肾小球萎缩,间隙增加,伴有间质水肿等明显损伤特征,肾小管基底膜不规则增厚;虫草素组和铁死亡抑制剂组相较于模型组肾小囊囊腔、肾小管管腔扩张程度明显减轻,肾小球体积相对正常,间隙增加和间质水肿明显改善,基底膜完整度更好,PAS阳性染色明显减少。与对照组比较,模型组大鼠肾组织PAS阳性面积比例明显升高(P<0.01);与模型组比较,虫草素组和铁死亡抑制剂组PAS阳性染色面积比例明显降低(P<0.01),见图1。
3.2 各组大鼠BUN、Scr含量对比与对照组比较,模型组BUN和Scr含量显著升高(P<0.01),而与模型组比较,虫草素组和铁死亡抑制剂组BUN和Scr含量显著降低(P<0.01),见图2。
3.3 各组Fe2+、ROS 和线粒体超氧化物水平对比与对照组比较,模型组Fe2+、ROS和线粒体超氧化物水平显著升高(P<0.05);与模型组比较,虫草素组和铁死亡抑制剂组Fe2+、ROS和线粒体超氧化物水平显著降低(P<0.05),见图3。
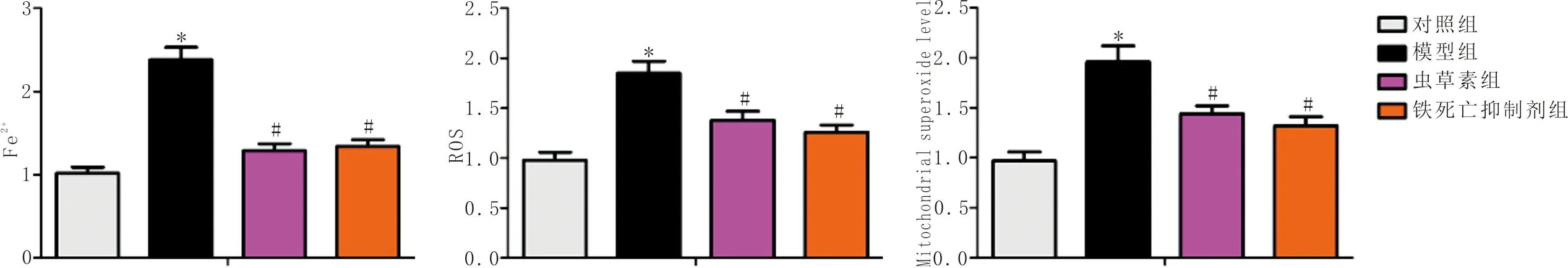
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。图3 各组Fe2+、ROS 和线粒体超氧化物水平对比
3.4 各组细胞凋亡水平对比与对照组比较,模型组细胞凋亡率显著升高(P<0.01);而与模型组比较,虫草素组和铁死亡抑制剂组细胞凋亡率显著下降(P<0.01),见图4。

注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。图4 各组细胞凋亡水平对比
3.5 各组铁死亡相关蛋白表达水平对比与对照组比较,模型组GPX4、SLC7A11、FTH1和Keap1的蛋白表达水平显著下调(P<0.05),ACSL4、Nrf2、NOX1和COX2的蛋白表达水平显著上调(P<0.05);而与模型组比较,虫草素组和铁死亡抑制剂组GPX4、SLC7A11、FTH1和 Keap1蛋白表达水平显著上调(P<0.05),ACSL4、Nrf2、NOX1和COX2的蛋白表达水平显著下调(P<0.05),见图5。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。图5 各组铁死亡相关蛋白表达水平对比
4 讨论
肾脏作为人体生成尿液、清除代谢产物、吸收有用物质的关键器官之一,对于维持机体酸碱平衡、电解质平衡和内分泌稳定具有重要意义,当肾功能受损时,不但影响肾脏自身功能,还会影响心脏、大脑等其他器官的稳定。RIRI是肾移植、肾切除、大出血等外科手术中常见并发症,也是慢性肾衰竭和终末期肾病的主要诱因之一[13]。随着对RIRI的不断探索,研究发现,机体炎症反应、氧化应激反应等多种生理病理在RIRI发病时被激活,参与介导RIRI的疾病进展[14]。铁死亡作为一种调节性细胞死亡过程,在多种癌症疾病、中枢神经系统疾病、心脑血管疾病以及缺血再灌注损伤疾病中发挥重要作用[15]。研究表明,铁死亡通过调控铁积累、脂质氧化及相关基因表达在RIRI的发生发展过程中发挥关键作用[16]。
本次研究通过构建RIRI大鼠模型,探究中药提取物虫草素对RIRI大鼠铁死亡的影响。RIRI模型是目前公认的较为稳定、适用于分析药物作用的动物模型之一[17],本次研究通过暴露大鼠肾动脉,采用动脉夹诱导缺血1 h后恢复供血的方式构建RIRI模型,PAS染色观察各组大鼠肾组织病理损伤情况,结果显示模型组大鼠肾小囊囊腔、肾小管管腔扩张明显,肾小球萎缩,间隙增加,伴有间质水肿等明显损伤特征,且PAS阳性染色明显增多,表明模型大鼠肾脏病理改变明显,这也与谭微等[18]研究结论相符。Ferrostatin-1作为常用的铁死亡抑制剂,在本次研究中作为天然活性物质虫草素的对照组,二者分别处理RIRI模型大鼠,结果显示,铁死亡抑制剂和虫草素均可显著改善RIRI大鼠肾脏病理损伤水平,显著改善肾功能指标BUN和Scr水平,对模型大鼠的肾功能有较好的保护作用。虫草素是有着“黄金草”之称的冬虫夏草的主要活性成分,是第一个从真菌中分离出的核苷类抗生素,具有较好的安神和补肾功效[19]。虫草素的独特之处在于其即可补肺阴,又可补肾阳,对于调节阴阳平衡具有极高的价值。现代药理学研究提示,虫草素在保健、抗衰老、神经保护、肺肾保护、抗肿瘤、抗炎、抗氧化和免疫调节方面同样表现优异[20]。本次研究中虫草素对RIRI大鼠肾功能的保护作用就在于其优秀的抗炎、抗氧化生物特性,通过灌胃虫草素减轻因缺血再灌注介导的氧自由基产生,抑制氧化应激反应[21],使其免受缺血再灌注导致的肾脏损伤,保护肾功能[22]。
本次研究结果发现,虫草素可显著抑制模型大鼠肾脏组织内Fe2+、ROS和线粒体超氧化物水平,抑制肾上皮细胞凋亡,上调铁死亡相关蛋白GPX4、SLC7A11、FTH1和Keap1的表达水平,下调ACSL4、Nrf2、NOX1和COX2的表达水平,表明虫草素通过调控铁死亡相关蛋白的表达水平,减少肾脏内铁积累,抑制氧化应激反应、线粒体凋亡和铁死亡过程,从而在肾脏保护中发挥重要作用,这也与Aydin等[23]研究结果基本一致。过氧化氢、单线态氧、超氧阴离子自由基和羟自由基是ROS的主要形式,ACSL4可催化长链脂肪酸和辅酶A形成脂酰辅酶A,抑制ACSL4可抑制硒蛋白GPX的表达,下调SLC7A11、FTH1和Keap1等的表达,特异性清除磷脂过氧化氢从而抑制铁死亡[24]。铁死亡作为铁离子依赖的细胞氧化性死亡方式,下调GPX4、SLC7A11、FTH1和Keap1等的表达可使细胞内的脂质氧化物无法通过这些分子进行谷胱甘肽还原反应[25],导致ROS的大量沉积,线粒体细胞膜断裂,超氧化物水平增多,氧化还原失衡,细胞发生程序性死亡[26]。虫草素作为冬虫夏草和蛹虫草等中草药虫草属真菌的主要活性成分之一,具有降血脂、抗炎、抗肿瘤、抗病毒、抗氧化应激、清除自由基、抑制微生物生长和调节免疫等药理作用,在多种炎症性疾病和恶性肿瘤疾病中发挥关键效应[27-28]。最新研究发现,虫草素可通过改善肾缺血再灌注大鼠氧化应激状态,抑制肾上皮细胞增殖和分化,改善肾小球滤过率[29]。在本次研究中,虫草素可上调GPX4、SLC7A11等蛋白表达水平,下调ACSL4、Nrf2等蛋白表达水平,抑制Fe2+积累,使线粒体膜电位发生改变,影响线粒体膜通透性和电位去极化[30],抑制细胞内活性氧的积累,加速脂质代谢,维持氧化还原反应平衡,抑制铁死亡过程的发生,减少肾脏细胞凋亡水平,发挥保护模型大鼠肾功能的作用[31]。
综上所述,虫草素可调节铁死亡相关蛋白的表达,抑制氧化应激反应、活性氧生成、Fe2+积累,降低铁死亡和细胞凋亡,从而有效保护肾缺血再灌注损伤大鼠肾功能,本研究为虫草素应用于肾缺血再灌注损伤的治疗提供了更多数据支持,值得临床参考借鉴。
