基于PI3K/Akt/NF-κB 信号通路探讨高尿酸血症合并非酒精性脂肪肝机制
2023-12-13龚晓红李松伟李武上雯陆超群陈一鸣
龚晓红李松伟李 桓*武上雯陆超群陈一鸣
(1.河南中医药大学,郑州 450046;2.河南省中医院(河南中医药大学第二附属医院),郑州 450002;3.河南中医药大学第一附属医院,郑州 450000;4.江苏省泗阳康达医院,江苏 宿迁 223798)
高尿酸血症(hyperuricemia,HUA)是以血液中尿酸水平增高为特征的一种代谢性疾病,是嘌呤代谢异常所致的代谢紊乱,严重者可发展为痛风[1]。非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是肝组织脂肪堆积导致的病理改变,可表现为肝细胞脂肪变性和脂肪性肝炎,疾病发展末期会形成肝硬化,有的发展为肝癌[2-3]。 近年来,我国人民生活水平不断得到提高,研究发现NAFLD 和HUA 患病率都呈现增高的趋势[1,4]。 研究发现二者不仅与血脂紊乱、肥胖、高血压、2 型糖尿病等疾病相关,而且还是心血管等疾病的重要危险因素[5]。 HUA 与NAFLD 二者之间关系紧密[6]。 研究发现HUA 人群中NAFLD 的患病率显著高于非HUA 人群,NAFLD 的病变程度也与血尿酸水平密切相关[7-8]。
PI3K/Akt 和NF-κB 信号通路在免疫和炎症反应中发挥着重要作用[9-10]。 研究发现该信号通路分别与HUA 和NAFLD 发病密切相关[11-15],但尚无基于该通路探索高尿酸血症合并非酒精性脂肪肝(hyperuricemia with nonalcoholic fatty liver disease,HUA-NAFLD)机制的相关研究。 本实验通过PI3K/Akt/NF-κB 信号通路探讨HUA、NAFLD 及HUANAFLD 之间关系,探讨其发病机制,为未来研究该病药物治疗靶点提供一定理论依据。
1 材料和方法
1.1 实验动物
雄性SPF 级SD 大鼠72 只,体重(200±10)g,购自济南朋悦实验动物繁育有限公司[SCXK(鲁)2019-0003]。 在河南省中医院(河南中医药大学第二附属医院)中心实验室IVC 系统动物室[SYXK(豫)2016-0009]饲养。 光照为昼夜各12 h,自由饮食,湿度60%~70%,温度20 ~25℃。 本实验通过河南省中医院实验动物伦理委员会审批(AF/SC-21/01.0),遵守3R 原则。
1.2 主要试剂与仪器
氧嗪酸钾(美国sigma 公司,批号STBJ5376);高酵母高脂饲料:48.5%的基础饲料+10%糖、脂肪、酵母提取物,10.4%蛋白质,2%胆固醇和5%蛋黄粉等;高脂饲料:58.5%基础饲料+10% 糖、脂肪,10.4%蛋白质,2%胆固醇和5%蛋黄粉等(江苏省协同医药生物工程有限公司提供);羧甲基纤维素钠(郑州派尼化学试剂厂,批号20191107);油红O 染液、苏木素染液、分化液、返蓝液(Servicebio 公司);HE 试剂盒(武汉赛维尔生物科技有限公司,货号G1076);兔抗大鼠GAPDH 抗体(CST 公司,货号4970S);一抗兔抗大鼠PI3K(p85)、AKT、p-PI3K(pp85)、 p-Akt、 p65、 p-p65、 IκκB、 p-IκκB 抗 体(Immunoway 公司,货号YM3503、YT0185、YP0765、YP0006、YT3108、YP0191、YT2303、YP0637);SDSPAGE 凝胶制备试剂盒(上海雅酶生物医药科技有限公司,货号PG113);RIPA 组织裂解液(北京索莱宝科技有限公司,货号R0010);BCA 蛋白浓度测定试剂盒、ECLPlus 超敏发光液、蛋白上样缓冲液(北京索莱宝科技有限公司,货号PC0020、PE0010、P1040); PVDF 膜(德 国 Millipore 公 司, 货 号IPVH00010)。 脱水机、包埋机、病理切片机、组织摊片机(湖北惠达仪器有限公司);冰冻切片机(Thermo 公司);正置光学显微镜成像系统(日本尼康)。
1.3 实验方法
1.3.1 HUA-NAFLD 模型制备、分组及给药
将72 只SD 大鼠随机分为空白组(Blank group)、HUA 组、NAFLD 组、HUA-NAFLD 组,每组16 只。 参照文献[16-17]对3 个模型组进行造模:空白组予普通饲料喂养;NAFLD 组予高脂饲料喂养;HUA 组予氧嗪酸钾乳悬液100 mg/(kg·d)皮下注射;HUA-NAFLD 组予高酵母高脂饲料喂养+氧嗪酸钾乳悬液100 mg/(kg·d)皮下注射;空白组和NAFLD 组皮下注射等量生理盐水。 所有大鼠均自由饮水、进食,记录其精神状态、体重、饮食情况。于第6 周末每组随机处死2 只进行检测,模型成功后继续原饲料喂养,并分别于第8 周和第12 周末取材(每组8 只)。
1.3.2 大鼠体重、肝指数计算
大鼠麻醉后,对肝组织进行分离,生理盐水漂洗2 遍,滤纸吸干后称重,记录重量并计算肝指数。大鼠肝指数(%)=肝重量/体重×100%。
1.3.3 生化指标检测
半自动生化分析仪检测血清中尿酸(uric acid,UA)、 肌 酐(creatinine, CREA)、 尿 素 氮(urea,UREA)、 谷 丙 转 氨 酶(alanine aminotransferase,ALT)、 谷 草 转 氨 酶( aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、高密度脂蛋白(high-density lipoprotein, HDL)、 低 密 度 脂 蛋 白( low-density lipoprotein,LDL)数值。
1.3.4 HE 和油红O 染色法观察肝组织病理变化
取0.5 cm×0.5 cm×0.5 cm 大小的肝组织,固定液固定24 h,石蜡包埋,切约4 μm 厚的切片。 HE染色后,每张切片选取3 个视野在光学显微镜下观察肝病理学改变。 制作肝冰冻切片,入油红染O 液浸染8~10 min,60%异丙醇分化,苏木素复染,返蓝液返蓝,然后封片,显微镜下镜检。
1.3.5 Western blot 检测肝组织PI3K/Akt 和NF-κB 信号通路中相关蛋白
取肝组织100 mg,加入匀浆珠和裂解液进行匀浆和裂解。 裂解完全后收集上清,检测蛋白浓度。加入5×蛋白上样缓冲液,沸水浴15 min 变性。 经凝胶电泳分离蛋白,转膜,封闭液封闭,加入一抗AKT、p-Akt、PI3K、p-PI3K、p65、p-p65、IκκB、p-IκκB均按照1 ∶1 000 进行稀释,4℃孵育过夜,PBST 洗膜10 min 3 次,加入二抗(1 ∶10 000),室温孵育2 h,PBST 洗膜10 min 3 次,洗去二抗。 加入ECL 溶液充分反应,暗室曝光,显影。 目标条带的灰度值采用Image J 软件进行分析。
1.4 统计学方法
采用Graph prism 8.0.2 软件进行统计分析,以平均数±标准差(±s)表示计量资料,若符合正态分布,则采用单因素方差进行组间比较,采用LSD 检验进行组内比较,以P<0.05 为差异具有统计学意义。
2 结果
2.1 大鼠体重及肝指数变化
由图1 可知,各组大鼠体重均随时间推移而增加;在第12 周末,与空白组比较,NAFLD、HUANAFLD 组大鼠体重升高(P<0.05,P<0.01);与HUA 组比较,HUA-NAFLD 组大鼠体重升高(P<0.05)。 与空白组比较,NAFLD、HUA-NAFLD 组大鼠肝指数升高(P<0.05,P<0.01);与HUA 组比较,NAFLD、HUA-NAFLD 组 大 鼠 肝 指 数 升 高(P<0.01);与NAFLD 组比较,HUA-NAFLD 组大鼠肝指数升高(P<0.01)。
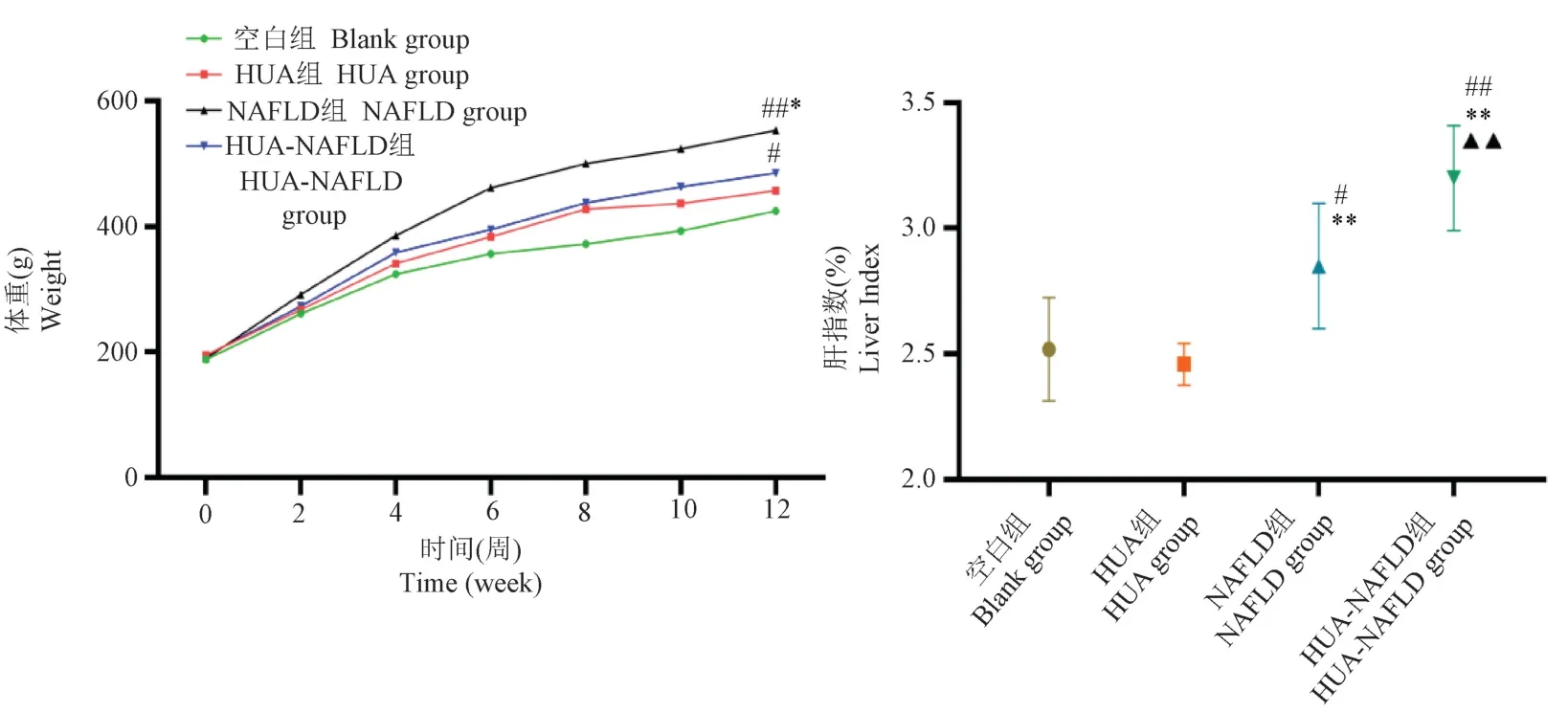
注:第12 周末,与空白组比较, #P<0.05, ##P<0.01;与HUA 组比较, *P<0.05, **P<0.01;与NAFLD 组比较, ▲▲P<0.01。图1 体重和肝指数比较Note.At the end of 12 weekends, compared with the Blank group, #P<0.05, ##P<0.01.Compared with the HUA group, *P<0.05,**P<0.01.Compared with the NAFLD group, ▲▲P<0.01.Figure 1 Comparison of body weight and liver index
2.2 各组大鼠血清生化指标比较
由图2 可知,HDL 随时间推移而下降,其余指标随时间推移均升高。 由表1 可知,在第12 周末,与空白组比较,HUA 组UA、LDL 水平升高,NAFLD组HDL 水平降低,HUA-NAFLD 组UA、TC、TG、LDL水平升高,HDL 水平降低(P<0.05,P<0.01);与HUA 组 比 较,NAFLD 组UREA 水 平 降 低(P<0.05);与HUA-NAFLD 组比较,HUA 组TC、TG、LDL 水平降低,NAFLD 组UA、TG、LDL 降低(P<0.05,P<0.01)。
表1 各组生化指标比较(±s)Table1 Comparison of biochemica lindexes in each group

表1 各组生化指标比较(±s)Table1 Comparison of biochemica lindexes in each group
注:与空白组比较, #P<0.05, ##P<0.01;与HUA-NAFLD 组比较, *P<0.05, **P<0.01;与HUA 组比较, ▲P<0.05。Note.Compared with the Blank group, #P<0.05, ##P<0.01.Compared with the HUA-NAFLD group, *P<0.05, **P<0.01.Compared with the HUA group, ▲P<0.05.
G组ro别ups UREA(mmol/L) UA(μmol/L) TC(mmol/L) TG(mmol/L) HDL(mmol/L) LDL(mmol/L)Bla空nk白g组roup 6.79±0.27 84.38±8.50 2.88±0.14 0.90±0.034 0.68±0.038 0.20±0.02 H HUUAA g r组oup 7.53±0.25 133.80±6.00## 2.97±0.18* 0.89±0.061** 0.6±0.03036 0.29±0.02#**N NAAF L FDL D g r组oup 6.13±0.28▲** 106.00±11.31** 3.38±0.16 0.85±0.053** 0.56±0.022# 0.25±0.01**H HUUAAN-N A A FL FDL D g r组oup 7.95±0.41 153.60±9.48## 3.69±0.14## 2.05±0.18## 0.51±0.02## 0.53±0.03##

图2 生化指标比较Figure 2 Comparison of biochemical indexes
2.3 肝组织病理变化
HE 染色显示,空白组大鼠肝细胞分布均匀,排列整齐,大小匀称,肝窦正常,无细胞核偏移和脂肪变性;HUA-NAFLD 组大鼠肝细胞出现大量脂肪空泡,呈明显气球样变,大量脂肪空泡将细胞核挤向一侧,肝索结构模糊;NAFLD 组肝细胞细胞质中出现广泛脂肪空泡,但较HUA-NAFLD 组明显减少,细胞核未发生偏移;HUA 组肝细胞细胞质中可见少量脂肪空泡,肝索结构尚清楚(见图3)。 油红O 染色显示,空白组肝油红O 切片中未观察到红色脂滴;HUA 组第12 周末肝油红O 切片中可观察到微小的红色脂粒;NAFLD 组肝组织可见弥漫红色脂滴,红色脂滴较HUA-NAFLD 组偏小;HUA-NAFLD 组可见明显增多的较大的红色脂滴,呈颗粒状和弥漫性(见图4)。

图3 肝组织HE 染色Figure 3 HE staining of liver tissue
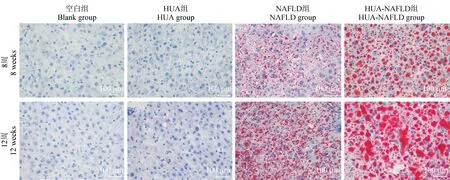
图4 肝组织油红O 染色Figure 4 Oil red O staining of liver tissue
2.4 肝组织PI3K/Akt 和NF-κB 信号通路中相关蛋白的表达水平
Western blot 结果显示:与空白组比较,NAFLD组p-Akt/Akt、 p-p65/p65 水 平 显 著 升 高, HUANAFLD 组p-Akt/Akt、p-PI3K/PI3K、p-p65/p65、p-IκκB/IκκB 水平显著升高(P<0.05,P<0.01);与HUA-NAFLD 组比较,HUA、NAFLD 组p-Akt/Akt、pp65/p65 水平显著下降,HUA 组p-IκκB/IκκB 水平显著下降(P<0.05,P<0.01);与HUA 组比较,NAFLD 组p-p65/p65 水平显著升高(P<0.05)(见图5)。

注:与空白组比较, #P<0.05, ##P<0.01;与HUA-NAFLD 组比较, *P<0.05, **P<0.01;与HUA 组比较, ▲P<0.05。图5 肝组织PI3K/Akt 和NF-κB 信号通路中相关蛋白的表达水平Note.Compared with the Blank group, #P<0.05, ##P<0.01.Compared with the HUA-NAFLD group, *P<0.05, **P<0.01.Compared with the HUA group, ▲P<0.05.Figure 5 Expression levels of related proteins in PI3K/Akt and NF-κB signaling pathways in liver tissue
3 讨论
HUA 和NAFLD 都属于代谢性疾病范畴,目前临床上主要应用降尿酸与降脂保肝等药物联合来治疗HUA-NAFLD[1]。 由于西药作用单一,副作用明显,使得患者依从性降低,特别是无症状HUA 患者,给临床用药增加了难度[8]。 HUA 与NAFLD 在临床中常相伴发生,但二者在疾病的发生和发展中是否互相影响,目前在其作用机制方面研究尚浅,应当加深其研究程度。 高尿酸血症是脂肪性肝病和其他代谢并发症患者的常见疾病,目前被认为是代谢功能障碍的生物标志物。 已有研究表明,高脂饮食会导致血浆甘油三酯和胆固醇显著升高,同时增加尿酸浓度[18],精确阐明尿酸升高在NAFLD 发生的具体机制可能有助于将降尿酸治疗作为预防NAFLD 的新靶点。 另一方面,若尿酸的升高其实是机体对NAFLD 所产生疾病效应的一种自我保护,对NAFLD 患者进行外源性补充尿酸也许可以变成治疗NAFLD 的一种新思路。
在PI3K/Akt/NF-κB 信号通路中,AKT 作为一种丝苏氨酸激酶,是PI3K/Akt 信号传导通路下游的重要靶激酶,经过PI3K 磷酸化激活后可进一步使其下游信号传导细胞因子Iκκs 磷酸化[10,19]。 Iκκ属于丝/苏氨酸蛋白激酶复合体,一般情况下,NFκB 与IκB 结合存在于胞质中,磷酸化后的Iκκ 可通过泛素化或磷酸化激活IκB,使之与NF-κB 解离,从而使NF-κB 发生核转位[20]。 NF-κB 是一种转录因子,在炎症进展过程中发挥核心作用,其激活后可诱发机体产生C 反应蛋白、肿瘤坏死因子-α 等炎性因子,诱发炎症反应[9,21]。 大量研究显示,PI3K/Akt/NF-κB 信号通路与HUA 和NAFLD 的发生有密切联系。 谢婷妃[14]研究发现高尿酸环境可使PI3K/Akt/NF-κB 信号通路相关蛋白表达水平上调,引发炎性细胞因子水平升高,导致人肾小管上皮细胞损伤。 抑制PI3K/Akt 和NF-κB 信号通路可降低HUA 模型鼠UA、CREA、UREA,改善大鼠肾组织病理形态学改变,保护HUA 模型鼠肾损伤[13,22]。抑制该通路还可以降低肝中TC、TG 含量,改善肝细胞脂肪变性和炎细胞浸润,从而减轻NAFLD 产生的效应[12,15,21]。 因此,PI3K/Akt/NF-κB 信号通路的激活可能使肝肾功生化指标改变,加重肝肾组织病理改变,从而发挥其疾病效应。
本研究结果发现,与HUA-NAFLD 组比较,HUA组TC、TG、LDL 水平降低,NAFLD 组UA、TG、LDL降低。 HE 结果显示,HUA-NAFLD 组大鼠肝细胞出现大量脂肪空泡,呈明显气球样变,大量脂肪空泡将细胞核挤向一侧,肝索结构模糊;油红O 染色显示,HUA-NAFLD 组可见明显更多的大红色脂滴,呈颗粒状和弥漫性,病变程度较NAFLD 组和HUA 组更加严重。 Western blot 结果显示,与空白组比较,NAFLD 组、HUA-NAFLD 组PI3K/Akt/NF-κB 信号通路中相关蛋白的磷酸化水平显著升高;与HUA 组比较,NAFLD 组p65 磷酸化水平显著升高;与HUA、NAFLD 组 比 较,HUA-NAFLD 组PI3K/Akt/NF-κB信号通路相关蛋白磷酸化水平也显著升高。
综上所述,通过对空白组、HUA、NAFLD 以及HUA-NAFLD 模型鼠的生化指标、肝病理及PI3K/Akt/NF-κB 信号通路进行探究,本研究发现PI3K/Akt/NF-κB 信 号 通 路 可 能 在HUA、NAFLD 以 及HUA-NAFLD 发病过程中发挥重要作用,对该病的发病机制及治疗靶点可提供实验依据。
