基于HIF-1α/自噬途径探讨二氯化钴调控3T3-L1脂肪细胞炎症反应及胰岛素抵抗的机制
2023-12-13岳欣欣付洋李怡然尹晓燕于飞傅全威
岳欣欣付 洋李怡然尹晓燕于 飞傅全威
(1.辽宁何氏医学院,沈阳 110000;2.北部战区总医院,沈阳 110000;3.东莞康华医院,广东 东莞 523080)
细胞自噬(autophagy)是细胞在生理、营养匮乏等应激条件影响下,通过自噬溶酶体途径,将胞质内受损的细胞器和过度积累的脂质等成分降解的生物学过程[1]。 近年来,通过不同的干预方法调控自噬活性,研究其对肥胖和糖尿病疾病的影响成为学者们关注的热点[2-5]。 缺氧是诱导自噬发生的常见方法之一,然而缺氧诱导的自噬激活是把双刃剑,它既可以发挥保护作用,也可以发挥加重细胞损伤的作用[6-7]。 因此,本研究在低氧诱导剂CoCl2干预条件下模拟体外缺氧环境,以3T3-L1 诱导为成熟脂肪细胞为细胞模型,基于HIF-1α/自噬途径,探讨低氧诱导剂CoCl2调控脂肪细胞自噬活性,发挥自噬的保护作用,阐明其使脂肪细胞免受炎症损伤和改善胰岛素抵抗的分子机制。
1 材料和方法
1.1 细胞株
3T3-L1 前脂肪细胞购自ATCC(XY-XB-1608)。
1.2 主要试剂与仪器
DMEM 不完全培养液和胰蛋白酶-EDTA 消化液(Keygen);CoCl2(Sigma);MTT(Aladdin);抗体: HIF-1α(BD, 美国)、LC3B(Cell Signaling Technology, 美国)、Belin-1 (Santa Cruz, 美国)、β-actin (Abcam,美国) 。 Western blot 及IP 细胞裂解液、蛋白上样缓冲液、地塞米松溶液、胰岛素、1-甲基-3-异丁基-黄嘌呤(IBMX)、FBS 胎牛血清均购自上海碧云天生物技术有限公司。
超净工作台购自江苏通净净化设备有限公司;CO2细胞培养箱,购自美国NUAIRE 公司;高速低温离心机,购自英国Dynamica 公司;PCR 仪及荧光定量系统购自美国BIO-RAD 公司;蛋白质电泳和转移系统购自美国BIO-RAD 公司;Olympus CKX41 显微镜、CKX53 倒置相差显微镜、BX63 自动荧光显微镜购自日本Olympus 公司。
1.3 实验方法
1.3.1 细胞培养和诱导分化
3T3-L1 前脂肪细胞用含10%小牛血清、4 mmol/L L-谷氨酰胺、100 U/mL 青霉素、链霉素的DMEM 高糖培养液培养。 细胞融合近80%~90%开始诱导分化,加入含10%胎牛血清(FBS)、0.5 mmol/L IBMX、1 μmol/L 地塞米松和10 mg/L 胰岛素的DMEM 高糖培养液培养48 h, 再换为含10%FBS、10 mg/L 胰岛素的DMEM 高糖培养液继续培养48 h, 随后以10% FBS 的高糖DMEM 继续培养,诱导8~12 d 后进行实验。 当观察到90%以上的细胞变圆并有大量脂滴出现,说明3T3-L1 被诱导为成熟的脂肪细胞[8]。
1.3.2 分组与干预措施
将诱导分化的成熟脂肪细胞,给予不同浓度(50、100、150、200、400 μmol/L)和不同时间(0、12 h、24 h、48 h)CoCl2处理,分析CoCl2干预脂肪细胞的浓度和时间,根据此结果,将成熟的脂肪细胞分为0 h 组(对照组)和CoCl2干预12 h 组、24 h 组、48 h 组。
1.3.3 细胞存活率检测(MTT 法)
将脂肪细胞按照一定的浓度接种于96 孔中,每组设置6 个平行孔,每孔加入100 μL 细胞悬浮液,培养至细胞个数接近1×104/孔时,按照分组需求加入药物干预。 然后每孔加入10 μL 浓度为5 mg/mL的MTT 溶液,放入细胞培养箱中继续培养4 h 后弃去培养基,每孔加入150 μL DMSO,放在摇床上低速摇晃10 min,最后用酶联免疫检测仪测定每孔在490 nm 处的吸光值。
1.3.4 Western blot 检测
按照Western blot 细胞裂解液说明书提取蛋白,用BCA 试剂盒检测蛋白浓度。 取30 μg 蛋白样品进行SDS-PAGE 凝胶电泳,转移到PVDF 膜上后用5% BSA 或5%脱脂奶粉室温封闭2 h,然后与各种一抗在4℃孵育过夜。 一抗稀释度分别为:HIF-1α(1 ∶500) 、LC3-Ⅱ (1 ∶500) 、Beclin-1 (1 ∶200) 、Glut-1(1 ∶500)和β-actin (1 ∶4000)。 TBS 洗涤3次后加入二抗,室温摇床2 h 后,加入ECL 发光液反应,曝光后拍照分析。
1.3.5 细胞免疫荧光检测
采用LC3B 自噬荧光检测试剂盒检测脂肪细胞中自噬活性水平。 将细胞以3.5×104/mL 接种于共聚焦培养皿,诱导分化成熟。 实验分组和干预措施同1.3.2,用甲醛∶丙酮(1 ∶1)固定细胞,LC3B 兔多克隆抗体0.5 μg/mL 37℃孵育1 h, 山羊抗兔IgG 0.01 mg/mL 37℃孵育30 min, 抗荧光淬灭剂封片,应用激光共聚焦显微镜拍照。
1.3.6 ELISA 法检测细胞上清液炎症因子的水平
取各组培养液上清,离心(1000 r/min,20 min),去除细胞碎片,保存于-20℃冰箱,按照ELISA 试剂盒说明书步骤,检测脂肪细胞培养液上清中TNF-α、IL-6 的水平。
1.4 统计学方法
采用Graphpad prism 8.0 软件进行数据分析和绘图。 对连续型数值变量用平均数±标准差(±s)表示,所用分析方法为单因素方差分析,对符合正态性和方差齐性的检验,组间两两比较采用LSD-t检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 不同浓度和不同时间CoCl2 对脂肪细胞存活情况的影响
用MTT 法检测不同浓度和不同时间CoCl2对脂肪细胞存活情况的影响,结果见图1,随着干预时间的增加,不同CoCl2浓度组脂肪细胞均出现存活率下降的趋势,随着CoCl2浓度的增加,同一时间段脂肪细胞的存活率也随之降低,这提示脂肪细胞存活率与CoCl2浓度变化、干预时间存在剂量依赖和时间依赖的变化趋势。 不同浓度CoCl2干预脂肪细胞12 ~24 h 时,细胞存活率开始出现下降趋势,但是下降趋势不明显。 干预24 ~48 h 时脂肪细胞存活率出现明显下降趋势,这提示干预24 h 是潜在的时间节点。 用50、100、150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 时,细胞存活率出现下降的趋势,但不显著,而用200、400 μmol/L 浓度的CoCl2干预脂肪细胞24 h,细胞存活率出现显著降低的趋势。这提示150 μmol/L 浓度的CoCl2是干预脂肪细胞模拟适度缺氧环境的最佳浓度。

图1 不同浓度不同时间CoCl2 对脂肪细胞存活率影响Figure 1 Effect of different concentration and time of CoCl2 on the survival rate of adipocytes
2.2 CoCl2 对脂肪细胞中HIF-1α、LC3-Ⅱ、Beclin-1、Glut-1 蛋白表达水平的影响
根据2.1 实验结果,选取150 μmol/L 的CoCl2对脂肪细胞分别干预0 h、12 h、24 h、48 h,检测脂肪细胞中HIF-1α、LC3-Ⅱ、Beclin-1、Glut-1 蛋白的表达水平,结果如图2 所示,与0 h 组(对照组)相比,12 h 和24 h 组LC3-Ⅱ、Beclin-1 蛋白表达水平增高,且具有统计学意义(P<0.05),与12 h 组相比,24 h 组LC3-Ⅱ、Beclin-1 蛋白表达水平增高,且具有统计学意义(P<0.05),这一结果提示12~24 h 自噬相关蛋白表达增加,自噬水平增加,24 h 自噬水平增加最为显著。 与0 h 组(对照组)相比,12 h 和24 h 组HIF-1α、Glut-1 蛋白表达水平增高,且具有统计学意义(P<0.05),与12 h 组相比,24 h 组HIF-1α、Glut-1 蛋白表达水平增高,且具有统计学意义(P<0.05),这一结果提示缺氧12 ~24 h 时HIF-1α 及其下游的Glut-1 蛋白表达水平开始增加,且与自噬增加水平一致,自噬水平增加可能以依赖HIF-1α 方式存在。

注:与0 h 组相比, *P<0.05;与12 h 组相比, #P<0.05。图2 不同时间CoCl2 对脂肪细胞中HIF-1α、LC3-Ⅱ、Beclin-1 和Glut-1 蛋白的表达的影响Note.Compared with 0 h group, *P<0.05.Compared with 12 h group, #P<0.05.Figure 2 Effects of CoCl2 on the expressions of HIF-1α,LC3-Ⅱ,Beclin-1 and Glut-1 in adipocytes of different times
2.3 CoCl2 对脂肪细胞自噬水平的影响
采用LC3B 自噬免疫荧光检测试剂盒检测脂肪细胞自噬水平,结果见图3,与0 h 组(对照组)相比,24 h 组自噬水平显著增加,12 h 和48 h 组自噬水平无显著变化。 这一结果提示150 μmol/L 的CoCl2干预脂肪细胞24 h,自噬活化水平最为显著,与自噬相关蛋白LC3-Ⅱ、Beclin-1 表达水平一致。
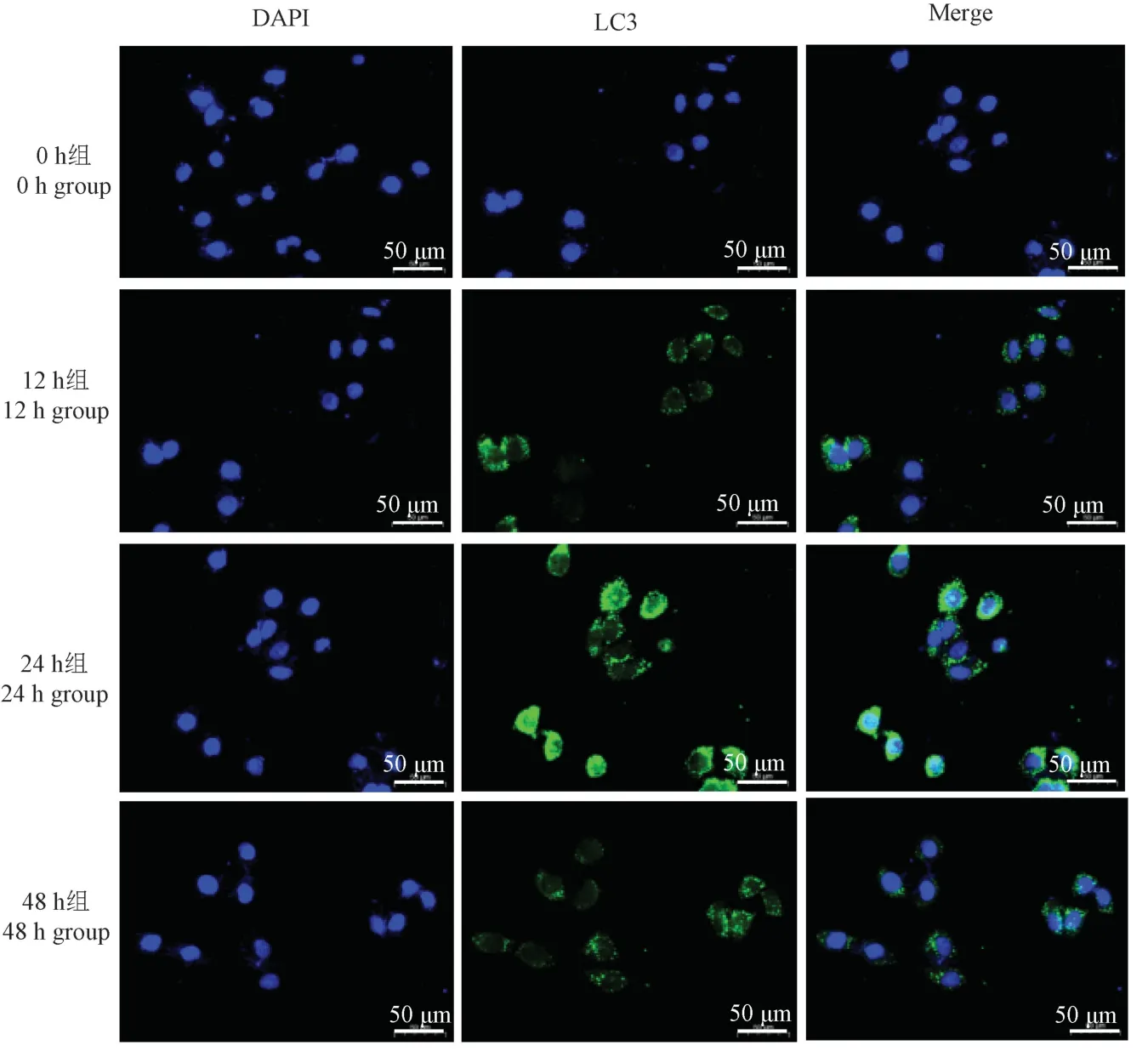
图3 免疫荧光检测LC3B 的表达情况Figure 3 Results of LC3 positive cell staining in each group
2.4 CoCl2 对脂肪细胞中炎症因子TNF-α、IL-6水平的影响
检测脂肪细胞上清液中炎症因子TNF-α、IL-6的水平,结果见图4,与0 h 组(对照组)相比12 h 和24 h 组细胞中炎症因子TNF-α、IL-6 水平无明显增加,无统计学意义(P>0.05),48 h组细胞中炎症因子TNF-α、IL-6 水平显著增加,且有统计学意义(P<0.05)。 与12 h 组相比,24 h 组细胞中炎症因子TNF-α、IL-6 水平无明显增加,无统计学意义(P>0.05),48 h 组细胞中炎症因子TNF-α、IL-6 水平显著增加,且有统计学意义(P<0.05)。 这一结果提示缺氧干预12 ~24 h 时是适度缺氧条件下,自噬水平增加以依赖HIF-1α 的方式增加的同时,自噬发挥保护细胞的作用,减轻了细胞炎症因子的水平。

注:与0 h 组相比, *P<0.05;与12 h 组相比, #P<0.05。图4 脂肪细胞上清液中炎症因子TNF-α 和IL-6 的水平Note.Compared with 0 h group, *P <0.05.Compared with 12 h group, #P<0.05.Figure 4 Effects of CoCl2 on the expressions of TNF-α and IL-6 in culture supernatants of adipocytes
3 讨论
体外模拟缺氧环境,诱导细胞缺氧常用二氯化钴(CoCl2),其主要机制是二价钴离子可诱导细胞低氧诱导因子(hypoxia induced factor,HIF)及其调控的下游基因的表达[9]。 因此,故本研究以此为依据将3T3-L1 细胞暴露于二氯化钴作用条件下观察细胞在缺氧应激条件下的生物学变化情况,本研究结果发现,随着CoCl2干预细胞时间的增加,不同CoCl2浓度组脂肪细胞均出现存活率下降的趋势,随着CoCl2浓度的增加,同一时间段脂肪细胞的存活率也随之降低,这提示脂肪细胞存活率与CoCl2浓度变化、干预时间存在剂量依赖和时间依赖的变化趋势。 12 ~24 h 时段,用不同浓度CoCl2干预脂肪细胞时,细胞存活率开始出现下降趋势,但是下降趋势不明显。 24 ~48 h 时段,用不同浓度CoCl2干预脂肪细胞时,脂肪细胞存活率出现明显下降趋势,这提示CoCl2干预脂肪细胞24 h 是潜在的影响脂肪细胞存活率的时间转折点。 再观察24 h 时,用50、100、150 μmol/L 浓度的CoCl2干预脂肪细胞,脂肪细胞存活率开始出现下降的趋势,但是不显著,用200、400 μmol/L 浓度的CoCl2干预脂肪细胞,脂肪细胞存活率出现显著降低的趋势,这提示150 μmol/L 浓度的CoCl2是干预脂肪细胞模拟适度缺氧环境的最佳浓度,这一结果与既往研究结果相似[10]。
缺氧是诱导自噬发生的最常见原因之一[11]。缺氧后HIF-1α 被活化,如果自噬以依赖HIF-1α 活化的方式发生,将有助于抵御缺氧损伤,维持细胞稳态;如果自噬以不依赖HIF-1α 活化的方式被激活,将促进细胞损伤和凋亡,既往多项研究基于此探讨如何调控自噬来达到治疗疾病的作用[12-18]。鉴于此,本研究预探讨150 μmol/L 浓度的CoCl2干预脂肪细胞是否可调控自噬以依赖HIF-1α 活化的方式发生,发挥自噬保护细胞的作用。 因此,阐明HIF-1α/自噬途径的关键分子信号通路是本研究的关键所在。 本研究选取150 μmol/L 浓度的CoCl2分别于0 h、12 h、24 h、48 h 干预脂肪细胞,探索HIF-1α 及其下游的Glut-1 蛋白、自噬相关蛋白LC3-Ⅱ、Beclin-1 表达水平,本研究结果发现,与0 h组(对照组)相比,24 h 组自噬相关蛋白LC3-Ⅱ、Beclin-1 表达水平显著增加,HIF-1α 及其下游的Glut-1 蛋白表达水平也显著增加,且增加水平明显高于其他组,由此结果我们推测自噬的活化是以依赖HIF-1α 活化的方式发生的,进一步说明150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 是调控自噬活化的最佳干预条件,且在此干预条件下自噬以依赖HIF-1α 方式的活化,发挥其保护细胞的作用。与此同时,本研究进一步通过免疫荧光技术检测自噬活性,结果发现,与0 h 组(对照组)相比,24 h 时自噬活化水平显著增加,且最为显著,这一研究结果与24 h 时自噬相关蛋白LC3-Ⅱ、Beclin-1 表达水平一致。 由此,本研究发现,基于HIF-1α/自噬途径,150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 可调控自噬活化发挥保护细胞的作用。 既往研究发现150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 后,脂肪细胞开始出现凋亡表现,凋亡的相关蛋白p53、Bcl-2 和caspase-9 等表达增加[10],这项研究从另一个方向说明24 h 后自噬开始发挥促进细胞损伤和凋亡的作用,也从另一个方向证实了本研究的结果是与其一致的。
既往研究证实,与瘦体重人群相比,肥胖人群脂肪组织中自噬相关蛋白LC3 的表达水平增高,且与脂肪组织炎状态和胰岛素抵抗密切相关,但是对于肥胖状态下脂肪细胞自噬活性和炎症状态的变化存在争议[4,19]。 基于上述理论,为进一步说明基于HIF-1α/自噬途径,150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 可调控自噬活化发挥保护细胞的作用与抑制脂肪细胞炎症因子的分泌相关。 本研究采用150 μmol/L 浓度的CoCl2干预脂肪细胞0 h、12 h、24 h、48 h,分析脂肪细胞中脂肪炎症因子的分泌情况,研究结果发现随着干预时间的延长,脂肪炎症因子TNF-α、IL-6 分泌水平逐渐升高,与0 h 组相比,12 h、24 h 脂肪炎症因子TNF-α、IL-6 分泌水平无显著升高,48 h 时脂肪炎症因子TNF-α、IL-6 分泌水平升高最为显著,这与24 h 时自噬相关蛋白LC3-Ⅱ、Beclin-1 表达水平显著增加趋势相反,也与24 h 时HIF-1α 及其下游的Glut-1 蛋白表达水平显著增加的趋势相反,这提示自噬活性增加时,炎症因子的分泌减少。 这一结果明确了50 μmol/L浓度的CoCl2干预脂肪细胞24 h 可调控自噬活化,抑制脂肪细胞炎症因子的分泌,发挥保护细胞免于炎症损伤的作用。 炎症因子TNF-α 和IL-6 分泌可干扰胰岛素信号通路转导导致胰岛素抵抗[20-21]。由此,本研究可进一步推测150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 可基于HIF-1α/自噬途径激活自噬活性,抑制炎症因子分泌进而改善脂肪细胞的胰岛素抵抗发挥细胞保护作用。
综上所述,本研究发现基于HIF-1α/自噬途径,150 μmol/L 浓度的CoCl2干预脂肪细胞24 h 可调控自噬以依赖HIF-1α 的方式被活化,使脂肪细胞免于进一步的炎症损伤,并改善脂肪细胞的胰岛素抵抗,发挥其保护脂肪细胞的作用。 期望低氧调控自噬成为治疗肥胖、2 型糖尿病的靶点,未来如何更加精准调控细胞的自噬活化强度,分析其治疗肥胖和糖尿病的精确分子机制,仍需要更多更先进深入的研究。
